杜红岩,周嘉南,潘 峰,杨 华,闫振成,倪银星,祝之明,钟 健
(1.第三军医大学大坪医院野战外科研究所 高血压内分泌科,全军高血压代谢病中心,重庆市高血压研究所,重庆 400042;2.第三军医大学科研部 生物医学分析测试中心,重庆 400038)
气相色谱-质谱联用法测定小鼠血清非胆固醇甾醇
杜红岩1,周嘉南1,潘 峰2,杨 华1,闫振成1,倪银星1,祝之明1,钟 健1
(1.第三军医大学大坪医院野战外科研究所 高血压内分泌科,全军高血压代谢病中心,重庆市高血压研究所,重庆 400042;2.第三军医大学科研部 生物医学分析测试中心,重庆 400038)
目的 本研究旨在建立气相色谱-质谱联用法(gas chromatograph-mass spectrometer,GC-MS)测定小鼠血清中非胆固醇甾醇的方法。方法 采集32周龄雄性C57BL/6J小鼠血清,以5α-胆甾烷为内标,经过氢氧化钾乙醇溶液皂化、正己烷萃取、硅烷化试剂衍生等步骤,进行小鼠血清样本进样前处理。运用气相色谱-质谱联用仪对小鼠血清非胆固醇甾醇进行定性及定量分析。配制不同浓度混标溶液进行GC-MS法分析制备标准曲线。制备高、中、低浓度混标溶液与等量小鼠血清混合处理后测定非胆固醇甾醇含量,进行加标回收率、精密度及重复性试验。采用酶比色法测定小鼠血清总胆固醇(total cholesterol,TC)含量。结果 GC-MS法测得小鼠血清角鲨烯(squalene)、去氢胆甾醇(desmosterol)、菜油甾醇(campesterol)、豆甾醇(stigmasterin)和β-谷甾醇(β-sitosterol)的含量依次为(4.52±0.94、1.71±1.57、22.17±9.86、0.69±0.05和8.82±3.92)μg/mL;标准化后角鲨烯/TC、去氢胆甾醇/TC、菜油甾醇/TC、豆甾醇/TC和β-谷甾醇/TC,分别为(5.92±2.06、1.89±2.26、26.52±9.54、0.90±0.18和9.08±5.51)μg/mg,平均加标回收率依次为95.65%、96.75%、99.14%、103.52%和100.57%,日内精密度及重复性试验相对标准偏差(relative standard deviation,RSD)均在5.00%以下。结论 GC-MS法具有检测速度快、结果准确、精密性高和重复性好的优点,可用于实验小鼠血清非胆固醇甾醇的检测,为深入研究实验动物胆固醇合成和吸收的机制提供研究手段。
气相色谱;质谱;非胆固醇甾醇
胆固醇代谢异常与动脉粥样硬化形成密切相关,由此引起的心脑血管疾病严重危害人体健康,因此,针对胆固醇合成与吸收的调控成为当前研究的热点[1-2]。人体中除胆固醇之外的甾醇,通常称为非胆固醇甾醇,其在血清中的含量能够反映机体胆固醇合成与吸收状态,准确测定该类物质在血清中含量对深入研究胆固醇代谢的分子机制至关重要[1,3]。血清非胆固醇甾醇中的角鲨烯、去氢胆甾醇和7-烯胆烷醇可用于反映机体内源性胆固醇的合成效率;而菜油甾醇、豆甾醇和β-谷甾醇可用于反映外源性胆固醇的吸收效率[4]。由于该类物质的结构非常相似,一般的化学方法如毛地黄皂苷法、乙酸酐-浓硫酸比色法等只能测定固醇类物质的总量,很难对多组分的固醇实现分离定量。色谱技术与质谱技术的联用能够更好地将结构相似的不同组分物质进行定性和定量分析,特别是气相色谱-质谱联用(gas chromatograph-mass spectrometer,GC-MS)法在食品安全、环境保护等众多领域广泛应用,引起医学领域研究者的广泛关注[5-6]。目前,已有研究报道采用气相色谱法测定人血清非胆固醇甾醇[7-8],在科学实验中我们常利用小鼠构建胆固醇代谢异常模型并进行相关机制研究,而针对实验动物小鼠的血清非胆固醇甾醇的GC-MS测定方法的研究尚未见报道。为此,本研究建立GC-MS法测定实验小鼠血清非胆固醇甾醇的方法。
1 材料与方法
1.1 血清样本采集与储存 实验用血清样本取自8只32周龄雄性C57BL/6J普食喂养小鼠(重庆大坪医院动物饲养中心),禁食12~16 h,称重后3%异戊巴比妥(0.06 mL/10g)腹腔麻醉,颈动脉取血置于分离胶采血管中,室温静置1 h后3 000转/分钟离心10 min,取血清,-70℃保存备用。
1.2 仪器与试剂 主要仪器:BS-124S电子天平(德国Sartorius公司),ULTRA MK2实验用水仪(英国Veolia Water Systems公司),7890A气相色谱仪(美国安捷伦公司),5975C质谱仪(美国安捷伦公司),2k-15低温离心机(德国Sigma公司),电热恒温水温箱(上海跃进医疗器械有限公司),HYQ-3110震荡混匀仪(美国CTI公司,),BIOBASE系列分立式全自动生化分析仪(济南鑫贝西生物技术有限公司)。主要试剂:5α-胆甾烷(≥97%)、角鲨烯、去氢胆甾醇、7-烯胆烷醇、菜油甾醇、豆甾醇、β-谷甾醇,衍生试剂:N-甲基-N-(三甲基硅基)三氟乙酰胺(MSTFA)、1,4-二硫代赤藓醇(DTE)、(三甲基硅)甲基碘(TMIS)(均购自Sigma公司);正己烷、氢氧化钾、无水乙醇均系色谱纯。
1.3 内标溶液、标准溶液与衍生试剂配制 以无水乙醇为溶剂配制浓度为1 mg/mL的标准品和5α-胆甾烷(内标)储备溶液,-20 ℃保存。配制50 μg/mL内标工作液进行样品浓度测定,配制250 μg/mL内标工作液进行标准曲线制备和加标回收率、精密度试验及重复性试验[9];将角鲨烯、去氢胆甾醇、7-烯胆烷醇、菜油甾醇、豆甾醇、β-谷甾醇配制成7种不同浓度的混标溶液(见表1)。将MSTFA、DTE、TMIS以5 mL∶10 mg∶10 μL的比例进行衍生试剂配制,4 ℃储存。
表1 各种甾醇标准品的浓度系列

标准品名称浓度(μg/mL)角鲨烯12562531251255125025去氢胆甾醇125625312512551250257-烯胆烷醇12562531251255125025菜油甾醇12562531251255125025豆甾醇12562531251255125025β-谷甾醇25012562525102505
1.4 实验步骤
1.4.1 小鼠血清样本处理 将血清样本与内标溶液或混标溶液振荡混匀30 s,加入250 μL的2 mol/L 氢氧化钾乙醇溶液,振荡涡旋30 s,放入到60 ℃温箱,水浴120 min后取出小管,冷却,涡旋30 s。向小管中加入1 mL的正己烷萃取,涡旋30s,20 ℃ 5 000转/分钟离心7 min。取上清液移入EP管中,氮吹仪蒸发、脱水,得残渣。加入50 μL衍生试剂,震荡涡旋30 s,60 ℃,水浴60 min,取出室温、避光冷却,取1 μL以备GC-MS分析[9]。
1.4.2 气相色谱与质谱条件 气相色谱条件:色谱柱为HP-5石英毛细管柱(325 ℃:30 m×250 μm×0.25 μm);以高纯氦气(99.999 %)为载气;设置初始柱温200 ℃,保持3 min,程序升温速率为10 ℃/min ,升至300 ℃,保持7.5 min;设置进样口温度为250 ℃;MSD 传输线温度280 ℃;进样口压力:16.089 psi;不分流模式。质谱条件:采用选择离子检测采集模式,溶剂延迟6.00 min,离子源230 ℃,MS四极杆150 ℃。
1.5 分析方法的考察
1.5.1 小鼠血清各非胆固醇甾醇的定性分析 取按照表1配制的混标溶液1份,精确加入10 μL 250 μg/mL内标工作液和100 μL去离子水,按照1.4.1步骤处理后,按照1.4.2条件进行气相色谱-质谱联用法分析。记录色谱图,对比各非胆固醇甾醇出峰情况和保留时间以及目标离子。
1.5.2 标准曲线制备 按照表1中的溶液浓度制备系列标准品溶液,各取40 μL,分别加入100 μL去离子水和10 μL 250 μg/mL内标工作液,处理后进行气相色谱-质谱联用法分析。以各非胆固醇甾醇与内标物的峰面积比对浓度进行线性回归,求得标准曲线回归方程。以各非胆固醇甾醇与内标物浓度之比为横坐标,非胆固醇甾醇与内标物的峰面积之比为纵坐标,绘制标准曲线。
1.5.3 加标回收率试验 精密量取已配好的高、中、低浓度混标溶液(浓度系列见表2)。取已知非胆固醇甾醇含量的小鼠血清3等份,各加入高、中、低浓度的混标溶液40 μL,精确量取10 μL 250 μg/mL内标工作液,处理后进行气相色谱-质谱联用法分析,连续进样3次,并计算加标回收率,加标回收率(%)=(测定浓度-本底浓度)/加标浓度×100%。
表2 加标溶液浓度系列(μg/mL)

标准品名称高浓度中浓度低浓度角鲨烯600300150去氢胆甾醇400200100菜油甾醇720036001800豆甾醇240120060β-谷甾醇25001000500
1.5.4 精密度试验 取1份小鼠血清样品,精确加入10 μL内标工作液,处理后行气相色谱-质谱联用法分析,连续进样3次,记录各非胆固醇甾醇和内标物的峰面积。
1.5.5 重复性试验 取3份不同小鼠血清样品,精确加入10 μL内标工作液,气相色谱-质谱联用法分析,同日内连续进样3次,记录非胆固醇甾醇和内标物的峰面积。
1.6 小鼠血清非胆固醇甾醇含量测定 取8个处理后的小鼠血清样品,每个样品各取1 μL,进行气相色谱-质谱联用法分析,记录峰面积,计算小鼠血清非胆固醇甾醇含量。
1.7 小鼠血清非胆固醇甾醇含量标准化处理 全自动生化分析仪酶比色法测定小鼠血清总胆固醇(total cholesterol,TC),运用小鼠血清各非胆固醇甾醇含量与TC的比值进行结果标准化。
2 结果
2.1 小鼠血清各非胆固醇甾醇的定性分析 GC-MS法测出小鼠血清中各种非胆固醇甾醇的保留时间依次为:角鲨烯12.1 min,5α-胆甾烷12.4 min,去氢胆甾醇15.1 min,7-烯胆烷醇15.3 min,菜油甾醇15.7 min,豆甾醇16.1 min,β-谷甾醇16.7 min(见图1)。目标离子(m/z)依次为69、217、343、458、343、484、357。

a:角鲨烯; b:5α-胆甾烷; c:去氢胆甾醇; d:7-烯胆烷醇; e:菜油甾醇; f:豆甾醇; g:β-谷甾醇。图1 各非胆固醇甾醇标准品衍生后的GC-MS图谱
2.2 各非胆固醇甾醇标准曲线方程 各个非胆固醇甾醇标准曲线方程(见表3),R2在0.991~1.000,结果显示各甾醇标准品的线性相关性良好。
2.3 加标回收率试验 本研究中角鲨烯、去氢胆甾醇、菜油甾醇、豆甾醇、β-谷甾醇的平均加标回收率依次为95.65%、96.75%、99.14%、103.52%、100.57%,RSD在1.73%~7.83%,RSD<8.00%,提示本方法准确度良好(见表4)。
表3 各种甾醇标准品的曲线方程

甾醇名称标准曲线方程R2角鲨烯Y=00731X-004230992去氢胆甾醇Y=00291X+0013609997-烯胆烷醇Y=00412X-0006861000菜油甾醇Y=00399X+001190997豆甾醇Y=00130X-0004120999β-谷甾醇Y=00505X+004150991
表4 小鼠血清非胆固醇甾醇加标回收率
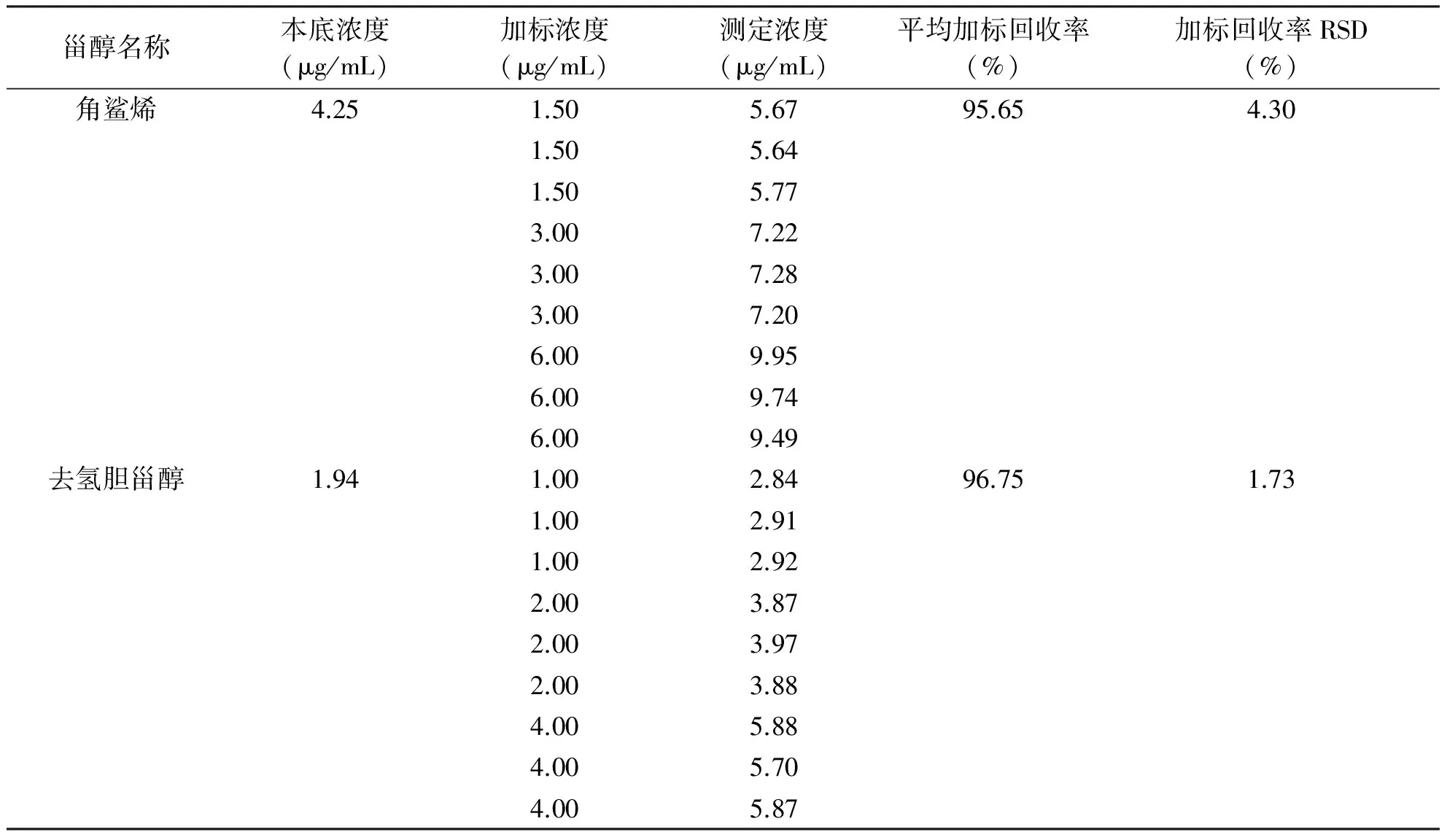
甾醇名称本底浓度(μg/mL)加标浓度(μg/mL)测定浓度(μg/mL)平均加标回收率(%)加标回收率RSD(%)角鲨烯4.251.505.6795.654.301.505.641.505.773.007.223.007.283.007.206.009.956.009.746.009.49去氢胆甾醇1.941.002.8496.751.731.002.911.002.922.003.872.003.972.003.884.005.884.005.704.005.87
续表

甾醇名称本底浓度(μg/mL)加标浓度(μg/mL)测定浓度(μg/mL)平均加标回收率(%)加标回收率RSD(%)菜油甾醇37.6818.0056.3099.147.8318.0055.5818.0057.0936.0068.2436.0071.7736.0070.4272.00111.5672.00105.7972.00119.64豆甾醇0.760.601.41103.523.460.601.310.601.371.201.981.202.001.201.992.403.362.403.252.403.41β-谷甾醇12.645.0018.14100.573.365.0017.685.0017.7310.0022.4010.0022.6010.0022.9225.0038.2125.0036.0425.0036.81
2.4 精密度试验 同一血清样品处理后连续进样3次,各非胆固醇甾醇对内标物的峰面积比值的相对标准偏差(RSD)在0.67%~2.52%,RSD<5.00%,表明该方法精密度较好。
2.5 重复性试验 同一处理批次血清样品连续进样3次,各非胆固醇甾醇对内标物的峰面积比值的RSD在1.29%~3.65%,RSD<5.00%,表明该方法重复性较好。
2.6 小鼠血清非胆固醇甾醇测定结果 小鼠血清非胆固醇甾醇含量结果(见表5),平均胆固醇含量为0.80 mg/mL。并对测定结果进行标准化。结果显示:除7-烯胆烷醇未检测出,其他非胆固醇甾醇均可测出。


名称化合物浓度化合物/总胆固醇μg/mg角鲨烯(μg/mL)452±094角鲨烯/总胆固醇592±206去氢胆甾醇(μg/mL)171±157去氢胆甾醇/总胆固醇189±226菜油甾醇(μg/mL)2217±986菜油甾醇/总胆固醇2652±954豆甾醇(μg/mL)069±005豆甾醇/总胆固醇090±018β-谷甾醇(μg/mL)882±392β-谷甾醇/总胆固醇908±551总胆固醇(mg/mL)080±016——————
3 讨论
胆固醇代谢异常可促进动脉粥样硬化的形成,进而引起心脑血管疾病。改善胆固醇异常代谢、延缓动脉粥样硬化的发生发展已成为目前脂类代谢研究的热点之一[2]。胆固醇在机体中的来源分为合成和吸收两个部分,临床上多采用酶比色法测定血清胆固醇水平,然而胆固醇的升高并不能反映究竟是机体胆固醇合成或是吸收异常,目前主要使用非胆固醇甾醇来反映机体胆固醇代谢平衡,主要包括:血清胆固醇合成标志物(如角鲨烯、去氢胆甾醇、7-烯胆烷醇)及胆固醇吸收标志物(如菜油甾醇、豆甾醇、β-谷甾醇)。因生物体中上述固醇类物质的结构相似且含量甚微,故对其化合物的定性与定量的精确分析成为研究的关键[1]。本研究建立GC-MS测定小鼠血清非胆固醇甾醇的方法,为深入研究胆固醇代谢机制提供技术手段。
目前测定血清非胆固醇甾醇的方法主要有气相色谱法和液相色谱法,但液相色谱法不能有效分离菜油甾醇与豆甾醇[10-11]。气相色谱法具有灵敏度高、选择性好,能有效分离结构相近物质和多组分混合物的优点,且分析速度快、操作简单;质谱分析检测范围广、分辨率高;二者联用更能提高检测的精密度和定量的准确性[12]。本研究建立的GC-MS测定小鼠血清非胆固醇甾醇的方法,在操作过程中特别注意到了以下几点:①为减少操作误差、避免溶剂挥发对实验结果的影响,我们参照文献报道[8],采用内标法和标准曲线法对小鼠血清非胆固醇甾醇含量进行测定;②考虑到人与小鼠存在种属差异,在标准曲线制作时选用了比以往报道[7]更宽的线性范围;③在实验中,我们采用选择性离子扫描技术,确保所测目标峰为特定非胆固醇甾醇,提高了特异性。
本研究中,各物质平均加标回收率均在95.65%~103.52%,RSD均在8.00%以内,说明本测定方法的准确度较好;同日内精密度以及重复性试验的RSD均在5.00%以下,说明该方法的精密度较高、重复性较好。因血清中的非胆固醇甾醇含量较低,在体内由脂蛋白进行转运,为消除脂蛋白含量变化对非胆固醇甾醇检测结果的影响,依据国内外报道[3,13],本研究采用非胆固醇甾醇与总胆固醇的比值对结果进行标准化。实验过程中我们发现小鼠血清中7-烯胆烷醇未被检测出,这与国内报道一致[13],可能系小鼠血清中7-烯胆烷醇的含量甚微或是不存在,同时,测定结果表明小鼠体内反映胆固醇合成和吸收的标志物种类与人体基本一致[3]。
综上所述,我们建立了GC-MS法测定小鼠血清中非胆固醇甾醇的方法,该方法具有检测时间较短、灵敏度高、特异性好、精密性高等特点,为深入进行小鼠胆固醇合成与吸收的研究提供了可靠的检测手段,为更好地在科学实验中以小鼠为模型深入研究人体胆固醇代谢机制奠定基础。
[1] Alphonse P A Jones P J.Revisiting human cholesterol synthesis and absorption:the reciprocity paradigm and its key regulators [J]. Lipids,2016,51(5):519-536.
[2] Bays H E.A lipidologist perspective of global lipid guidelines and recommendations,part 1:Lipid treatment targets and risk assessment [J]. J Clin Lipidol,2016,10(2):228-239.
[3] 白娜,任洁.胆固醇吸收合成标志物研究进展 [J]. 心血管病学进展,2015,3:315-319.
[4] Miettinen T A,Gylling H,Nissinen M J.The role of serum non-cholesterol sterols as surrogate markers of absolute cholesterol synthesis and absorption [J]. Nutr Metab Cardiovas,2011,21(10):765-769.
[5] 范会,李荣,李明明,等.固相微萃取-气质联用分析川芎挥发性成分 [J]. 遵义医学院学报,2015,38(6):642-645.
[6] 唐富山,覃飞,吴庆,等.气相色谱法测定自制山银花露中芳樟醇的含量 [J]. 遵义医学院学报,2016,39(4):423-426.
[7] Rimnacova L,Husek P,Simek P.A new method for immediate derivatization of hydroxyl groups by fluoroalkyl chloroformates and its application for the determination of sterols and tocopherols in human serum and amniotic fluid by gas chromatography-mass spectrometry [J]. J Chromatogr A,2014,1339:154-167.
[8] Wu W F,Wang Q H,Zhang T,et al.Gas chromatography analysis of serum cholesterol synthesis and absorption markers used to predict the efficacy of simvastatin in patients with coronary heart disease [J].Clin Biochem,2013,46(12):993-998.
[9] Saraiva D,Semedo R,Castilho Mda C,et al.Selection of the derivatization reagent——the case of human blood cholesterol,its precursors and phytosterols GC-MS analyses [J]. J Chromatogr B Analyt Technol Biomed Life Sci,2011,879(32):3806-3811.
[10] Andrade I,Santos L,Ramos F.Advances in analytical methods to study cholesterol metabolism:the determination of serum noncholesterol sterols [J]. Biomed Chromatogr ,2013,27(10):1234-1242.
[11] 陈文祥,李培瑛.高效液相色谱测定血清中的非胆固醇甾醇 [J]. Acta Biochimica Et Biophysica Sinica,1994,(1):37-42.
[12] Li J,Ren L,Sun G,et al.Gas chromatography-mass spectrometry (GC-MS) and its application in metabonomics[J].Chinese Journal of Biotechnology,2013,29(4):434-446.
[13] 李斌,赵子建,张晓霞,等.mfat-1小鼠胆固醇代谢特点及相关机制 [J]. 中国动脉硬化杂志,2014,22(5):459-462.
收稿2016-10-11;修回2016-11-09〗
(编辑:谭秀荣)
Determination of non-cholesterol sterols in mouse serum by gas chromatograph-mass spectrometer
DuHongyan1,ZhouJianan1,PanFeng2,YangHua1,YanZhencheng1,NiYinxing1,ZhuZhiming1,ZhongJian1
(1.Department of Hypertension and Endocrinology,Institute of Hypertension Research,Daping Hospital of the Third Military Medical University,Chongqing 400042,China; 2.Biomedical Analysis Center,Third Military Medical University,Chongqing 400038,China)
Objective To establish a method of gas chromatograph-mass spectrometer (GC-MS) to determine the non-cholesterol sterols in mouse serum.Methods Serum samples collected from male mice aged 32 weeks were preprocessed by saponification with potassium hydroxide ethanol solution,extraction by hexane,and derivation by silylation reagents with 5α-cholestane as an internal standard.The non-cholesterol sterols content in mouse serum were determined by GC-MS.Different concentrations of mixed standard solutions by GC-MS analysis were made for the standard curve.Three different concentrations of mixed standard solutions were put into the same amount of mouse serum,and were used to determine the content of non-cholesterol sterols by GC-MS for the recoveries, precision and repetition test.The serum total cholesterol (TC) was determined by enzyme colorimetric method.Results The contents of squalene,desmosterol,campesterol,stigmasterin and β-sitosterol by GC-MS were as follows(4.52±0.94,1.71±1.57,22.17±9.86,0.69±0.05 and 8.82±3.92)μg/mL,respectively.The results were standardized as ratio to TC (total cholesterol).Squalene/TC,desmosterol/TC,campesterol/TC,stigmasterin/TC and β-sitosterol/TC were as follows(5.92±2.06,1.89±2.26,26.52±9.54,0.90±0.18 and 9.08±5.51)μg/mg.The mean recoveries of the non-cholesterol sterols were between 95.65% and 103.52%.The intra-day RSDs of precision and repetition test were both below 5.00%.Conclusion GC-MS can be used for quickly measuring serum non-cholesterol sterols of mouse with high sensitivity,specificity and reproducibility.This method will provide a reliable basis for further study of the mechanisms of cholesterol synthesis and absorption in experimental animals.
gas chromatograph; mass spectrometer; non-cholesterol sterols
国家自然科学基金资助项目(NO:81270005)。
钟健,女,副教授,硕士生导师,研究方向:内分泌与代谢病,E-mail:515285051@qq.com;祝之明,男,教授,博士生导师,研究方向:心血管、内分泌与代谢病,E-mail:zhuzm@yahoo.com。
R589.2
A
1000-2715(2016)06-0617-06



