耿 飞,孙 涛,卢癸凤
(1.遵义医学院 生理学教研室,贵州 遵义 563099;2.遵义医学院 病理生理学教研室,贵州 遵义 563099)
基础医学研究
HDJ2促进体外培养胶质瘤细胞的侵袭并抵抗其凋亡
耿 飞1,孙 涛1,卢癸凤2
(1.遵义医学院 生理学教研室,贵州 遵义 563099;2.遵义医学院 病理生理学教研室,贵州 遵义 563099)
目的 探讨HDJ2对胶质瘤细胞株U251及U261体外生物学功能的影响。方法 培养U251和U261细胞并瞬时转染针对HDJ2的siRNA及过表达质粒,RT-PCR检测转染后细胞的HDJ2 mRNA表达,CCK-8法检测转染后细胞增殖能力,Transwell实验检测转染后细胞的侵袭能力,流式细胞仪观察转染后U251和U261细胞的凋亡情况。结果 在胶质瘤细胞中干扰HDJ2后其体外侵袭能力显着下降(U251细胞:P=0.02;U261细胞:P=0.001),凋亡率明显上升(U251细胞:P=0.027;U261细胞:P=0.001),而过表达HDJ2后则表现出相反结果,但HDJ2对胶质瘤细胞的增殖能力无明显影响(U251细胞过表达及干扰HDJ2:P=0.517,P=0.735;U261细胞过表达及干扰HDJ2:P=0.735,P=0.212)。结论 HDJ2可以有效促进胶质瘤细胞的体外侵袭能力并诱导胶质瘤细胞的凋亡抵抗,提示其在体外胶质瘤的发展进程中发挥着重要的作用。
HDJ2;胶质瘤;侵袭;凋亡
胶质瘤是成人最常见的脑肿瘤,占颅内肿瘤的81%,可见于中枢神经系统的任何部位[1]。作为胶质瘤中占比最大、恶性程度高、侵袭性强的肿瘤,胶质母细胞瘤患者5年生存率仅有5%[2]。尽管近年来针对胶质瘤的研究取得了长足进步,但临床上对其治疗并没有实质性突破,胶质瘤的预后仍然不容乐观。因此,进一步阐明胶质瘤发生、发展的分子机制,仍然是目前针对其研究的重要方向。
热休克蛋白(HSPs)是一类多肽类蛋白质,根据其结构大小分为:HSP90、HSP70、HSP60、HSP40以及小分子HSP27,HSPs参与蛋白装配、分泌、运输及蛋白降解和调节转录因子等多种细胞活动[3-5]。HSP40(DnaJ)是HSPs中的一个分子伴侣家族,而HDJ2又是HSP40家族成员之一[6]。DnaJ蛋白家族成员的结构都具有一个共同特点,即均在氨基末端有一个高度保守的J结构域、一个甘氨酸/丙氨酸富集结构域、4个CxxCxGxG锌指重复序列结构域,以及一个C端底物结合结构域。J结构域是DnaJ蛋白的标志性结构域,该结构域包含保守的组氨酸、脯氨酸和天冬氨酸残基,可以与HSP70结合以增强其ATP活性[7]。由于HSP70在多种肿瘤中表达上调,并且通过抑制细胞死亡而强有力地促进肿瘤的发展,而HDJ2与HSP70之间联系紧密,因此HDJ2也成为一个受人关注的靶点[8-12]。然而,目前并没有研究报道剔除了HSP70的因素后,HDJ2基因的J结构域在肿瘤发生发展中有独立作用[7]。而近年来,HDJ2家族可能参与肿瘤发生和恶性进程一直是人们争论的问题。本文拟通过在体外对胶质瘤细胞株分别沉默和过表达HDJ2并观察其对细胞增值、侵袭和凋亡的影响,明确HDJ2在胶质瘤细胞株中的生物学作用,以期未来揭示HDJ2影响胶质瘤进程的分子机制。
1 材料与方法
1.1 材料 人胶质瘤细胞株U251及U261由遵义医学院生理学教研室保存。
1.2 试剂与仪器 DMEM培养基、胎牛血清、含EDTA0.25%胰酶,Gibico生物公司;Lipofectamine TM 2000试剂盒,Life Technologies公司;HDJ2 siRNA(包括NC/HDJ2-1/HDJ2-2/HDJ2-3 siRNA共4个片段),广州锐博生物科技公司;HDJ2过表达质粒,美国复能基因公司;质粒小提试剂盒,Life旗下的Invitrogen公司;Trizol、逆转录试剂盒、荧光定量PCR试剂盒,TAKARA公司;GAPDH及HDJ2的RT-PCR引物由Invitrogen公司合成;CCK-8试剂盒,日本同仁公司;Boyden Transwell小室,美国BD公司;Annexin V、Propidium Iodide,南京凯基生物科技发展有限公司。六孔板、96孔板、培养瓶等,NEST公司。
CO2细胞培养箱,Thermo公司;显微镜,Olympus公司;ABI7500荧光定量PCR仪,ABI公司;ST16R型低温高速离心机、NANODROP2000超微量分光光度计,Thermo公司;Model 680酶标仪,BIO-RAD公司;PK-8D型电热恒温水槽,上海一恒科技有限公司。流式细胞仪,BD公司。
1.3 方法
1.3.1 胶质瘤细胞株U251和U261细胞培养 U251及U261来源于美国模式培养物集存库,由遵义医学院生理学教研室保存,采用含10%胎牛血清的DMEM培养基,置于37 ℃,含5%CO2的细胞培养箱中培养。
1.3.2 质粒扩增 购买回来商品化的HDJ2过表达及其空白对照质粒经过转化,质粒小摇、质粒中摇,质粒中提等一系列扩大培养,以大批量获取质粒用于后续实验。
1.3.3 U251和U261转染HDJ2siRNA及HDJ2过表达质粒 选取状态良好的胶质瘤细胞株U251及U261,消化吹打成均匀的细胞悬液后铺于6孔板内,密度达50%,24 h后待细胞长到密度达70%左右,给予每孔5 μL siRNA(浓度为20 μmol/L)瞬时转染,分为阴性对照组(NC)及siHDJ2-1/siHDJ2-2/siHDJ2-3 4个组,转染8 h后更换含10%胎牛血清的DMEM继续培养。过表达则分为阴性对照组(MOCK)及HDJ2过表达组,其中阴性对照组转染HDJ2过表达质粒的空白对照质粒,每孔给予4 μg质粒转染6 h后,更换含10%胎牛血清的DMEM继续培养。
1.3.4 RT-PCR检测HDJ2干扰和过表达转染后U251和U261细胞的HDJ2mRNA表达 收集瞬时转染24 h后的细胞,用TRIZOL抽提法提取RNA后,紫外分光光度仪测定RNA浓度及260/280值,TAKARA逆转录试剂盒进行逆转录,逆转录反应条件为37 ℃ 60 min,85 ℃灭活5 min。所得的反转录产物用灭菌水稀释5倍后-20 ℃保存备用。RT-PCR检测cDNA中HDJ2含量,引物序列为HDJ2(F:5’CCTTCATTTGGATTCTTATCAGG3’,R:5’GAGCCAAAACCACCACCTGC3’),内参为GAPDH(F:GTCAACGGATTTGGTCGTATTG,R:CTCCTGGAAGATGGTGATGGG),PCR反应条件为:95 ℃预变性10 min、95 ℃ 15 s、60 ℃ 30 s、72 ℃ 34 s,40个循环,检测各模版的Ct值,所有实验均重复3次,结果以Ct值法计算各对照组及实验组各基因的相对表达量,计算公式为△△Ct=(CtHDJ2-CtGAPDH)实验组-(CtHDJ2-CtGAPDH)对照组。
1.3.5 CCK-8检测HDJ2干扰和过表达转染后U251和U261细胞增殖能力 选取生长状态良好的胶质瘤细胞株U251及U261铺板,分别给予siRNA或HDJ2过表达质粒瞬时转染。24 h后,PBS洗涤2次,消化,离心,去除细胞培养基,加入空培(不含胎牛血清的DMEM培养基,下同),重悬,计数。按每孔1 000个细胞的数量加入到96孔板中,每孔用全培(含10%胎牛血清的DMEM培养基,下同)将细胞稀释至约100 μL,每处理组内分7组,每组5个复孔,同时设立仅加培养基的空白对照组。铺板后24 h CCK8法测定每孔OD值,吸出全培,加入100 μL由全培及CCK8试剂按9:1的比例配好的混合液,37 ℃孵育2~4 h。酶标仪检测每孔450 nm处的OD值,将空白对照组为基准进行调零,得出显示细胞增殖能力的OD值,每组取5个复孔的均值,间隔24 h进行下一轮检测,连测7 d,绘制细胞增殖曲线。
1.3.6 Transwell实验检测HDJ2干扰和过表达转染后U251和U261细胞的侵袭能力 选取生长状态良好的胶质瘤细胞株U251及U261铺板,分别给予siRNA或HDJ2过表达质粒瞬时转染。24 h后,PBS洗涤2次,消化,离心,去除细胞培养基,加入空培,重悬,计数后调整细胞密度,于每个预先用基质Matrigel胶预处理好的8 μm 孔径聚碳酸脂微孔滤膜的Transwell小室内加入200 μL细胞悬液,内含2×105个细胞。下室内加入600~800 μL全培,37 ℃孵育24 h,取出Transwell小室,用棉花清理上室内基质胶及细胞,甲醇孵育固定30 min,苏木素染色30 min后于显微镜(目镜10倍,物镜20倍)下观察穿膜细胞,随机取上、下、左、右、中心5个视野拍摄照片。计算5个视野中细胞数目的均值,代表成功侵袭的细胞数目。
1.3.7 流式细胞仪检测U251和U261转染后的凋亡情况 选取生长状态良好的胶质瘤细胞株U251及U261铺板,分别给予siRNA或HDJ2过表达质粒瞬时转染,并给予1.0 μmol/L阿霉素进行凋亡诱导。24 h后,PBS洗涤2次,用不含EDTA的胰酶消化,离心,重悬,计数。收集105~106个细胞。PBS洗涤细胞2次,每次2 000 rpm离心5 min,去除PBS,滤纸上沥干。加入500 μL Binding-buffer悬浮细胞,加入5 μL Annexin V,充分吹打混匀后,再加入5μL Propidium Iodide吹打混匀,室温避光反应5~15 min后于1 h内用流式细胞仪检测细胞凋亡率。
1.4 统计学分析 数据采用SPSS 13.0的统计软件包处理,两组均数间比较采用独立样本t检验,多组间均数比较采用单因素方差分析,取α=0.05为检验标准。
2 结果
2.1 U251和U261细胞HDJ2干扰效率 在U251及U261细胞株中分别用HDJ2不同干扰片段siRNA-1/-2/-3瞬时转染后检测HDJ2 mRNA水平。在U251细胞株中,与对照组NC相比,HDJ2 siRNA-1/-2/-3干扰效率分别为0.82、0.45、0.23,siRNA-2及siRNA-3为有效干扰片段(F=159.52,P<0.001),其中siRNA-3组HDJ2 mRNA水平下降最显着(见图1A)。在U261细胞株中,结果显示,siRNA-2及siRNA-3为有效干扰片段,(F=51.23,P<0.001),3个干扰片段干扰效率分别为0.35、0.29、0.18(见图1B)。综合2个细胞株实验结果,挑选在U251及U261细胞株中mRNA干扰效率均最为稳定且效率最高的HDJ2 siRNA-3进行后续实验。

***:与对照组比较,P<0.001。 图1 3个HDJ2-siRNA在U251(A)和U261(B)细胞株中的干扰效率
2.2 U251和U261细胞HDJ2过表达效率 分别在U251、U261中给予HDJ2过表达质粒瞬时转染后,用荧光定量-PCR检测HDJ2过表达效率。结果显示,瞬时转染48 h后,在U251及U261中,与对照组MOCK相比,过表达HDJ2后mRNA水平(见图2)均明显提高(t=-5.63,P=0.03;t=-16.18,P=0.004),表明过表达成功,HDJ2过表达质粒可用于后续实验。

**:与对照组比较,P<0.01。图2 U251和U261细胞HDJ2过表达效率
2.3 HDJ2干扰和过表达后U251和U261细胞的增殖能力 在U251及U261细胞株中分别瞬时转染HDJ2 siRNA或过表达质粒后,CCK8法检测细胞增殖能力并绘制生长曲线,结果显示,干扰HDJ2后2株胶质瘤细胞增殖能力没有显着变化(F=0.433,P=0.517;F=4.052,P=0.735);而在过表达HDJ2后,2株胶质瘤细胞增殖能力与MOCK组相比,差异无统计学意义(F=0.117,P=0.735;F=1.647,P=0.212)。综合干扰及过表达HDJ2后胶质瘤细胞增殖能力结果分析,HDJ2对胶质瘤细胞体外增殖能力没有显着影响(见图3)。
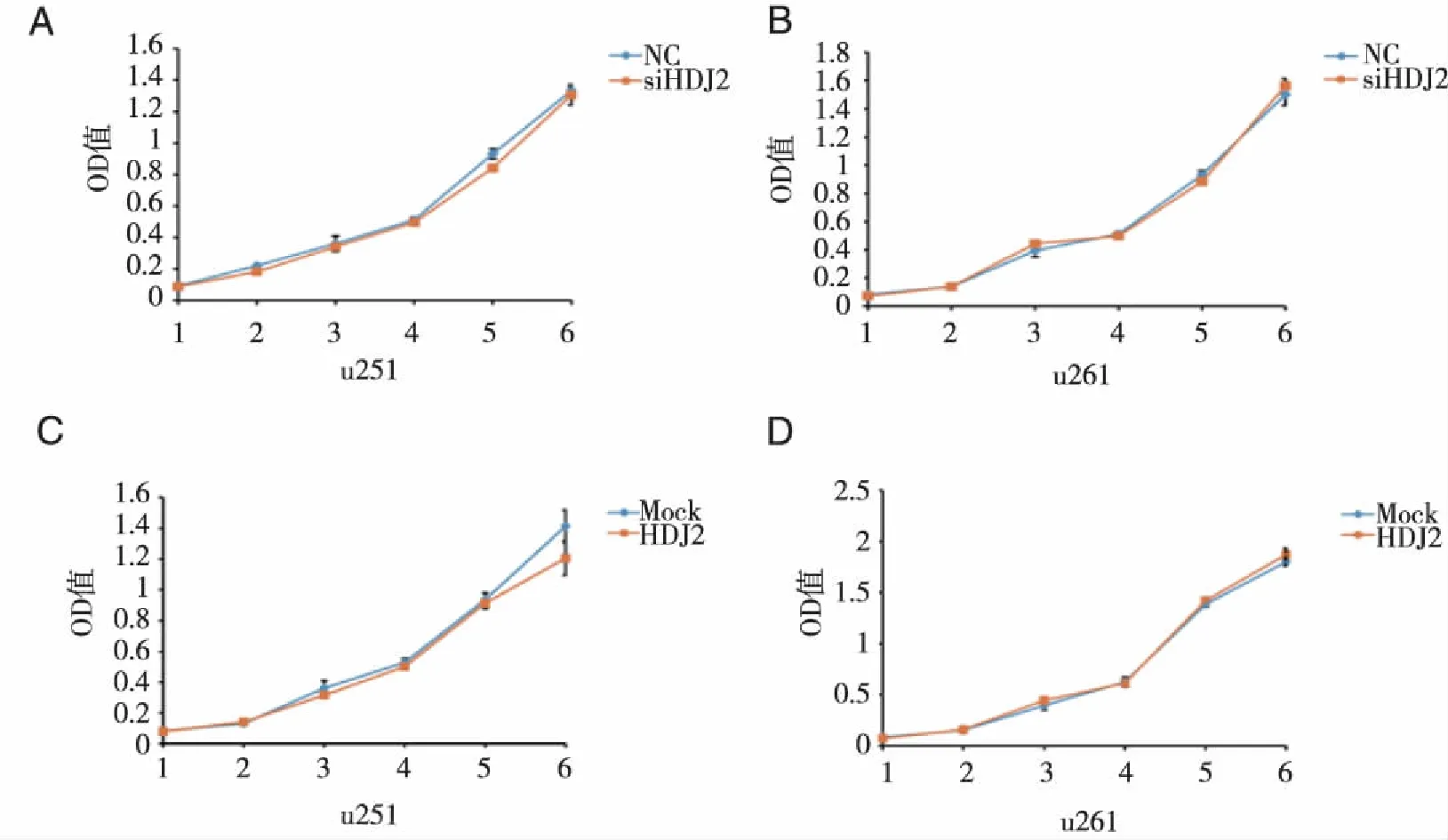
A、B:HDJ2干扰;C、D:HDJ2过表达;A、C:U251细胞;B、D:U261细胞。图3 HDJ2干扰和过表达对U251和U261细胞增殖的作用
2.4 HDJ2干扰或过表达后对U251和U261细胞侵袭能力的影响 在U251及U261中分别瞬时转染siRNA或过表达质粒后,Boyden Transwell小室检测细胞体外侵袭能力的变化。结果显示,在干扰HDJ2后,与NC组相比,HDJ2 si-RNA组U251及U261细胞穿膜数目均显着降低(t=7.126,P=0.02;t=8.792,P=0.001)。而与MOCK组相比,过表达HDJ2后U251及U261细胞的穿膜数目显着上调(t=-7.164,P=0.002;t=-5.653,P<0.005;见图4)。

**:与对照组比较,P<0.01。图4 HDJ2干扰和过表达对U251和U261细胞侵袭能力的影响(×200)
2.5 HDJ2干扰或过表达后对U251和U261细胞凋亡的影响 分别在U251、U261中给予干扰片段HDJ2 siRNA或过表达质粒瞬时转染处理,并给予1.0 μmol/L阿霉素进行凋亡诱导,24 h后流式细胞仪检测胶质瘤细胞的凋亡。结果显示,在U251及U261细胞株中干扰HDJ2后,细胞凋亡率升高(t=-3.392,P=0.027;t=-10.702,P=0.001),而过表达HDJ2后则结果相反(t=10.952,P=0.001;t=9.445,P=0.001;见图5)。

**:与对照组比较,P<0.01;***:与对照组比较,P<0.001。图5 HDJ2干扰或过表达后对U251和U261细胞侵袭能力的影响
3 讨论
在本文中,为了探讨HDJ2对U251及U261细胞生物学行为的影响,我们首先构建并筛选出了针对HDJ2的特异性siRNA及过表达质粒。体外实验显示HDJ2可促进U251、U261的侵袭,同时可以抵抗阿霉素对U251、U261的凋亡诱导作用;但对它们的增殖能力没有影响。
HDJ2作为HSP40家族成员之一,首先是作为HSP70的分子伴侣被发现的。目前已有研究发现,HSP40家族成员的特征性结构域J-domain可与HSP70结合,这种结合可以激活其自身的ATP酶活性,ATP酶活性增强后促进ATP水解,生成的ADP可以稳定HSP70与其底物结合的稳定性,从而保持HSP70的活性。因此,HSP40与HSP70处于一种相辅相成的协同状态[9-10]。有文献报道称HSP70可以增强WASF3的活性进而促进前列腺癌的侵袭及转移[13]。而HSP40另一家族成员HLJ1(DNAJB4)可以通过影响E-cadherin的表达进而调控肺癌细胞株CL1-0,CL1-1,CL1-5及CL1-5-F4的侵袭能力[14]。因此,我们推测HDJ2可能通过提高HSP70与其底物WASF3结合的稳定性进而起到促进U251、U261的侵袭能力,也可能通过影响EMT的发生而促进胶质瘤的侵袭。
在神经胶质瘤中,HDJ2被认为对肿瘤的放疗抵抗性起着一定的作用,在胶质瘤细胞中抑制HDJ2的表达,细胞的放疗敏感性大大增强,而过表达HDJ2则显着降低了胶质瘤的放疗敏感性,表现出放疗抵抗[15]。该研究指出,射线照射胶质瘤细胞后可以促进HDJ2从细胞浆转移到细胞核及线粒体等有膜的细胞器中,也有文献报道,HDJ2可以将某些蛋白质从胞浆运输到线粒体,从而增强胰腺癌细胞的凋亡抵抗能力。而众所周知的是,大部分细胞凋亡通常都是通过线粒体途径完成的[16-17]。我们在胶质瘤细胞株U251及U261中干扰HDJ2后,细胞凋亡率显着上升,和上述结果吻合,从而比较明确地揭示了HDJ2在胶质瘤中的凋亡抵抗作用的功能。
本研究利用胶质瘤细胞株U251及U261,说明HDJ2在胶质瘤中扮演着凋亡抵抗及促进肿瘤侵袭转移的角色,提示其可能是促癌基因,为胶质瘤的治疗提供可能的靶点,而具体的作用机制还有待于进一步的探讨。
[1] Ostrom Q T,Gittleman H,Farah P,et al.CBTRUS statistical report:primary brain and central nervous system tumors diagnosed in the United States in 2006-2010[J].Neuro Oncol,2013,15(6):1-56.
[2] Ostrom Q T,Bauchet L,Davis F G,et al.The epidemiology of glioma in adults:a“state of the science”review[J].Neuro Oncol,2014,16(7):896-913.
[3] Kampinga H H,Hageman J,Vos M J,et al.Guidelines for the nomenclature of the human heat shock proteins[J].Cell Stress Chaperones,2009,14(1):105-111.
[4] Mitra A,Shevde L A,Samant R S.Multi-faceted role of HSP40 in cancer[J].Clin Exp Metastasis,2009,26(6):559-567.
[5] Qiu X B,Shao Y M,Miao S,et al.The diversity of the DnaJ/Hsp40 family,the crucial partners for Hsp70 chaperones[J].Cell Mol Life Sci,2006,63(22):2560-2570.
[6] Lianos G D,Alexiou G A,Mangano A,et al.The role of heat shock proteins in cancer[J].Cancer Letters,2015,360(2):114-118.
[7] Stark J L,Mehla K,Chaika N,et al.Structure and function of human DnaJ homologue subfamily a member 1(DNAJA1)and its relationship to pancreatic cancer[J].Biochemistry,2014,53(8):1360-1372.
[8] Alexiou G A,Vartholomatos G,Stefanaki K,et al.Expression of heat shock proteins in medulloblastoma[J].J Neurosurg Pediatr,2013,12(5):452-457.
[9] Murphy M E.The HSP70 family and cancer[J].Carcinogenesis,2013,34(6):1181-1188.
[10] Stankiewicz A R,Lachapelle G,Foo C P,et al.Hsp70 inhibits heat-induced apoptosis upstream of mitochondria by preventing Baxtranslocation[J].J Biol Chem,2005,280(46):38729-38739.
[11] Guo F,Sigua C,Bali P,et al.Mechanistic role of heat shock protein 70 in Bcr-Abl-mediated resistance to apoptosis in human acute leukemia cells[J].Blood,2005,105(3):1246-1255.
[12] Didelot C,Lanneau D,Brunet M,et al.Anti-cancer therapeutic approaches based on intracellular and extracellular heat shock proteins[J].Curr Med Chem,2007,14(27):2839-2847.
[13] Teng Y,Ngoka L,Mei Y,et al.HSP90 and HSP70 proteins are essential for stabilization and activation of WASF3 metastasis-promoting protein[J].J Biol Chem,2012,287(13):10051-9.
[14] Wang C C,Tsai M F,Hong T M,et al.The transcriptional factor YY1 upregulates the novel invasion suppressor HLJ1 expression and inhibits cancer cell invasion[J].Oncogene,2005,24(25):4081-4093.
[15] Wang C C,Liao Y P,Mischel P S,et al.HDJ-2 as a target for radiosensitization of glioblastomamultiforme cells by the farnesyltransferase inhibitor R115777 and the role of the p53/p21 pathway[J].Cancer Res,2006,66(13):6756-6762.
[16] Gore L,Holden S N,Cohen R B,et al.A phase I safety,pharmacological and biological study of the farnesyl protein transferase inhibitor,tipifarnib and capecitabine in advanced solid tumors[J].Ann Oncol,2006,17(11):1709-1717.
[17] Kurzik-Dumke U,Hörner M,Czaja J,et al.Progression of colorectal cancers correlates with overexpression and loss of polarization of expression of the htid-1 tumor suppressor[J].Int J Mol Med,2008,21(1):19-31.
[收稿2017-03-12;修回2017-04-27]
(编辑:王静)
HDJ2 promotes the progression of glioma cell lines in vitro
GengFei1,SunTao1,LuGuifeng2
(1.Department of Physiology,Zunyi Medical University,Zunyi Guizhou 563099,China;2.Department of Pathophysiology,Zunyi Medical University,Zunyi Guizhou 563099,China)
Objective To investigate the effects of HDJ2 on the biological behavior of glioma cell line U251 and U261 in vitro.Methods Fluorescence quantitative PCR was used to verify the interference or over-express efficiency after transfection of siRNA or HDJ2 over-expression plasmid.A Boyden chamber assay aimed to detect the cell migration abilities of glioma cells was used.CCK-8 assay and apoptosis assay were used to detect the cell proliferation abilities and apoptosis.Results Results showed that transfection of HDJ2 siRNA in U251 and U261 cells effectively attenuated their migration abilities and triggered apoptosis,while over expression of HDJ2 led to the opposite results.Moreover,HDJ2 siRNA or over-expression of HDJ2 had no significant effects on U251 and U261 cell proliferation when compared to control groups.Conclusion These results provide evidence that HDJ2 promotes migration and inhibits apoptosis in glioma cell lines in vitro,thus playing a tumor-promotive role in vitro.
HDJ2;glioma;invasion;apoptosis
R739.41
A
1000-2715(2017)03-0243-06



