赵 静,王振国,赵 琳
(1.武警特色医学中心 内分泌与血液科,天津 300162;2.武警特色医学中心 医研部,天津 300162;3.上海市第四人民医院 老年医学科,上海 200080)
随着人们生活水平的提高,2型糖尿病(Type 2 diabetes mellitus, T2DM)已成为威胁人类健康的重要因素,而肥胖症是T2DM发病率增高的重要因素之一[1]。T2DM的主要病理机制是胰岛素抵抗,而脂肪组织是胰岛素作用的重要靶器官[2]。吡格列酮(Pioglitazone,PGZ)是一种过氧化物酶体增殖物激活受体(Peroxisome proliferator-activated receptor-γ, PPARγ)激活剂,可以提高脂肪组织、肝脏和骨骼肌等对胰岛素的敏感性,改善机体的胰岛素抵抗,广泛用于T2DM的治疗[3]。本研究通过观察吡格列酮干预后Zucker糖尿病-肥胖(Zucker diabetic fatty,ZDF)大鼠及其对照组Zucker lean (ZL)大鼠胰岛素抵抗和脂肪分布变化,提高对吡格列酮治疗T2DM的作用机理的认识。
1 材料与方法
1.1 实验动物及干预方法 5~6周龄ZDF大鼠和ZL大鼠各18只(动物为清洁级,购于北京维通利华实验动物有限公司,许可证号:SCXK(京)2016-0006),体重(220±15 g),分别随机分为ZDF-吡格列酮组(ZDFPGZ)、ZDF-生理盐水组(ZDFVE)、ZL-吡格列酮组(ZLPGZ)、ZL-生理盐水组(ZLVE),每组各9只。所有大鼠均用高脂饲料喂养于SPF级动物实验室,每周测量动物的体重,取尾静脉血液监测血糖,空腹血糖超过7.0 mmol/L、ZDF组体重超过ZL组平均体重的20%即为诱导糖尿病-肥胖模型成功。8周后将符合条件的ZDF和ZL大鼠用吡格列酮和生理盐水进行灌胃干预8周,剂量为10 mg/(kg·d),生理盐水10 mL/(kg·d)。干预结束后麻醉处死动物,取腹主动脉血1 mL置于肝素抗凝管中;取大鼠肾周脂肪组织,一部分置于冻存管储存于-196℃的液氮中,另一部分置于4%的多聚甲醛溶液中固定,24 h后进行上机石蜡包埋。
1.2 主要试剂及仪器 无水葡萄糖,购自四川峨嵋山药业股份有限公司;诺和灵精蛋白生物合成人胰岛素注射液,购自江苏万邦生化医药股份有限公司;盐酸吡格列酮片,购自天北京太洋药业股份有限公司;大鼠胰岛素、胆固醇(Cholesterol, CHOL)、甘油三酯(Triglycerides, TG)和低密度脂蛋白(Low density Lipoprotein-cholesterol, LDL-C)ELISA试剂盒,购自美国RapidBio公司;RT-PCR转录试剂盒,购自瑞士Roche公司;ABI Prism 7300 型荧光定量PCR仪(Applied Biosystems 公司);ECLIPSE 80i 荧光显微镜(日本尼康公司)。
1.3 大鼠血浆胰岛素、血脂水平检测及胰岛素抵抗评价 将大鼠抗凝血2 500×g离心10 min,分离出血浆,通过酶联免疫吸附测定技术(Enzyme linked immunosorbent assay, ELISA)测定大鼠血浆胰岛素、CHOL、TG和LDL-C浓度。通过建立稳态评估模型(Homeostasis model assessment, HOMA)计算胰岛素抵抗指数(HOMA of insulin resistance, HOMA-IR),公式为[空腹胰岛素(mU/L)×空腹血糖(mmol/L)]/22.5[4]。
1.4 MRI扫描观察大鼠腹部脂肪分布 采用西门子Verio 3.0T磁共振仪器、大鼠专用线圈对大鼠腹部进行扫描和信号采集。应用异氟烷、氧气混合气体(异氟烷浓度1.5%~2%)对大鼠进行吸入麻醉,动物呈仰卧位。扫描序列为T2WI,参数:采用快速自旋回波序列进行采集,TR时间6 000 ms,TE时间74 ms;层厚1.5 mm;扫描野(FOV)120 mm×96 mm。在后处理工作站上测量大鼠内脏脂肪(Visceral adipose tissue, VAT)及皮下脂肪(Subcutaneous adipose tissue,SAT)面积,并计算VAT所占腹部脂肪比例,即[VAT面积 /(VAT+SAT) 面积×100%]。
1.5 HE染色测量大鼠内脏脂肪细胞大小 取大鼠肾周脂肪蜡块置于切片机上切片,厚度为5 μm,将石蜡切片进行HE染色,利用imageJ软件测量大鼠VAT脂肪细胞直径。
1.6 RT-qPCR检测大鼠内脏脂肪组织GLUT-4、PPAR-γ基因表达 将液氮中保存的大鼠肾周脂肪研磨至粉末,加入Trizol及三氯甲烷等提取脂肪组织总mRNA,使用Roche逆转录试剂盒,按照说明在GeneAmp2400 PCR仪中将mMRA逆转录为cDNA。配制SYBR Green Master(ROX)反应体系:SYBR Green Master(ROX)10 μL、cDNA模板2 μL、5 μmol/mL上游引物和下游引物各1 μL、Milli-Q超纯水补足至20 μL。用RT-qPCR方法检测大鼠脂肪组织葡萄糖转运蛋白-4(Glucose transporter-4,GLUT-4)、PPAR-γ基因表达水平,引物序列:β-actin,上游引物5’-AAT TAC TCC CTC TCC TA-3’,下游引物5’-ACT CAT CTA CTC CTC TTC T-3’;GLUT-4,上游引物5’-GACATTTGGCGGAGCCTAAC-3’,下游引物5’-TAACTCCAGCAGGGTGACACAG-3’;PPAR-γ,上游引物5’- CCAGAGTCTGCTG ATCTGCG -3’,下游引物5’- GCCACCTCTTTGCTCTGCTC -3’。反应条件为95℃预变性10 min,95℃变性15 s,60℃退火1 min,共40个循环。将结果用ZLVE组标准化,用2-△△CT方法计算目的基因表达水平。
1.7 腹腔葡萄糖耐量试验(IPGTT)和胰岛素耐量试验(IPITT) 在处死动物前1周进行IPGTT和IPITT,用于评价大鼠胰岛素敏感性和胰岛素抵抗程度。IPGTT:扎刺大鼠尾静脉,用血糖试纸蘸取血液测量血糖基线值,然后腹腔注射20%的D-葡萄糖溶液(1g/kg体重)并开始记录时间,在30、60、90、120 min分别测量血糖值。IPITT:采血方法与IPGTT相同,测量基线血糖浓度后腹腔注射胰岛素工作液(0.1U/kg体重)并开始记录时间,在30、60、90、120 min分别测量血糖值。
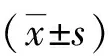
2 结果
2.1 体重和血糖 ZDF组大鼠在高脂喂养1周后较ZL组血糖明显升高(P<0.01),并且ZDF组体重明显大于ZL组。除1只ZDFPGZ大鼠死亡,1只ZDFVE大鼠因体重达不到超过对照组平均体重的20%标准而诱导失败,余ZDF和ZL大鼠均符合模型要求。吡格列酮/生理盐水干预后,2周内ZDFPGZ组血糖下降至正常水平,ZDFVE组血糖持续升高;而ZDFPGZ组体重持续增加,ZDFVE组体重较ZDFPGZ组小(P<0.01,见图1A、B)。
与 ZDFVE组比较,a:P< 0.01; 与 ZL组(ZLVE和ZLPGZ组)比较,b:P< 0.01;与ZDFPGZ组比较,c:P< 0.01。图1 血糖和体重
2.2 血浆胰岛素、血脂水平及HOMA-IR 造模成功后ZDF大鼠与ZL大鼠比较表现为明显的高脂血症和高胰岛素血症,ZDF大鼠TG、CHOL、胰岛素水平均明显高于ZL大鼠(P<0.01),ZDF大鼠较ZL大鼠HOMA-IR明显增大(P<0.01),表现为严重的胰岛素抵抗。吡格列酮干预后ZDFPGZ组大鼠TG、CHOL、LDL-C、胰岛素水平及HOMA-IR较ZDFVE组均明显降低(P<0.01),差异有统计学意义,说明大鼠的高脂血症、高胰岛素血症及胰岛素抵抗明显改善(见表1)。

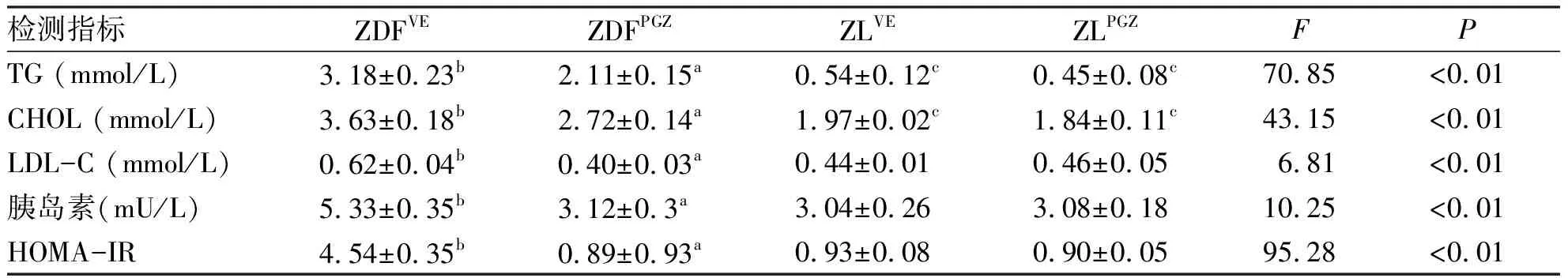
检测指标ZDFVEZDFPGZZLVEZLPGZFPTG (mmol/L)3.18±0.23b2.11±0.15a0.54±0.12c0.45±0.08c70.85<0.01CHOL (mmol/L)3.63±0.18b2.72±0.14a1.97±0.02c1.84±0.11c43.15<0.01LDL-C (mmol/L)0.62±0.04b0.40±0.03a0.44±0.010.46±0.056.81<0.01胰岛素(mU/L)5.33±0.35b3.12±0.3a3.04±0.263.08±0.1810.25<0.01HOMA-IR4.54±0.35b0.89±0.93a0.93±0.080.90±0.0595.28<0.01
与ZDFVE组,a:P< 0.01; 与ZL组(ZLVE和ZLPGZ组)比较,b:P< 0.01; 与 ZDFPGZ组比较,c:P< 0.01。TG, 甘油三酯; CHOL, 胆固醇; LDL-C: 密度脂蛋白;HOMA-IR, 胰岛素抵抗指数。
2.3 大鼠腹部脂肪分布情况 ZDFPGZ组大鼠腹部VAT和SAT含量百分比均高于ZDFVE组,差异有统计学意义(P<0.01),说明用药后VAT和SAT均有所增加;ZDFPGZ组大鼠的VAT含量百分比低于ZDFVE组(68.26±1.03 vs. 74.11±0.79,P<0.01),说明吡格列酮干预后虽然总脂肪量增加,但是VAT的相对含量减少,更倾向于增加SAT的含量(见表2)。
2.4 大鼠内脏脂肪细胞大小 造模成功后,ZDF组大鼠脂肪细胞直径明显大于ZL组,差异有统计学意义(P<0.01)。吡格列酮干预后,ZDFPGZ组大鼠脂肪细胞明显大于ZDFVE组(P<0.01),差异有统计学意义,说明吡格列酮可以使脂肪细胞扩增;ZLVE组与ZLPGZ组脂肪细胞直径相比较,差异无统计学意义(P>0.05,见表2)。 大鼠内脏脂肪HE染色结果见图2。
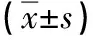
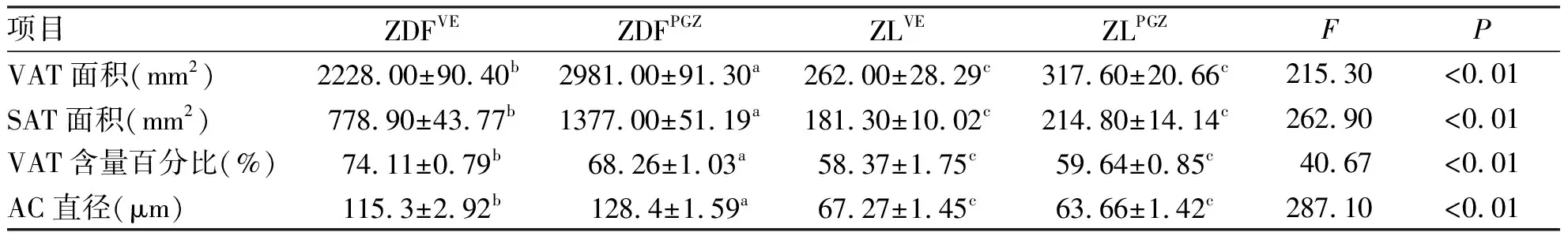
项目ZDFVEZDFPGZZLVEZLPGZFPVAT面积(mm2)2228.00±90.40b2981.00±91.30a262.00±28.29c317.60±20.66c215.30<0.01SAT面积(mm2)778.90±43.77b1377.00±51.19a181.30±10.02c214.80±14.14c262.90<0.01 VAT含量百分比(%)74.11±0.79b68.26±1.03a58.37±1.75c59.64±0.85c40.67<0.01AC直径(μm)115.3±2.92b 128.4±1.59a67.27±1.45c63.66±1.42c287.10<0.01
与ZDFVE组比较,a:P< 0.01; 与ZL组(ZLVE和ZLPGZ组)比较,b:P< 0.01; 与ZDFPGZ组比较,c:P< 0.01。 VAT, 内脏脂肪组织; SAT, 皮下脂肪组织; VAT含量百分比= VAT面积/(VAT + SAT)面积×100%;AC,Adipocyte,脂肪细胞。
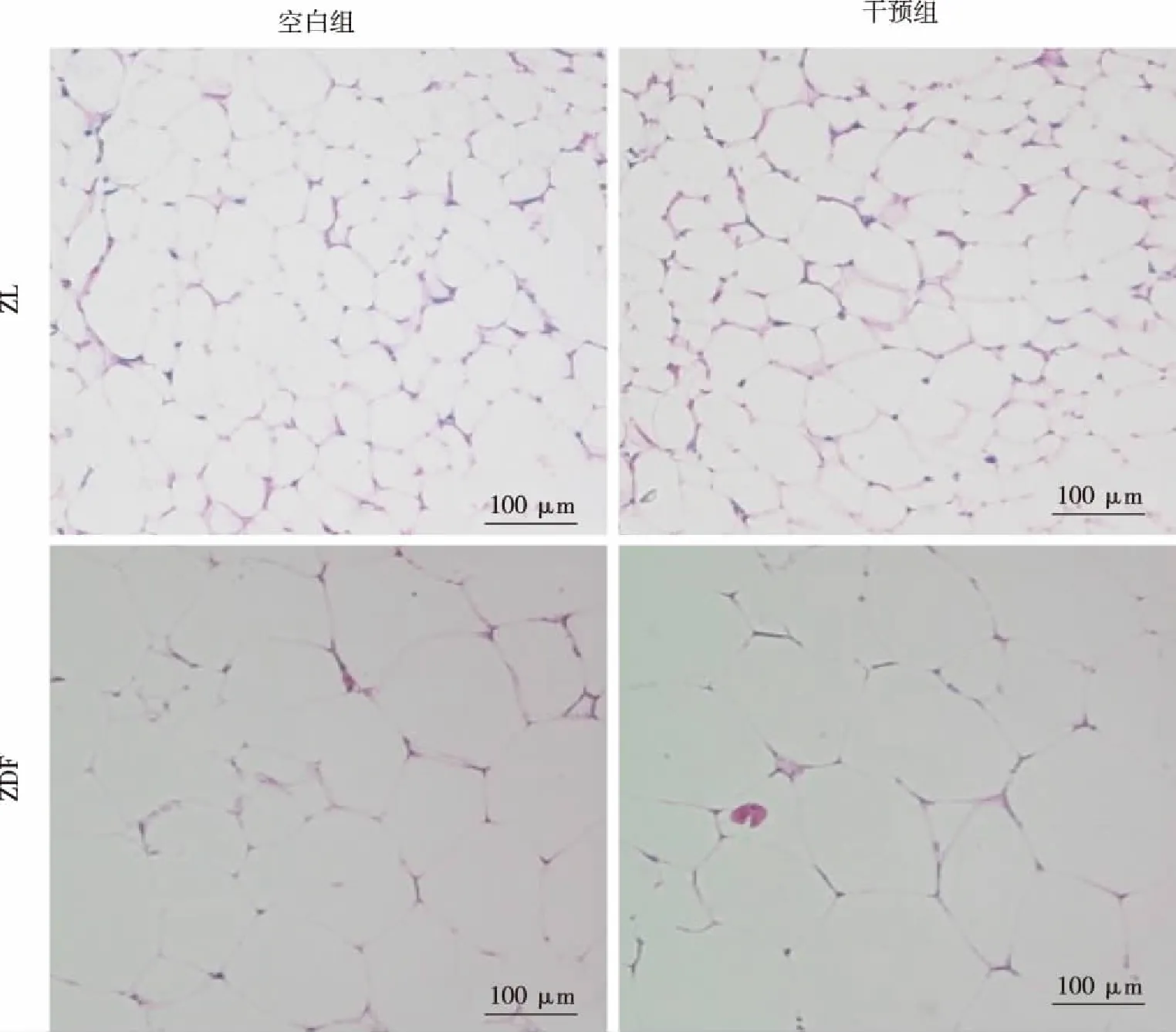
图2 大鼠内脏脂肪组织HE染色结果(×100)
2.5 大鼠内脏脂肪GLUT-4、PPAR-γ基因表达水平 ZDF大鼠VAT中与胰岛素抵抗相关的GLUT-4和PPAR-γ基因表达减少(P<0.01);吡格列酮干预后表达量增高,GLUT-4(0.40±0.02 vs. 0.84±0.03, ZDFVEvs. ZDFPGZ,P<0.01), PPAR-γ(0.33±0.01 vs. 1.02±0.04, ZDFVEvs. ZDFPGZ,P<0.01,见图2A、B)。
2.6 IPGTT及IPITT结果 如图2C和D所示,IPGTT显示ZDFVE组的血糖浓度在所有的时间点均比其他组高(P<0.01),ZDFPGZ组胰岛素敏感性明显提高;IPITT显示ZDFVE组的血糖浓度高于其他组(P<0.01),ZDFPGZ组胰岛素抵抗明显改善。

与 ZDFVE组比较,a:P< 0.01; 与ZL组(ZLVE和ZLPGZ组)比较,b:P< 0.01; 与 ZDFPGZ组比较,c:P< 0.01。 A、B:各组GLUT-4、PPAR-γ基因表达量;C、D:腹腔葡萄糖耐量试验(IPGTT)和胰岛素耐量试验(IPITT)。图3 基因表达及IPGTT、IPITT
3 讨论
随着社会发展和人们生活方式的改变,肥胖症(BMI ≥30 kg/m2)已成为全球性的公共健康问题,肥胖症的流行增加了T2DM、心脑血管疾病及一些代谢性疾病的发病率[1,5-6]。胰岛素抵抗是T2DM的主要病理机制,研究表明,脂肪组织是机体三大胰岛素靶器官(肝脏、脂肪、骨骼肌)之一,参与到肥胖相关胰岛素抵抗的发生和发展中,不同位置的脂肪组组对胰岛素抵抗的贡献不同,VAT较SAT更易引起胰岛素抵抗[2]。
吡格列酮属于噻唑烷二酮(Thiazolidinedione,TZD)类胰岛素增敏剂,可激活脂肪组织、骨骼肌和肝脏等胰岛素靶器官的PPAR-γ,增加靶细胞对胰岛素的敏感性,从而改善胰岛素抵抗,广泛应用于T2DM的临床治疗[7-8]。PPAR-γ在脂肪细胞内呈高表达状态,在脂肪细胞分化、功能调控中发挥重要作用,在PPAR-γ基因缺失的个体中脂肪细胞会表现为明显的胰岛素抵抗[9]。脂肪组织是TZD最重要的作用位点[10],本研究吡格列酮干预后大鼠内脏脂肪组织PPAR-γ表达量明显升高,胰岛素抵抗程度明显改善。GLUT-4是胰岛素靶器官重要的膜转运蛋白,介导葡萄糖的跨膜转运,脂肪细胞的GLUT-4基因表达降低会导致机体的胰岛素抵抗[11-12]。Kramer D等[13]研究指出,肥胖大鼠的脂肪细胞中GLUT-4表达降低,应用TZD类药物可使其正常表达。本研究应用吡格列酮后大鼠内脏脂肪组织GLUT-4表达量明显升高,血糖恢复至正常水平。
尽管吡格列酮治疗T2DM有良好的临床效果,但其仍有一些副作用,如:体重增加、水钠储留、充血性心衰及骨折等[14]。本研究中肥胖-糖尿病大鼠应用吡格列酮后体重增加,脂肪扩增,细胞直径增大。有学者提出“脂质窃取”模型来解释吡格列酮引起的体重增加,即吡格列酮通过将肝脏和骨骼肌中的沉积的脂质转移到脂肪细胞,使脂肪细胞变成一个“良好”的脂质存储器官,来改善肝脏和骨骼肌的脂毒性,从而缓解机体的胰岛素抵抗[15-16]。并且TZD类药物倾向于将脂质转移至SAT,而不是更易引起胰岛素抵抗的VAT[17]。本研究发现,吡格列酮干预后大鼠腹部总脂肪量增加,但SAT相对于VAT增加更加明显,与文献一致。因此,吡格列酮引起的体重增加和脂肪扩增可能是改善机体胰岛素抵抗的作用机制之一。但是吡格列酮引起的水钠潴留仍然是引起充血性心衰的重要危险因素,对于心衰患者应谨慎使用[18]。
研究表明,皮下脂肪组织在胰岛素抵抗中发挥的重要作用,皮下脂肪组织PPAR-γ和GLUT-4高表达,有利于增加胰岛素敏感性,改善机体胰岛素抵抗程度,促进肥胖相关的机体代谢综合征的良性转化[19]。本研究不足之处是未对皮下脂肪组织病理及胰岛素抵抗相关基因进行检测,有待于进一步深入研究。
吡格列酮作为PPAR-γ激活剂,可以改善肥胖-糖尿病大鼠的胰岛素抵抗,纠正ZDF大鼠的高脂血症、高血糖症。以往研究认为体重增加是吡格列酮的副作用,本研究认为吡格列酮引起的体重增加可能是其作用机制之一,即吡格列酮通过脂肪组织扩增,尤其是皮下脂肪组织扩增的方式,来储存机体过多的脂质,从改善机体的胰岛素抵抗程度。



