李涛浪,马志远,罗 迤,吕俊远,侯泽宇,张 淇,卢成丽,穆仁敏,汪 虎,程晓明,刘雪梅
(1.遵义医科大学附属医院 甲状腺乳腺外科,贵州 遵义 563099;2.遵义医科大学附属医院 消化内科,贵州 遵义 563099)
最新研究统计表明,乳腺癌是女性最为常见的恶性肿瘤,对女性的生命和健康带来严重威胁[1-2]。目前对乳腺癌的治疗以外科手术为主的综合治疗,其中化疗占重要地位。众所周知,化疗药物具有较强的局部刺激性及血管毒性,并且乳腺癌患者的化疗周期较长,因此反复多次的静脉血管穿刺输液,容易导致血栓形成及外周静脉炎的发生,当局部药物外渗时可能产生局部感染、溃烂经久不愈等严重后果,影响患者的生活质量和生命安全[3]。为避免上述情况的发生,中心静脉置管输液作为一种安全的输液途径已经完全替代外周静脉输液化疗[4-5]。1982年,Niederhuber等[6]首次报道了植入式静脉输液港(Implantable venous access port,IVAP,简称PORT)在临床中的应用。因其具有较少的血管并发症、较低的局部感染和导管移位发生率、且易于护理等优点,PORT在乳腺癌临床领域被广泛应用[7]。现将遵义医科大学附属医院甲状腺乳腺外科1 031例乳腺癌患者使用IVAP 进行化疗的应用情况及所发生的并发症和处理措施进行分析报道,以期使该技术的临床应用得到进一步优化,降低并发症的发生率,提高安全性,为患者的治疗保驾护航。
1 资料与方法
1.1 一般资料 收集2016年6月至2019年10月在本院甲状腺乳腺外科接受IVAP化疗的1 031例乳腺癌患者资料进行回顾性分析。其纳入适应证及禁忌证参照2017年中华医学会外科学分会乳腺外科学组制定的专家共识及技术操作指南[8]。适应证为需输入化疗药物的乳腺癌患者。禁忌证包括:①不能耐受手术;②凝血机制障碍;③对导管所含成分过敏;④拟植入部位皮肤感染;⑤植入部位具有放射治疗史,或局部组织影响 PORT稳定性;⑥拟植入深静脉有静脉炎和静脉血栓形成史。1 031例均为女性乳腺癌化疗患者,包括新辅助或者辅助化疗、肿瘤复发转移化疗的患者。考虑到需要接受手术及术后放疗等因素,根据植入部位分为4组(即右侧颈内静脉组、左侧颈内静脉组、右侧锁骨下静脉组及左侧锁骨下静脉组),对于植入部位的选择优先考虑肿瘤对侧的颈内静脉,若颈内静脉穿刺困难或不成功则选择锁骨下静脉,双侧乳腺癌患者优先考虑选择右侧颈内静脉。本研究方案已通过遵义医科大学附属医院医学伦理委员会审查批准。
1.2 材料 输液港是美国BARD公司生产的单腔标准型PORT(0603880C 普通港),由导管和注射座构成。导管由硅胶制成,放射可显影,近端可裁剪。注射座底面直径约25 mm,顶部为硅胶隔膜,能够耐受蝶翼针的反复穿刺。
1.3 手术步骤及随访 深静脉穿刺置管均采用塞丁格(Seldinger)穿刺技术。所有穿刺置管(颈内静脉或锁骨下静脉)均在超声引导下进行,在确认穿刺针进入静脉后,沿针芯放入导丝,拔出穿刺针,再用可撕裂鞘沿导丝扩张经皮通道及静脉壁(撕裂鞘需要沿导丝进入静脉腔内),拔出导丝,沿可撕裂鞘置入硅胶导管至合适深度,回抽见血后,去除可撕裂鞘。在锁骨中外1/3下方约2 cm胸壁处建立囊袋(若为锁骨下穿刺置管,则囊袋建立在穿刺点外下方3~5 cm处)。用牵引棒将导管近端经皮下由穿刺点牵引至注射座囊袋部位,剪裁后连接注射座,导管锁锁定。用蝶翼针穿刺注射座,再次回抽见血,并用生理盐水(含肝素)正压封管。最后将注射座固定于胸肌筋膜表面以防止术后港座翻转,常规关闭切口,包扎并标明日期。全程操作过程中注意保持导管的密闭性,防治空气栓塞的发生。术后常规拍片确认导管位置,理想的导管末端应位于T5~7水平[9-10]。周期维护或输注化疗药物前常规超声探查颈内静脉或锁骨下静脉观察导管情况,判断有无血栓形成,根据回抽及输液通畅情况,必要时再次拍片观察导管有无异位的发生。
1.4 观察指标 收集患者一般资料、PORT置入位置、手术完成时间、并发症情况及处理方式;每周期化疗及取出PORT前进行置港部位血管超声复查,观察有无导管相关血栓形成;住院期间及返院护理PORT时,检查其置港部位及肢体有无肿胀、感染,输注液体时是否通畅、渗漏等。
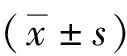
2 结果
2.1 一般资料 所有患者均为女性,年龄范围21~77岁,平均年龄(47.2±11.1)岁。输液港留置时间根据不同化疗方案所需时间决定,大部分至最后一次化疗结束或放疗结束拔出。留置时间5~512 d,平均(177.6±77.6)d。其中1例术后发生感染,于第5天取出。因需要靶向治疗,部分患者留置至靶向治疗结束。另有患者治疗期间复发转移,更换治疗方案,最长留置512 d取出。所有患者均顺利完成手术,无大出血、空气栓塞、血气胸等情况发生。
2.2 不同部位手术时间 经右侧颈内静脉穿刺置入输液港516例、经左侧颈内静脉穿刺置入460例、经右侧锁骨下静脉穿刺置入34例、经左侧锁骨下静脉穿刺置入21例。经右侧颈内静脉手术完成时间明显短于经左侧颈内静脉手术(37.6±7.5 vs 40.0±7.6 min,P=0.000 2)。右侧锁骨下及左侧锁骨下手术完成时间分别为39.6±7.4 min及41.6±11.6 min,与其它组置管比较无统计学意义(见表 1)。
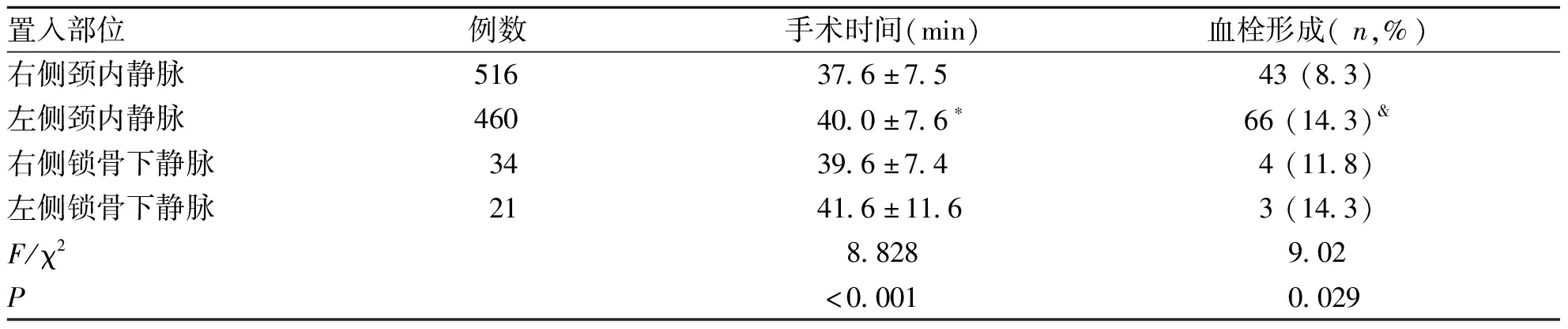
表1 不同手术部位手术时间及血栓形成情况
2.3 术后并发症 导管相关性血栓总发生率为11.3%(116/1 031),发生在术后3周至4月不等,不同置管路径的情况为:经左侧颈内静脉穿刺置管显着高于经右侧颈内静脉(14.3% vs 8.3%,P=0.029)。右侧锁骨下静脉有4(11.8%)例发生血栓,左侧锁骨下有3(14.3%)例发生血栓(见表 1)。所有患者未产生症状性血栓,无肺栓塞等情况发生。
整个留管期间发生回抽无血共77例(7.5%),主要发生在术后1d至3月,其中经右侧颈内静脉置管31例(6.0%),经左侧颈内静脉39例(8.5%),经右侧锁骨下静脉置管4例(11.8%),左侧锁骨下静脉置管3例(14.3%)。经左右侧颈内静脉置管比较差异无统计学意义(χ2=2.229,P=0.135);锁骨下静脉穿刺置管回抽无血比例高于颈内静脉,但无统计学差异。部分患者经调整体位,或肝素生理盐水冲洗后通畅。
导管异位12例,右侧颈内静脉置管4例,主要发生在术后1~3月,其中同侧锁骨下静脉异位1例,异位至对侧无名静脉3例。左侧颈内静脉5例,异位至左侧锁骨下静脉2例,右侧无名静脉3例。其中有1例左侧颈内静脉置管异位同时发生血栓,经常规处理无法通畅,最终予以拔除,改为中心静脉置管完成后续治疗。
共有7例(0.7%)发生感染,发生时间为术后2~30 d,其中,1例术后2 d出现囊袋处局部红肿,后出现畏寒发热等全身症状,于术后第5天拔除,经抗炎治疗好转;3例局部感染,锁骨下、颈部红肿、蜂窝织炎及脓肿形成,抗炎及局部治疗无效,拔除输液港后治愈;2例出现囊袋感染,皮肤溃烂、港体外露,无法使用,予以拔除;1例局部感染轻微,抗炎治疗后好转,继续使用。
港体外露6例(0.6%),发生在术后7~21 d,其中,2例因感染皮肤溃烂导致(最终拔除),另4例出现皮肤缺血坏死,后续感染,皮肤破溃,港体外露,重新修剪皮缘缝合2例,港体移位2例。
导管脱落2例,其中1例发生在治疗完成,取出输液港手术过程中,经检查发现脱落至右肺,最终采用介入手术取出,另1例发生在术后23 d,输液时因渗漏而局部肿胀,经超声检查,导管与港体连接脱落,重新切开皮肤,连接牢靠后正常使用。
3 讨论
化疗在乳腺癌的综合治疗中占据重要位置,由于辅助化疗多为6~8个周期,时间跨度较长达4~6个月,部分患者合并靶向治疗者可长达1年及以上,同时由于化疗药物的毒副作用容易引起的外周血管损伤、药物外渗、感染、皮肤溃烂且经久不愈等严重情况。故肿瘤患者经外周静脉化疗方法基本摒弃,目前临床上多采用中心静脉导管(Central venous catheter,CVC)、外周静脉植入的中心静脉导管(Peripherally inserted central catheter,PICC)或输液港置入的方法。与经输液港途径化疗相比,CVC留置时间仅1周左右,同时导管易脱出,每次周期化疗都需要穿刺,而多次穿刺容易形成血栓和瘢痕,且局部瘢痕形成后导致穿刺困难,患者后期心理压力大,易出现恐惧心理,甚至拒绝穿刺导致难以完成后续治疗。而PICC路径相对较长,容易发生穿刺点感染及血栓形成,且两者均不易护理,治疗期间不能淋浴,患者就医体验差,生活质量受影响。IVAP的植入可以为需要长期输液及化疗的患者提供安全可靠的静脉通路,可将各种浓度高、刺激性强的药物直接输送至中心静脉处,从而可以避免血管硬化和外周静脉炎等并发症的发生,还可有效防止药物外渗等因素造成的局部组织溃烂、坏死,并且体外无暴露点,长期留置情况下局部和全身感染率明显低于CVC级IVAP[11-12]。其次,患者日常活动基本不受限制,使用及维护方便,能保护患者隐私、提高生活质量及满意度[13-15]。目前国内外各大医疗中心IVAP基本普及,在穿刺路径上有多种选择,推荐经皮颈内静脉及锁骨下静脉穿刺置管,亦可选择贵要静脉、股静脉等[16]。在手术操作过程中推荐选择B超引导下穿刺或术前超声定位[8,17]。本研究中主要采取颈内静脉及锁骨下静脉穿刺置管,考虑到乳腺癌手术和术后放疗等因素的影响,首选病患对侧颈内静脉或锁骨下静脉进行穿刺置管,所有1 031例患者均在超声引导下穿刺置管成功。而右侧颈内静脉置管时间明显短于左侧颈内静脉(P=0.0002),这可能与血管解剖位置差异有关,右侧易于显露,同时术者站立于患者右侧,右手受干扰较小。
IVAP的并发症常见的有血气胸、气体栓塞、误穿动脉、导管异位、脱落、感染、导管断裂、血栓形成、输液不畅及港体外露等。并发症的总体发生率为 9.6%~38.0%[18-19],本研究中有220例发生并发症,发生率为(21.3%),低于张进泓等3 380例输液港的总体并发症为46.9%的报道[20]。其中发生率最高为导管相关性血栓形成,国内外文献报道其发生率为1.1%~35.5%[20-23],本研究中总发生率为11.3%,与既往报道基本一致,不同置管路径的情况为:经左侧颈内静脉穿刺置管显着高于经右侧颈内静脉(14.3% vs 8.3%,P=0.029)。可能与左右颈内静脉及无名静脉的解剖结构有关,右侧颈内静脉管径较左侧颈内静脉粗,且与头臂静脉、上腔静脉三者几乎成一直线,对导管管壁的冲洗力度更大,因此在实际工作中尽可能选择右侧颈内静脉植入路径[24],但也取决于肿瘤的位置及后续手术范围、是否放疗等因素。对于锁骨下静脉,考虑次选,锁骨下静脉植入路径易发生导管夹闭综合征。本报道中左右两侧锁骨下静脉共55例,其中7例发生血栓,所有患者未产生症状性血栓,相对安全,但可能样本量少,如增加病例数可能会出现相关并发症。
目前暂无相关指南推荐对于无症状性血栓的处理,所有患者均未予以溶栓或抗凝治疗;治疗结束后取输液港,无1例出现因血栓脱落所致的临床症状。临床操作过程中应在超声引导下穿刺,避免因反复穿刺造成血管壁损伤进而导致血栓的形成。后期应按时、规范进行维护。输液不畅或回抽无血是PORT应用中另一常见情况,文献报道其发生率为 4.3%~29.8%[25-26],我们观察到整个留管期间发生回抽无血共77例(7.7%),经左侧颈内静脉置管高于右侧颈内静脉置管,这与左侧颈内静脉置管血栓发生率较高具有一致性,但二者比较无统计学意义,经左、右侧锁骨下静脉置管发生率分别为14.3%及8.3%,高于颈内静脉,可能与导管走行于锁骨与第一肋骨之间的狭窄间隙有关。输液不畅或回抽无血临床上主要表现为以下两种情况:一种是回抽无回血且推注困难,分析原因主要有无损伤针插入港体侧壁过深或太浅、导管末端紧贴于血管壁上、纤维蛋白鞘或血栓形成、导管通路中出现打折及药物沉积等;另一种情况是回抽无回血但推注通畅,但局部无异常,主要与使用末端三向瓣膜导管、回抽手法不对和体位有关。处理方式包括调整患者头颈部偏向、上肢体位、肝素盐水冲洗或溶栓等[20]。本研究中有51例患者经过将头偏向非穿刺侧、调整患者枕头高度、或上抬上肢后抽回血成功;13例重新调整蝶翼针后成功回抽见血,输液通畅。但有13例患者经过上述处理仍无回血,但静脉推注无阻力,输液通畅,局部无肿胀。这多与附壁血栓形成导致回抽时封堵导管有关,可以考虑先试输一定的生理盐水,若无异常,则继续使用IVAP。
导管异位是输液港手术后常见的早期并发症之一。由于其导管尖端位于上腔静脉以外的其它静脉内,故在输液时可能影响静脉的血流或输注液体的流向,使患者产生局部不适的症状,也可能会使血栓形成的风险增加[27]。Gurkan等报道有0.3%~6%的患者会发生导管异位[19],而本组患者的导管异位发生率仅为1.1%(12/1031)。分析可能与置管长度不够或术后上肢活动幅度较大等因素有关,对其处理的文献报道也存在争议,有学者主张在X线透视下或在DSA下行介入手术调整复位[19,28],也有作者认为没有必要对异位导管进行调整[29]。本组中有1例左侧颈内静脉置管异位且同时发生血栓,经常规处理无法恢复通畅,最终予以拔除,改为中心静脉置管完成后续治疗。其余11例均顺利完成治疗,因此我们认为,异位产生可根据不同情况进行分别处理,如合并发生血栓可试行溶栓,如无效,血栓稳定情况下则拔除,其它情况可继续使用。
导管相关性感染包括局部感染和导管相关血流感染。文献报道其发生率为3%~10%[20,30]。我们观察到共有7例(0.7%)发生感染,其中1例全身感染,6例局部感染。最终拔除6例,1例局部感染轻微,抗炎治疗后好转,继续使用,但应注意围手术期的无菌操作。另外,乳腺癌患者,化疗骨髓移植,免疫力低下也是导致感染的因素,要引起足够的重视。
本研究中港体外露6例,发生率为0.6%,与文献报道一致[20],其中2例因感染导致皮肤溃烂,最终拔除;重新修剪皮缘缝合2例,港体移位2例。除感染外,其它原因为皮囊厚度不够,或锁骨下皮囊切口过于紧靠锁骨下缘,缝合后张力过大,加之肢体活动影响切口愈合,最终裂开,这些均应引起关注,加以防范。
另有少见并发症产生,如导管的脱落,是最为严重的并发症之一。断裂脱落的导管会随着血流方向移动,严重者可能会导致心律失常、肺栓塞等严重并发症[31]。文献报道IVAP导管脱落或断裂的发生率为0.1%~1.6%[20-21],本研究中有2例导管脱落,其中1例发生在治疗完成后,取出输液港过程中,因操作者经验不足,误将连接港体处导管剪断,而未及时处理,其后经检查发现已脱落至右肺动脉,最终采用介入手术取出,另1例发生在术后23d,输液时渗漏局部肿胀,超声检查,导管与港体连接脱落,重新切开皮肤,将导管与港体连接牢靠后正常使用,分析原因可能与初次手术时连接不牢靠,加之患者活动幅度过大有关,抑或产品本身质量有关。
综上所述,植入性静脉输液港是乳腺癌病人化疗可选择的静脉通路,其临床应用前景广泛,可应用至所有需要接受化疗的肿瘤患者以及长期输液的患者。安全可靠,患者满意度高,但有一定的并发症,经右侧颈内静脉置管是优选。感染和导管断裂是导致非正常取港的主要原因。临床应用中应充分评估患者具体情况,遵循指南及专家共识,按要求进行使用和维护以降低并发症的发生。



