吴 慧,符起亚, 张旭凤 ,董 明,罗 文
(1.海南医学院第一附属医院 口腔科,海南 海口 570102;2.大连医科大学 口腔医学院,辽宁 大连 116044)
口腔种植已经被广泛应用于牙齿缺失的修复治疗中,成功的骨整合和种植体在口腔中的长期稳定性对于种植修复的成功是十分重要的[1]。但是,种植体周围炎是一种造成种植体修复失败的常见疾病,进而造成了种植体的脱落[2]。Tsarev等[3]指出种植体周围骨稳态取决于牙槽骨与种植体的骨结合。宿主细胞防御细菌攻击是造成种植体周围组织损伤的主要原因。淋巴细胞、巨噬细胞以及中性粒细胞被免疫系统募集和激活,并诱导局部炎症反应在骨组织中产生细胞因子和趋化因子[4]。抗炎细胞因子和趋化因子是种植体周围炎发病过程中炎症和免疫的重要介质[5]。因此,必须深入探索种植体周围炎的潜在分子机制,优化骨再生疗法。
MicroRNA(miRNA)包括一类小的非编码,属于内源性RNA分子。它们长约22个核苷酸。miRNA可以抑制靶向基因的转录,进而调控靶基因的表达[6]。研究表明,miR-214可以调节成骨细胞分化和骨形成。miR-182可能通过抑制破骨细胞分化,进而改善骨质疏松症发生[7]。miR-21和miR-133可以促进小鼠骨骼成肌细胞增殖[8]。上述研究均表明miRNA在骨平衡代谢中扮演了重要的角色[9]。miRNAs介导成骨细胞以及破骨细胞的增殖、衰老和分化,使miRNAs成为骨病的新治疗靶点[10]。
miR-128在细胞的增殖、分化及凋亡中起到了重要的作用,早期研究表明miR-128主要位于大脑中,在癫痫病、抑郁症和阿尔茨海默氏病等神经系统疾病中起到了重要的作用[11]。另外miR-128与肺癌、神经胶质瘤、乳腺癌、神经胶质瘤、胰腺癌和甲状腺癌等多种肿瘤的发生发展密切相关[12]。最近的研究报道指出miR-128参与了骨代谢疾病,包括质疏松症,类风湿病关节炎和骨关节炎的发生[13]。但是关于miR-128在种植体周围炎中的作用尚无报道指出。本课题组在之前的实验中,对种植体周围炎临床样本进行miRNA测序,发现miR-128表达差异明显,本实验通过检测miR-128在种植体周围炎组织中的表达情况,通过加入miR-128 inhibitor(抑制物)及mimics(模拟物),检测miR-128对于成骨细胞的增殖及分化的影响,在分子水平为种植体周围炎的治疗提供依据。
1 材料与方法
1.1 实验材料 RAW264.7细胞(中科院上海细胞库);RANKL(sigma公司)Lipofectamine RNAi MAX Reagent (13778-075,Invitrogen);miR-128 inhibitor(抑制物)及mimics(模拟物)(AM11746,Ambion);DMEM培养基(HyClone);TransStart® Tip Green qPCR SuperMix(TransGen Biotech);TRAP染色(sigma公司);CCK8(日本同仁化学)
1.2 方法
1.2.1 临床样本收集 收集2018年7月至2019年11月期间于海南医学院第一附属医院口腔科就诊的种植体周围炎患者(10例种植体周围炎组织)和正畸拔牙患者(10例健康牙龈组织)组织,所有患者均签署知情同意书。项目实施得到海南医学院第一附属医院伦理委员会批准(伦:2018002)。
纳入和排除标准:本次课题选取种植体周围炎患者均为微生物引起的种植体周围炎,排除因器械等原因引起的种植体周围炎,按照欧洲牙周病联合会与美国牙周病学会定义的《种植体周围炎诊断标准》[14]进行病例筛选,具体纳入标准如表1所示。排除标准:非生物并发症引起的种植体周围炎。

表1 种植体周围炎纳入标准
1.2.2 Real-time PCR 采用离心柱法提取样本总RNA,研磨棒研磨至匀浆状,室温静置10 min,4 ℃ 12 000 r/min 离心10 min,加200 μL氯仿EP 管中,剧烈震荡30 s,放置3 min,吸取200 μL上层水相至另一EP 管,加入100 μL无水乙醇,混匀,离心2 min,10 000 r/min 离心30 s。按照SYBR ® Premix ExTaqMⅡ配制Real-Time PCR反应液,加入样本cDNA,按照95 ℃ 30 s,95 ℃ 5 s,60 ℃ 30 s,95 ℃ 15 s进行40个循环。采用2-ΔΔCt法来计算目的基因表达相对量。miR-128-3p(F1:GGTCACAGTGAACCGGTC,F2:GTGCAGGGTCCGAGGT); U6(F1:CTCGCTTCGGCAGCACATATACT,F2:ACGCTTCACGAATTTGCGTGTC);TRAP (F1:AGCGCCTTCGGTCCAGTTGC,F2:TGCCAGTGCCTCTTTGCTGCT));GAPDH (F1:GATTCCACCCATGGCAAATTCC,F2:CACGTTGGCAGTGGGGAC)。
1.2.3 RAW264.7细胞诱导为破骨细胞及破骨细胞鉴定 复苏RAW264.7细胞后,采用含有10% FBS的DMEM培养基培养。加入100 ng RNAKL。诱导细胞5 d后,进行鉴定。
1.2.4 细胞转染 参考Lipofectamine RNAi MAX Reagent,取对数期破骨细胞(1×104/mL),待细胞贴壁后,加入转染试剂和40 nM miR-128 inhibitor及mimics。转染试剂按配制两个EP管,分别为Tube 1(RNA)及Tube 2 (Transfection Polymer)。其中Tube 1包括5 μL siRNA和95 μL Xfect 反应缓冲液,Tube 2包括10 μL Xfect siRNA Polymer和90 μL Xfect 反应缓冲液。漩涡混匀各管混合物,速度漩涡10 s,室温孵育10 min,将200 μL复合物逐滴加入细胞培养基中,8 h后换液,48 h后Real-time PCR检测转染效率;
1.2.5 CCK8细胞增殖实验 将转染miR-128 inhibitor及mimics的破骨细胞(3 000个/孔)及对照组加入10 μL CCK8试剂,待24、48 h后采用酶标仪检测细胞增殖情况。按照CCK8说明书进行操作,酶标仪测定450 nm的吸光光度值。
1.2.6 Western blot 细胞蛋白质提取,静置1 h;配制反应液。将转染miR-128 inhibitor及mimics的破骨细胞加入蛋白裂解液,静置后4℃ 6 000 r/min 15 min。采用BCA法蛋白质定量,计算蛋白浓度。在样品中加入1/5体积的5X蛋白上样缓冲液,混匀后95 ℃煮8 min,按20 μg每孔加入样品,通电后进行电泳,转膜后加入一抗TRAP(1∶1 000)、GAPDH(1∶2 000),4 ℃孵育过夜,加入二抗,室温孵育1 h,采用HRP-ECL发光。
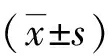
2 结果
2.1 患者一般情况分析 种植体周围炎组与对照组在年龄及性别无统计学差异,说明本实验纳入病例范围没有差异,如表2所示。

表2 患者情况分析
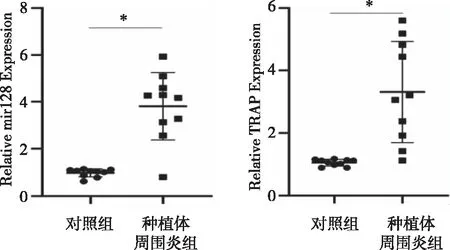
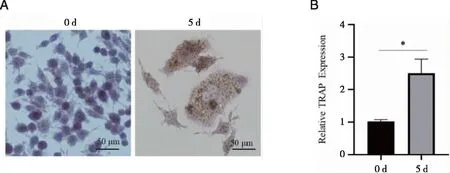
2.2 miR-128及TRAP在种植体周围炎样本中的表达 Real-time PCR检测结果显示, miR-128以及TRAP在种植体周围炎患者炎性组织中表达均高于对照组(P<0.05),如图1所示。相关性分析结果显示,miR-128与TRAP在种植体周围炎患者炎性组织中存在中度相关性(r=0.527,P<0.05),提示miR-128与骨破坏标志因子TRAP有一定的相关性,如图2所示。
*:与对照组比较,P <0.05。 图1 miR-128及TRAP在种植体周围炎患者组织和对照组组织中的表达
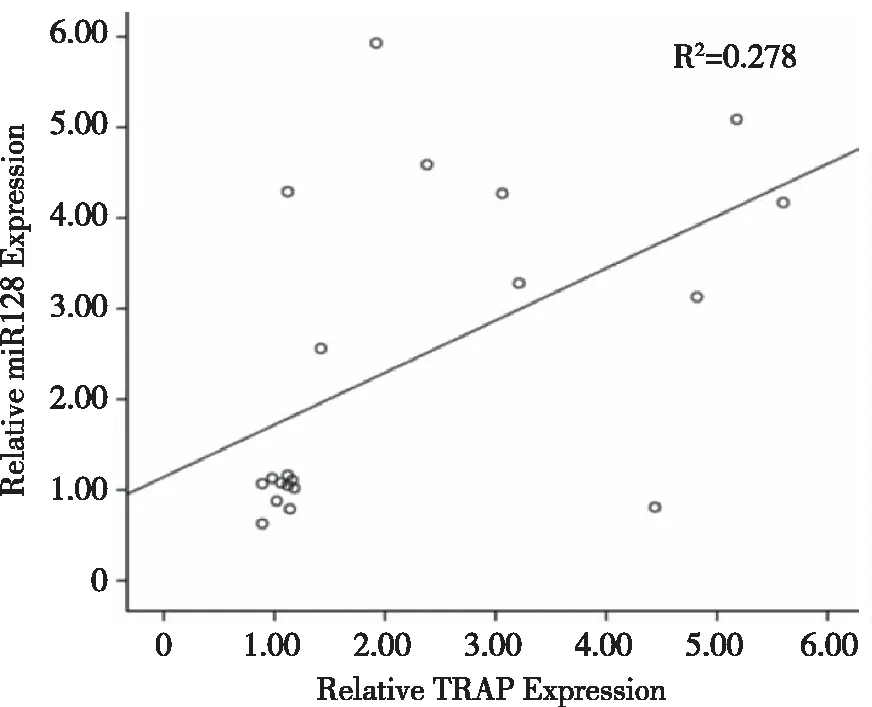
图2 miR-128及TRAP在种植体周围炎组织中的相关性分析
2.3 诱导RAW264.7细胞为破骨细胞鉴定 形态学鉴定TRAP结果显示,相对于未诱导的RAW264.7细胞的细胞形态由圆形或类圆形变为多核细胞,且细胞核≥3,结果如图3A所示。Real-time PCR结果显示,与未诱导(0 d)相比,诱导5 d后,TRAP的基因表达相对量高于对照组(P<0.05),结果如图3B所示,上述实验表明破骨细胞诱导成功。
A:TRAP染色结果显示破骨细胞诱导成功(×200);B:Real-time PCR检测诱导细胞5 d后,TRAP基因表达结果;* :P <0.05。 图3 诱导RAW264.7细胞为破骨细胞鉴定
2.4 miR-128inhibitor及miR-128mimics转染破骨细胞的转染效率 Real-time PCR 检测转染效率结果显示,miR-128 inhibitor转染破骨细胞后,miR-128的表达相对量低于Mock组及inhibitor NC组(P<0.05),Mock组及inhibitor NC组之间无统计学差异(P>0.05),如图4A所示。miR-128 mimics转染破骨细胞后,miR-128的表达相对量高于Mock组及Negative control组,(P<0.05),Mock组及Negative control组之间无统计学差异(P>0.05),如图4B所示。
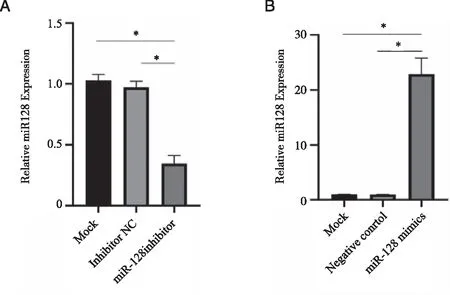
A: miR-128 inhibitor转染破骨细胞的转染效率;B: miR-128 mimics转染破骨细胞的转染效率;*: P <0.05。图4 miR-128 inhibitor及miR-128 mimics转染破骨细胞的转染效率
2.5 miR-128 促进破骨细胞的增殖能力 CCK8结果显示,miR-128 inhibitor转染破骨细胞24、48、72 h后,破骨细胞增殖能力随时间推移而降低,miR-128 inhibitor组细胞增殖能力低于Mock组及inhibitor NC组,Mock组及Inhibitor NC组之间破骨细胞的增殖能力在72 h之内无显着变化(P>0.05),结果如图5A所示。miR-128 mimics转染破骨细胞24、48、72 h后,破骨细胞增殖能力随时间推移而升高,miR-128 mimics组细胞增殖能力高于Mock组及Negative control组(P<0.05),Mock组及Negative control组之间破骨细胞的增殖能力在72 h之内无显着变化(P>0.05),结果如图5B所示。
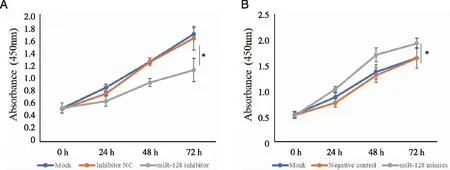
A:CCK8结果显示miR-128 inhibitor抑制破骨细胞增殖;B:miR-128 mimics促进破骨细胞增殖;*:与miR-128 inhibitor组比较,P <0.05;与miR-128 mimics组比较,P <0.05。图5 miR-128促进破骨细胞的增殖能力
2.6 miR-128 促进破骨细胞的分化能力 miR-128 inhibitor转染破骨细胞后,miR-128 inhibitor组TRAP的基因表达低于Mock组及inhibitor NC组(P<0.05),Mock组及inhibitor NC组之间无显着变化(P<0.05)。miR-128 mimics组TRAP的基因表达高于Mock组及Negative control组(P<0.05),Mock组及Negative control组之间无显着变化,结果如图6A所示。miR-128 inhibitor转染破骨细胞后,miR-128 inhibitor组的TRAP的蛋白相对于Mock组及inhibitor NC组表达降低,结果有统计学差异(P<0.05)。miR-128 mimics转染破骨细胞后,miR-128 mimics组的TRAP的蛋白相对于Mock组及Negative control组表达增高,结果有统计学差异(P<0.05),结果如6B、C所示。
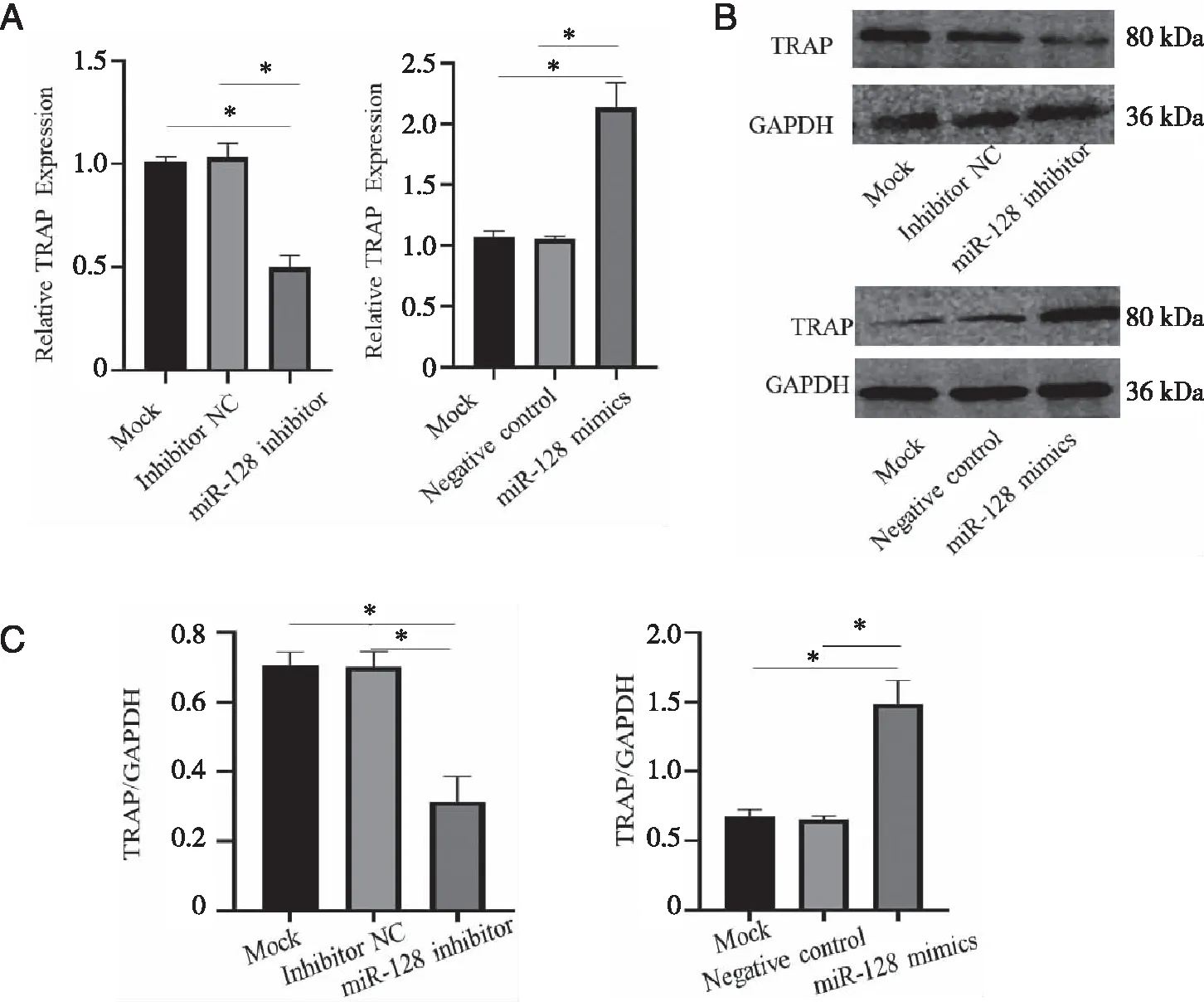
A:Realtime PCR检测miR-128 inhibitor及miR-128 mimics后TRAP的基因表达情况;B和C:Western blot检测miR-128 inhibitor及miR-128 mimics后TRAP的蛋白表达情况;*:与miR-128 inhibitor组比较,P<0.05;与miR-128 mimics组比较,P<0.05。图6 miR-128 inhibitor及miR-128 mimics后各组破骨细胞TRAP基因及蛋白的表达
3 讨论
种植体周围炎是种植体修复失败的主要原因之一。研究表明,28%~56%的患者和12%~40%的部位在种植术后会发展成种植体周围炎[15-16]。种植体周围炎的发生率随着时间的推移逐渐增加。在种植体周围炎的早期,巨噬细胞、中性粒细胞和淋巴细胞被募集到植体周围并被激活,这些细胞分泌促炎因子和趋化因子[2]。在种植体周围炎的中晚期,破骨细胞被激活。局部出现炎症微环境,导致种植体牙槽骨出现吸收并导致种植体的修复失败[17]。最近的研究表明,一些miRNA可以通过多种信号通路参与种植体周围炎的炎症调节和骨骼重塑[18]。
本实验对miR-128在种植体周围炎炎性样本中的表达进行检测,结果显示同其他炎性骨破坏疾病一样,miR-128在种植体周围炎炎性样本中表达增高,同时也检测了骨破坏标志因子TRAP的表达情况,并将miR-128与TRAP的表达进行了相关性分析,发现miR-128与TRAP的表达有相关性,提示miR-128与种植体周围炎的骨破坏有关,miR-128也有可能作为预防和治疗种植体周围炎的有效靶点。本实验中,通过加入miR-128的抑制剂,检测破骨细胞的增殖情况,结果表明miR-128可以促进破骨细胞的增殖,同时检测了TRAP基因及蛋白的表达情况,结果表明,抑制miR-128可以抑制TRAP的表达,说明miR-128可以促进破骨细胞的分化。抗酒石酸酸性磷酸酶(Tartrate-resistant acid phosphase,TRAP) 是破骨细胞的特异性标志酶。在骨代谢生化指标临床应用专家共识( 2020)中被认为是骨吸收标志物[19]。TRAP是破骨细胞分化的重要指标,研究表明TRAP表达越多,破骨细胞分化能力越强[20]。本实验将miR-128 inhibitor及miR-128 mimics转染破骨后,以TRAP作为检测破骨细胞分化的指标。
miR-128参与巨噬细胞引起的炎症和氧化应激作用进而促进破骨细胞的分化,在小鼠类风湿性关节炎模型中,miR-128的抑制显着抑制了通过抑制NF-κB的活性[21]。此外,在大鼠骨关节炎模型中,miR-128通过破坏Atg12导致自噬和加剧膝关节骨关节炎[22]。此外,学者发现miR-128在骨关节炎中显着上调[23]。总体而言,miR-128可能在促进关节炎。抑制miR-128可能是一种有效的方法预防和治疗小鼠类风湿性关节炎和骨关节炎的发生[23]。而种植体周围炎也是一种细菌引起的骨组织破坏疾病,研究表明miR-128在炎症诱导的破骨细胞分化中起到了重要的作用。最近的报道指出miR-128的过表达加剧TNF-α诱导的骨髓基质细胞的表达,也有报道指出miR-128通过靶向SIRT1 / NF -κB信号传导途径促进小鼠破骨细胞分化,也有报道指出抑制miR-128对骨质流式有保护作用。这部分结果与我们的实验结果一致。
通过上述的结果证明了miR-128在种植体周围炎中起到了促进破骨细胞增殖与分化的作用,但是它具体通过何种机制,是以后需要进行研究的问题。



