马金花,黄 佩,吴柳松,罗南都,何志旭,陈 艳,4
(1.遵义医科大学附属医院 小儿内科,贵州 遵义 563003;2.贵州省儿童医院 小儿内科,贵州 遵义 563003;3.遵义医科大学 组织损伤修复与再生医学省部共建协同创新中心,贵州 遵义 563003;4.贵州茅台医院,贵州 仁怀 564500)
地中海贫血(thalassemia)是一种由基因缺陷导致人体珠蛋白(α和/或β-珠蛋白)合成受阻,从而引起贫血或临床病理状态的一种遗传性溶血性贫血疾病,通常分为α地贫和β地贫[1-2]。据统计,全世界每年有70 000名各种类型的地贫儿童出生[3],我国是地贫的高发国家,在南方地区发病率为9.70%~50.15%不等[4]。重型患者需长期输血及去铁治疗,目前唯一能根治的方法是行造血干细胞移植[5],但是价格较昂贵,且配型及移植后并发症等问题限制了其广泛应用,给患者家庭及全社会带来巨大的经济和心理负担[6]。对地贫高危人群进行基因诊断,为育龄期的地贫患者或携带者提供适合的生育指导,以及对高风险夫妇的胎儿进行产前诊断及遗传咨询以避免重型地贫患儿的出生,是国内外公认的首选预防措施[7-8]。
既往地贫诊断的策略是先在人群中进行血常规及血红蛋白电泳检查,随后对上述两项出现异常者再进行基因检查以明确[9]。但血常规及血红蛋白电泳检查不能明确基因类型,常规的地贫基因筛查试剂盒仅能检出有限的地贫基因类型,无法检测出未知的突变,因此存在一定的漏诊及误诊[7, 10]。近年来诞生了第三代测序(third-generation sequencing,TGS)技术,该方法的特点为单分子测序(single molecule sequencing,SMS)和实时测序[11],在特定序列的单核苷酸多态性(single nucleotide polymorphism,SNP)检测、稀有突变及其频率测定中具有优势[1],得到了越来越广泛的应用。因此,为探讨三代测序在地贫诊断中的应用,本研究选取200例可疑地贫者进一步行三代测序明确地贫的基因型、构成比及分布等,为地贫的诊断及治疗提供理论依据。
1 对象与方法
1.1 对象及诊断标准 选取200例疑似地贫且血样本符合检测要求的我院门诊患者进行研究。查血常规及血红蛋白电泳进行初筛,依据初筛结果分为初筛阳性组和初筛阴性组,然后进一步行第三代测序检测。地中海贫血的诊断参考《α-地中海贫血的临床实践指南》及《β-地中海贫血的临床实践指南》中的标准[12-13]。本研究通过遵义医科大学附属医院生物医学研究伦理委员会审查(伦理审查批件号:KLL-2023-532)。
1.2 检测方法 血常规及血红蛋白电泳检测均于遵义医科大学附属医院临床检验科完成,以平均红细胞体积(MCV)<80 fL(正常参考值范围80~94 fL)和/或平均红细胞血红蛋白量(MCH)<26 pg(正常参考值范围26~32 pg)和/或血红蛋白F(Hb F)>2%(正常参考值范围≤2%)和/或血红蛋白A2(Hb A2)<2.5%或>3.5%(正常参考值范围2.5%~3.5%)定为地贫初筛阳性,其中,Hb A2<2.5%视为α地贫初筛阳性,Hb A2>3.5%和/或Hb F>2%视为β地贫初筛阳性。初筛后剩余外周血样本送贝瑞基因(北京贝瑞和康生物技术有限公司),先进行基因组DNA提取,核酸分析仪检测DNA浓度和纯度合格后进行三代测序,测序平台为pacific biosciences(PacBio)sequel。
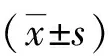
2 结果
2.1 受检者基本信息及地贫初筛结果 共纳入200例研究对象,男性92例,女性108例,年龄19~40(27.07±5.18)岁,汉族35例,少数民族165例,其中侗族76例,苗族44例,布依族21例,壮族11例,水族10例,瑶族3例;依据地中海贫血初筛标准,初筛阳性者120例(其中α地贫初筛阳性51例,β地贫初筛阳性41例,其余28例无法确定初步分型),男性57例,女性63例,其中汉族24例,侗族47例,苗族28例,水族7例,布依族7例,壮族6例,瑶族1例;初筛阴性者80例。初筛阳性组与阴性组性别、年龄及民族分布比较,差异无统计学意义(P>0.05,表1)。
2.2 血常规及血红蛋白电泳筛查结果 200例疑似地贫患者依据初筛结果分为地贫初筛阳性组和阴性组,其血常规(MCV、MCH)及血红蛋白电泳(Hb F、Hb A2)结果如下(表2)。
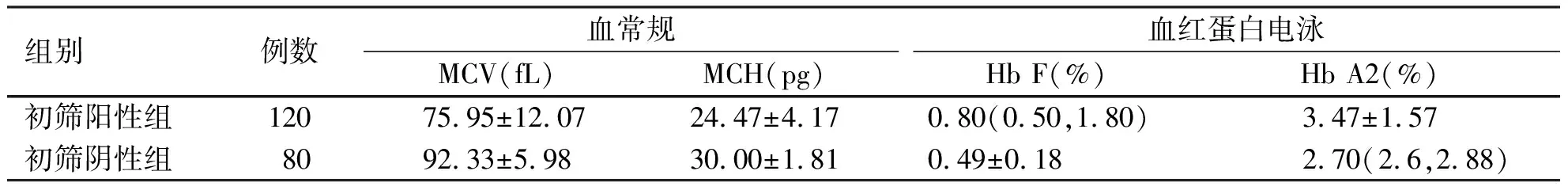
表2 血常规及血红蛋白电泳结果
2.3 第三代测序结果
2.3.1 地贫初筛阳性组及阴性组中基因阳性情况 地贫初筛阳性组(120例)行第三代测序共检出地贫基因阳性84例,基因阳性率70.0%(84/120),其中α地中海贫血47例(56.0%,47/84),β地贫34例(40.5%,34/84),α/β复合地中海贫血基因型3例(3.6%,3/84),地贫基因阴性36例(30.0%,36/120)。地贫初筛阴性组(80例)行第三代测序共检出地贫基因阳性28例,基因阳性率35.0%(28/80),其中α地贫23例(82.1%,23/28),β地贫4例(14.3%,4/28),α/β复合地中海贫血基因型1例(3.6%,1/28),地贫基因阴性52例(65.0%,52/80)。两组间地贫类型构成的差异有统计学意义(P<0.05),初筛阳性组较阴性组的β地贫占比高,初筛阴性组较阳性组的α地贫占比高(表3)。
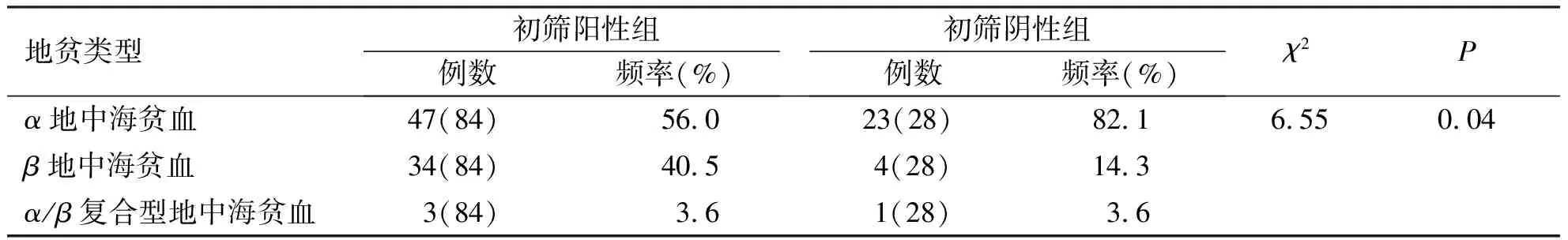
表3 地中海贫血基因阳性分布情况
2.3.2 地贫基因阳性组中不同基因型之间、不同基因型与基因阴性组之间常规筛查指标比较 (1)地贫初筛阳性组中按基因结果分为基因阳性组和基因阴性组,基因阳性中再依据不同基因型分类,比较地贫基因阳性组中不同基因型之间、不同基因型与基因阴性组之间血常规及血红蛋白电泳结果,发现:α地贫中,Hb CS杂合的MCH值、Hb WS杂合的Hb A2值均较--SEA/αα高,差异有统计学意义(P<0.05);--SEA/αα和-α3.7/αα的Hb A2值、CD17的MCH值均较基因阴性组低,-28的MCV、MCH及Hb A2值和CD41-42、CD17的Hb A2值均较基因阴性组高,差异有统计学意义(P<0.05)。其余组间差异无统计学意义(P>0.05,表4)。
(2)地贫初筛阴性组中,比较地贫基因阳性组中不同基因型之间、不同基因型与基因阴性组之间血常规及血红蛋白电泳结果,发现:α地贫中,-α4.2/αα的MCV值、-α3.7/αα和-α4.2/αα的MCH值均较--SEA/αα低,差异有统计学意义(P<0.05);-α4.2/αα的MCV值、-α3.7/αα和-α4.2/αα的MCH值、-α3.7/αα和Hb CS杂合的Hb A2值均较基因阴性组低,差异有统计学意义(P<0.05)。其余组间差异无统计学意义(P>0.05,表5)。
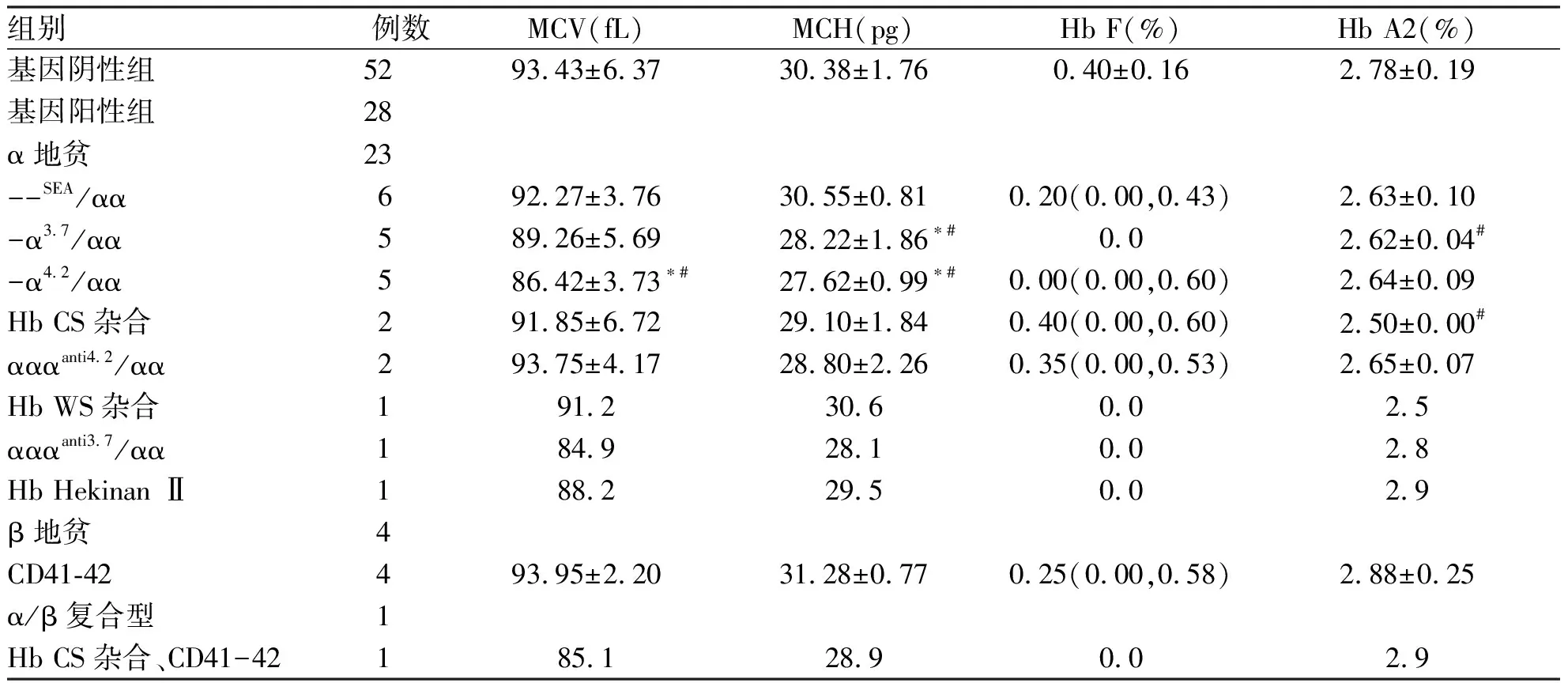
表5 初筛阴性组中基因阳性与阴性组血常规及血红蛋白电泳比较
2.3.3 初筛阳性及阴性组中地贫基因型及分布情况 初筛阳性组的84例基因阳性者中,α地贫47例,以--SEA/αα(46.8%,22/47)及-α3.7/αα(25.5%,12/47)突变型为主;初筛阴性组的28例基因阳性患者中,α地贫23例,以--SEA/αα(26.1%,6/23)、-α3.7/αα(21.7%,5/23)及-α4.2/αα(21.7%,5/23)突变型为主(表6)。

表6 两组中α地中海贫血基因型及分布
初筛阳性组中,β地贫34例,以CD41-42(52.9%,18/34)及CD17(35.3%,12/34)突变型为主;初筛阴性组中,β地贫4例,均为CD41-42(100.0%,4/4,表7)。
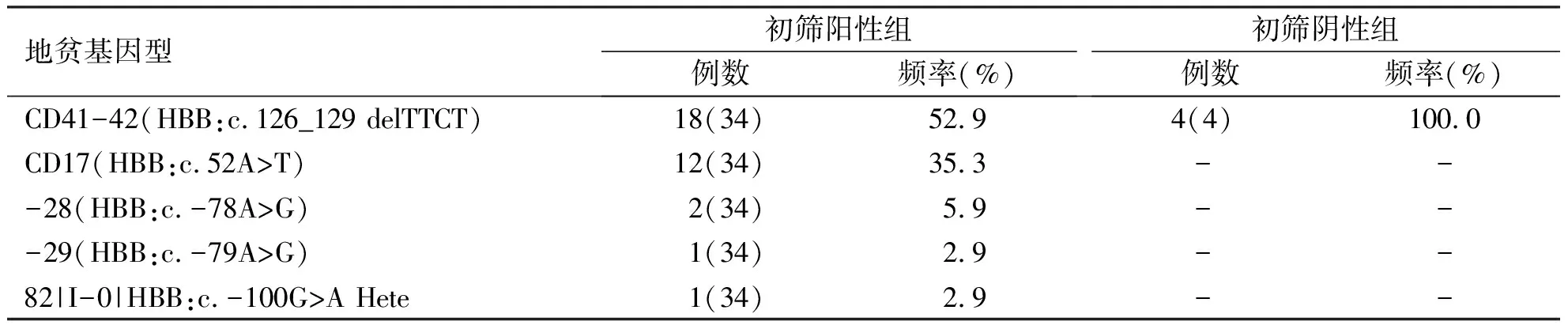
表7 两组中β地中海贫血基因型及分布
初筛阳性组中,α/β复合地中海贫血基因型3例;初筛阴性组中,α/β复合型地贫1例,为Hb CS杂合复合CD41-42型(表8)。

表8 两组中α/β复合型地中海贫血基因型及分布
2.3.4 地贫基因民族分布 三代测序共检出地贫基因阳性112例,其中α地贫70例,共11种基因型,主要基因型--SEA/αα和-α3.7/αα在侗族分布最多,其次为苗族和汉族。β地贫38例,共5种基因型,主要基因型CD41-42在侗族分布最多,其次为布依族和汉族;基因型CD17在侗族分布最多,其次为汉族。α/β复合地中海贫血4例,共4种类型,在侗族、苗族、布依族和瑶族中各1例(表9)。
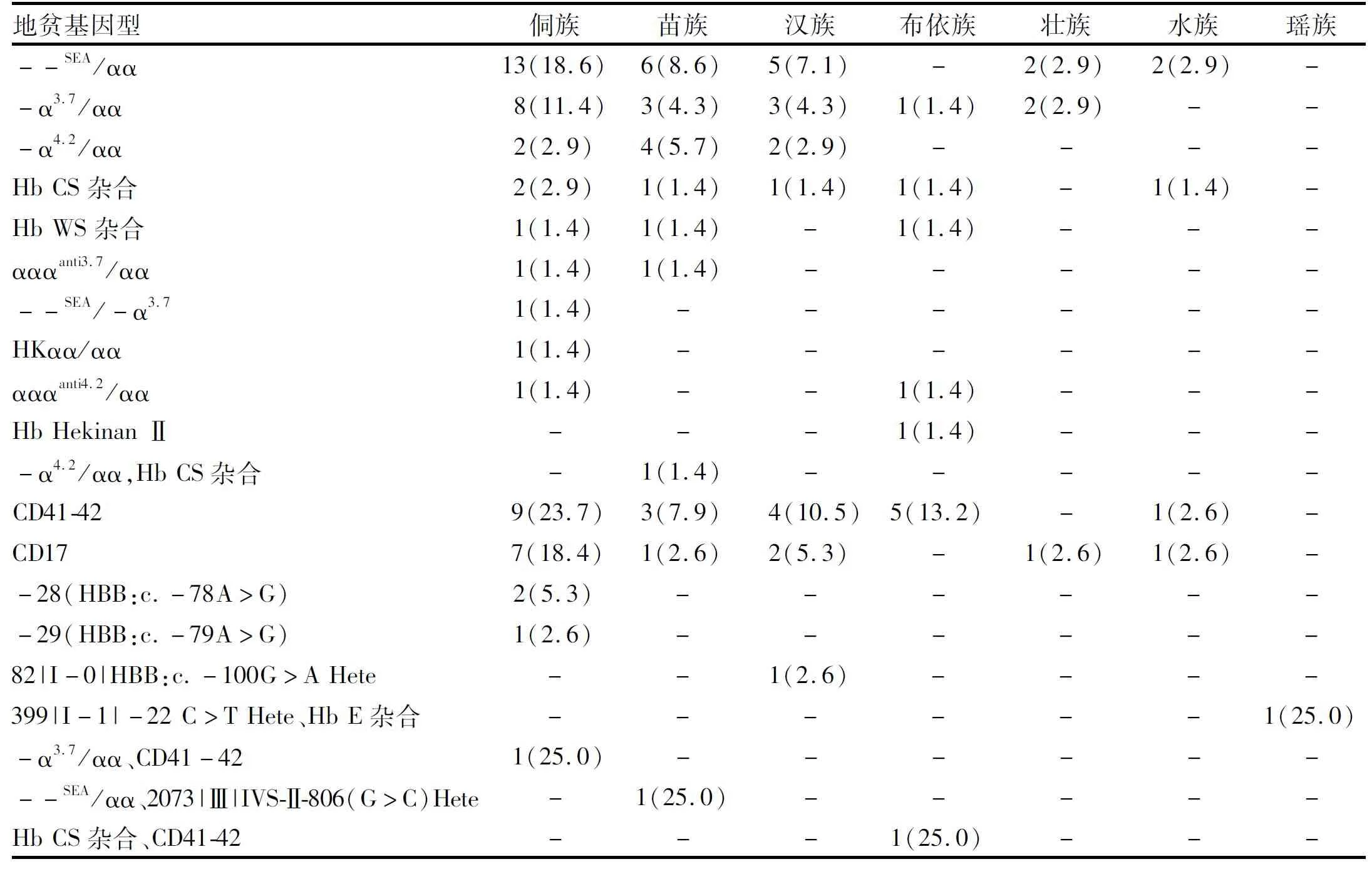
表9 各民族中地中海贫血基因型及分布[例(%)]
2.3.5 第三代测序检出的地贫基因型种类 经查阅文献,常规地贫基因检测试剂盒主要能检测出以下26种基因类型:--SEA/αα、-α3.7/αα、-α4.2/αα、Hb CS杂合、Hb WS杂合、Hb QS杂合、IVS-Ⅱ-654(HBB:c.316-197 C>T)、-28(HBB:c.-78A>G)、-29(HBB:c.-79A>G)、-30(T>C)、-31(A>C)、-32(C>A)、CD14-15(HBB:c.45-46 ins G)、CD15-16(+G)、CD17(HBB:c.52A>T)、IVS-I-5(G>C)、CD30(A>G)、IVS-I-I(G>T)、CD26(G>A)、CD27-28(HBB:c.84-85 ins C)、CD41-42(HBB:c.126_129 delTTCT)、CD43(HBB:c.130G>T)、CD37(G>A)、CD71-72(HBB:c.216-217 ins A)、IVS-Ⅱ-5(G>C)、-73(A>T)和-90(C>T)。
本研究中经第三代测序共检出18种不同地贫基因型,其中有8种(44.4%,8/18)是常规试剂盒无法检出的类型,分别为αααanti3.7/αα、αααanti4.2/αα、--SEA/-α3.7、Hb Hekinan Ⅱ、HKαα/αα、82|I-0|HBB:c.-100G>A Hete、399|I-1|-22 C>T Hete和2073|Ⅲ|IVS-Ⅱ-806(G>C)Hete;其中4种(22.2%,4/18)为罕见突变类型,如香港型和1例位于内含子处的突变类型。表10所示的4种地中海贫血基因型为本研究中第三代测序检出的已报道过的罕见地贫基因类型。

表10 第三代测序检出的罕见突变基因型
3 讨论
地中海贫血是一种严重威胁人类健康、导致死亡和残疾的遗传性血液病[14],目前唯一的治愈方法是异基因造血干/祖细胞(HSPCs)移植,但该方法受到供体及移植后并发症等多种因素限制[15]。地贫已成为了世界性的重大公共卫生问题[16-17],重型地贫一旦漏诊,将会给患者家庭及社会带来沉重的负担,因此,为提升全民健康水准,基于该病目前的发病及治疗形势,需要从准确的检测出发,提高人群检出率,避免重型患儿的出生。
地中海贫血临床症状的轻重因基因型而异,严重者可因胎儿水肿而胎死腹中,重型患者多需终生输血及袪铁治疗,携带者往往没有典型的临床症状,而血常规和血红蛋白电泳检测结果不具特异性,因此,做为地贫初筛的方法不仅无法明确诊断,也可能遗漏部分患者[18-19]。随着基因测序技术的出现、发展及进步,为人类基因组的表征做出了巨大的贡献,彻底改变了临床基因诊断和研究方法[11,20]。第一代测序技术运行时间短,但每个反应只能获得一个阅读长度,不适合大规模高通量测序[21],第二代测序技术由于测序仪器、试剂和生物信息学技术人员的高成本一定程度上影响了自身的应用,而近年来备受关注的第三代测序技术,又名单分子实时测序技术,在进行DNA测序时不需经过PCR扩增,故不存在因扩增而引入的碱基错误,在特定序列的SNP检测、稀有突变及其频率测定中优势突出[1],且在直接检测DNA和RNA修饰方面也很有前景[22],得到了越来越多的应用,但是在地贫诊断中研究较少。因此,本研究拟进一步探讨第三代测序技术在地贫诊断中的应用,了解地贫基因类型、构成比等,为地贫的诊断提供理论依据。
本研究中,对200例可疑地贫患者进行血常规及血红蛋白电泳检测发现地贫初筛阳性120例,阴性80例,在性别、年龄及民族中无差异。应用三代测序技术分别对地贫初筛阳性及阴性组进行检测,发现初筛阳性组中地贫基因的阳性率为70.0%,而初筛阴性者中基因阳性率为35.0%,证实了血常规及血红蛋白电泳筛查的确存在较高的漏诊率[23],尤其在地贫高发的地区,常规筛查阴性的人群不能完全除外地中海贫血,他们可能仍为携带者[24],提示单纯的血液学检测往往会造成漏诊,需进一步行三代测序进行确诊。同时,我们深入分析了初筛阴性人群中漏诊地贫患者的血常规及血红蛋白电泳结果,发现-α4.2/αα的MCV和MCH值、-α3.7/αα的MCH和Hb A2值以及Hb CS杂合的Hb A2值均较基因阴性组低,提示在利用血常规和血红蛋白电泳进行地贫初筛时,可能需适当调整MCV、MCH及Hb A2(低值)作为判断初筛阳性的临界值来进一步降低漏诊,但由于本文中的研究对象及覆盖地域等有限,暂无法做更深入和全面的探索,将在后续的研究中继续完善。
接下来我们比较了各组间地贫类型的构成,发现初筛阳性组较阴性组的β地贫占比更高,而阴性组较阳性组的α地贫占比更高,提示在初筛阴性的人群中,α地贫被漏诊的机率更大。同时也发现,初筛阳性组中β地贫的检出率(40.5%)较既往Xu、Tan、 Su等[25-27]报道的比率(26.0%,25.9%和24.0%)更高,考虑是因为β地贫主要由单核苷酸位点变异(single nucleotide variants,SNV)引起[28],既往的基因检测方法容易漏诊,而本研究中使用的第三代测序技术在点突变的检测上更得心应手,因此提高了β地贫的检出率,降低了漏诊及误诊。分析地贫基因型发现,初筛阳性与初筛阴性组中的主要基因类型较一致,α地贫以--SEA/αα、-α3.7/αα和-α4.2/αα突变型为主,β地贫以CD41-42突变型为主,主要基因类型及α地贫较β地贫多见的情况与既往报道一致[29-30]。
本研究中少数民族人数占82.5%,符合我省是少数民族聚居地的特点。112例地贫基因阳性者中,少数民族占比(83.9%)高于汉族,且基因型种类也较汉族多样,以侗族及苗族为代表;但这与既往王芳等[31]的研究结果不尽相同,提示同省不同地区少数民族人口分布及地贫基因携带存在差异,且可能随时间变迁而发生变化,因此需针对性地进行宣教和制定不同的预防机制,定期进行监测。此外,在本研究中其余少数民族虽检出地贫基因阳性,但受检人数较少,缺乏代表性,故未做详细分析,待收集到更详尽的数据再作补充和讨论。
血常规及血红蛋白电泳检测无法明确地贫基因型,既往常用于地贫初筛,而普通的地贫基因检测试剂盒检出的基因类型有限(仅20~30余种)[32],远远不能满足精准诊断的目标。在本研究中,我们利用三代测序明确了112例地贫基因阳性者,共检出地贫基因型18种,其中8种(44.4%)用常规地贫基因试剂盒无法检出,包括了4种(22.2%)罕见的地贫基因型[33-36]。同时也发现,随着测序技术在地贫诊断中的不断深入,α珠蛋白三倍体的检出率较前升高,单纯的α珠蛋白三倍体常无特异性表现,但当它与β地贫共同遗传时,下一代则可能出现中间型地贫的临床症状[2],这对遗传咨询及产前诊断显得尤为重要。可见,第三代测序不仅可以明确地贫基因型,其检测广度更优于普通地贫基因试剂盒,检出类型较多,对罕见变异体的识别也是一种有前途的检测方法[37],能提高罕见基因型的检出率,甚至发现未知基因类型[38],精确诊断也为遗传咨询及患者诊治提供更好的参考,避免漏诊及误诊,对地贫高发且人口基数大的国家意义尤为重大,同时也能丰富人类地贫基因库。第三代测序技术的应用能提高地贫的检出率,结合遗传咨询已减少了部分重型地贫患儿的出生,正努力实现重型地贫零出生的目标,进一步提高人口素质,减轻患者家庭和社会的经济负担。
综上所述,第三代测序技术能明确地贫基因型及检出罕见基因突变,较常规地贫基因检测试剂盒覆盖更多的基因类型,能提高地贫检出率、降低漏诊率。而血常规及血红蛋白电泳虽能筛出高度疑似地贫的人群,但存在较高的漏诊率,因此,先采用常规检测方法在人群中进行地贫初筛,再对初筛阳性者行基因测序确诊的这种传统地贫筛查方式存在弊端,建议直接行第三代测序确诊以避免遗漏,尤其对于高发地区的人群。



