邓晓丹 许天兰
(贵州省人民医院,贵州 贵阳 550002)
新生儿坏死性小肠结肠炎(NEC)是新生儿期最常见的一种严重的胃肠道疾病,在活产婴儿中的发病率可高达1‰~5‰[1]。其可造成患儿腹胀、呕吐或便血,随着病情进展可诱发呼吸功能障碍、肠坏死或穿孔,诱发弥散性血管内凝血(DIC)或多器官衰竭(MOF)等病症,在NEC患儿中死亡率可高达20%~30%[2]。NEC患儿的病情严重程度与预后密切相关,以往文献有关NEC发病的危险因素研究较多,而对影响NEC严重程度和预后的相关因素分析较少。本文主要探讨影响新生儿坏死性小肠结肠炎预后的相关危险因素。
1 资料与方法
1.1一般资料 选取2014年1月至2019年2月我院新生儿科收治的54例符合《实用新生儿学》NEC诊断标准的新生儿,结合临床表现、腹部X 片和相关实验室检查进行诊断及Bell分期。根据修正Bell 分期标准将患儿分为Ⅰ期组(n=19)、Ⅱ期组(n=22)、Ⅲ期组(n=13),根据预后将患儿分为治愈组(n=40),预后不良组(n=14)。54例NEC患儿中,男32例,女22例,剖宫产33例,自然分娩21例,胎龄<32周 6例,32~周 14例;≥37周 34例;出生体重<1 500 g 6例,1 500 g~15例,≥2 500 g 33例,起病日龄最短1 d,最长37 d。治愈组中,男23例,女17例;胎龄(37.06±2.88)周,体质量(2733.88±761.32) g,起病日龄(7.70±1.31) d;分娩方式:顺产15例,剖宫产25例。预后不良组中个,男9例,女5例;胎龄(36.17±4.54)周,体质量(2 270.71±894.77) g,起病日龄(8.86±2.26) d;分娩方式:顺产6例,剖宫产8例。两组患儿一般资料比较差异无统计学意义(P>0.05),具有可比性。
1.2方法 回顾性分析所有患儿的相关临床资料。采集患儿的一般情况、围产因素、临床表现、合并症或并发症、实验室指标、临床结果等资料。将治疗后死亡病例及放弃治疗病例合并分析,比较NEC患儿治愈与预后不良的相关影响因素。对可能影响患儿临床结局的因素进行单因素分析,对有意义的危险因素进行多因素Logistic回归分析。
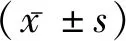
2 结 果
2.1围产因素、并发症及实验室指标 54例患儿中,羊水粪染7例,胎膜早破12例,窒息9例,胎儿宫内窘迫20例,妊娠合并糖尿病3例,妊娠合并高血压3例,妊娠期胆汁淤积2例,妊娠合并甲状腺功能减退5例,孕母梅毒2例,胎盘粘连12例,前置胎盘1例;生后母乳喂养7例,配方奶喂养47例;宫内感染11例,起病前抗生素使用19例,机械通气13例,溶血病5例,硬肿症16例,新生儿贫血29例,先天性心脏病6例,败血症14例,肺炎12例,RDS5例,化脓性脑膜炎4例,休克4例,起病前输血4例,肠穿孔4例,实验室指标:白细胞异常(<5×109或>20×109)15例,CRP异常(>8 mg/L)37例;血小板减少(<100×109)9例;PCT增高30例,腹部X片异常18例,电解质紊乱13例,低蛋白血症37例。
2.2治疗及转归 确诊后立即采取禁食处理,经静脉营养治疗,适时给予胃肠减压,并针对患儿感染情况酌情采取三代头孢菌素联合甲硝唑,部分根据药敏调整用药;若采取保守治疗无好转或患儿出现肠穿孔或腹膜炎立即开腹手术,目的在于及时切除坏死肠壁,避免发生肠穿孔、脓毒血症、感染性休克等严重并发症。依据NEC患儿预后结局划分为治愈组与预后不良组,经治疗后40例NEC患儿痊愈(治愈组),症状消失,体温、肠鸣音恢复,食欲好,复查实验室指标及X片正常;其中I期患儿痊愈率达到94.7%(18/19),Ⅱ期患儿痊愈率达到90.9%(20/22),Ⅲ期痊愈率仅为15.3%(2/13);14例患儿死亡(其中10例因存在严重合并症及经济原因,家属放弃治疗),NEC患儿的治愈率随患儿病情加重而逐渐降低(P<0.01)。
2.3单因素分析 两组间血小板减少、PCT增高、败血症、硬肿症、电解质紊乱、低蛋白血症、化脑、肠穿孔、休克、机械通气上差异有统计学意义(P<0.05)。见表1。
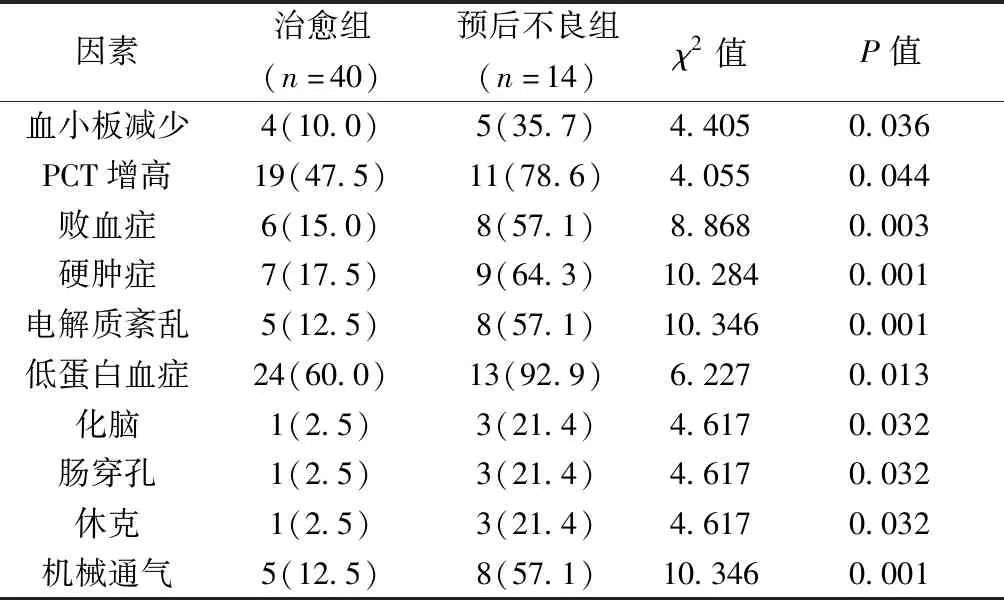
表1 影响NEC患儿临床预后的单因素分析
2.4多因素Logistic回归分析 对预后起决定性作用的因素有硬肿症和Bell分期;对于硬肿症因素而言,患有硬肿症的婴儿预后不良分风险将增加41.783倍;对于Bell分期而言,随着Bell分期增加,婴儿预后不良的风险明显增加,Bell分期每增加一级,婴儿预后不良的风险增加3.274倍。见表2。
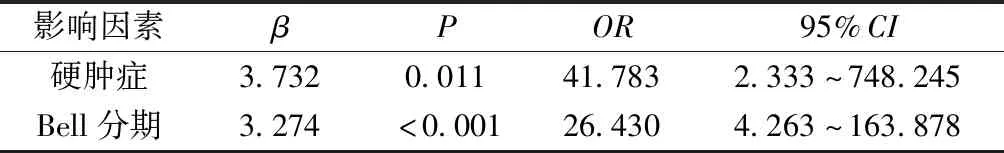
表2 影响预后因素多元逐步Logistic回归分析
3 讨 论
NEC的发病机制至今仍未完全清楚,有研究[3]认为,感染和肠壁炎症是NEC 的最主要病因,可能与肠黏膜屏障功能不良导致细菌在肠腔、肠壁内大量繁殖、产生炎性介质相关,炎性介质能够引发肠壁损伤,甚至发生坏死,继而引发全身症状反应,严重时发生休克、多器官衰竭,从而导致死亡。本研究结果显示败血症、血小板减少是NEC预后不良的危险因素,研究[4]证实,败血症与NEC发病密切相关,同时肠道内一些致病菌的过度繁殖也可直接损伤肠道导致NEC 的发生。有研究[5]发现,败血症等感染重的情况会加重NEC的病情,NEC发病后血小板减少不仅是严重感染的表现,同时与NEC发生后肠道弥散性血管内凝血有关,病程中血小板持续减少,提示肠黏膜受损程度重,黏膜下层微循环障碍,坏死出血多。
PCT 由甲状腺合成,在机体严重感染时可快速升高,最早可在感染后2 h 内检测到,6 h 是上升速度最快的时段,8~24 h 可稳定保持高水平状态[6-7]。本研究显示,预后不良组PCT值与治愈组差异有显着性,提示严重细菌感染可能是预后不良组NEC的主要致病病因。本研究发现,休克、肠穿孔是NEC病情严重程度的危险因素,预后不良组发生休克及肠穿孔比例更高。这与研究[8]结果相一致。
研究[9]显示,机械通气是NEC患儿出现胃肠损伤的危险因素。本组研究数据发现,单因素分析中证实机械通气是NEC病情严重程度的危险因素,在预后不良组,气管插管、机械通气比例高达57.1%,与治愈组差异具有显着性。其原因可能系患儿机体缺氧合并代谢性酸中毒时会进一步加重肠道缺氧缺血程度;其次机械通气时需进行气管插管及气道管理操作,这些操作又会破坏食道黏膜的完整性及防御功能,增加院内感染的风险;再则较长时间机械通气的患儿往往有长时间的抗生素使用史,容易引起肠道菌群失调,从而诱发NEC 和(或)加重患儿NEC 的病情进展。本研究还显示,低蛋白血症、电解质紊乱均与NEC预后不良有关,分析可能与严重感染时机体内环境紊乱,蛋白质合成不足有关。
目前NEC的临床分期主要参考Bell分期标准,Ⅲ期NEC为重症NEC,进展快,预后差[10]。本研究中,预后不良组其中11例系Ⅲ期患儿,其机械通气使用率、败血症发生率、休克发生率均高于Ⅰ、Ⅱ期组,多因素Logistic回归分析显示,Bell分期是对预后起决定性的因素,考虑与Ⅲ期肠道损伤严重,病原菌容易移位引起肠源性败血症有关。本研究还显示硬肿症是NEC预后不良的独立危险因素。本组患者中,预后不良组硬肿症发生率为64.3%相较治愈组17.5%差异具有显着性,原因可能是硬肿症患者血液循环普遍较差,存在不同程度凝血功能障碍,极易造成肠粘膜粘连、肠壁缺血,进一步加重患者肠损伤程度以及感染症状有关。
NEC的预后不良与合并败血症、休克、血小板减少、PCT增高、电解质紊乱、低蛋白血症等合并症有关,多因素分析显示疾病分期、硬肿症是患儿预后不良的独立危险因素。



