赵丹 李尼克 李雯 彭春红 赵德刚 张湘燕△
(1.贵州省人民医院呼吸与危重症医学科,贵州 贵阳 550002;2.国家卫生健康委员会肺脏免疫性疾病重点实验室,贵州 贵阳 550000;3.贵州医科大学,贵州 贵阳 550000;4.贵州大学农业生物工程研究院/山地植物资源保护与种质创新教育部重点实验室,贵州 贵阳 550000)
细菌的外膜蛋白(Outer membrane protein,Omp)广泛存在于革兰氏阴性杆菌科中,主要含有外膜蛋白A(Outer membrane protein A,OmpA)、孔蛋白C和F等,是其毒力的主要部分,具有致病性及免疫原性[1]。OmpA是鲍曼不动杆菌含量最多的外膜蛋白之一,过去对鲍曼不动杆菌的研究主要集中在耐药性及免疫原性,但其结构与耐药性及免疫原性之间的关系探索相对较少。为进一步确定鲍曼不动杆菌OmpA的生物学特征,本研究对鲍曼不动杆菌OmpA基因进行检测、测序分析,预测其三级结构、跨膜结构等,为进一步研究鲍曼不动杆菌OmpA的致病性奠定基础。
1 材料与方法
1.1 实验材料鲍曼不动杆菌临床分离株12株(由贵州省人民医院检验科微生物室惠赠),鲍曼不动杆菌标准株(ATCC17978)购于美国模式菌种收集中心(American Type Culture Collection,ATCC)。
1.2 主要器材移液枪、高速低温离心机(德国Eppendorf公司),DNA Engine PCR仪(美国伯乐Bio-rad公司),凝胶成像系统(美国Bio-rad公司),电泳仪(北京六一公司),台式恒温摇床(美国Thermo公司),细菌培养箱(美国Thermo Fisher公司),超纯水仪(台湾艾柯公司),超净工作台(苏州苏净集团安泰公司),VITEK-32全自动微生物分析鉴定仪(法国梅里埃公司)。
1.3 主要试剂LB培养基(英国Oxoid公司),琼脂糖(英国OXOID公司),细菌DNA提取试剂盒(康维世纪),2×Maxima SYBR Green/ROX qPCR Master Mix(Thermo Scientific,#K0221),2×ES Taq MasterMix(康维世纪,CW0690S),DEPC H2O(均来自天根生化科技有限公司),合成引物购及基因测序(上海生工公司)。
1.4 主要试剂配置50×TAE缓冲液1 L(pH值8.5):Tris 242 g、Na2EDTA·2H2O 37.2 g,加入800 mL的双蒸水充分混匀,乙酸57.1 mL,加入双蒸水定容至1 L,室温保存。10×TBE缓冲液(pH值8.3):Tris 108 g、Na2EDTA·2H2O 7.44 g、硼酸55 g、双蒸水800 mL,上述溶液充分混匀后,加入双蒸水定容至1 L,室温保存。溴乙锭(工作浓度0.5 g/mL):10 mg/mL溴乙锭1 g,双蒸水100 mL,充分混匀,转移至棕色瓶中,室温避光保存。氨苄青霉素(Amp)(5 mL):Amp 0.5 g,ddH2O 5 mL,充分混匀、过滤,分装于1.5 mL EP管中(每支200 μL),于-20 ℃保存。卡拉霉素(Kan)(5 mL):Kan 0.5 g,ddH2O 5 mL,充分混匀、过滤,分装于1.5 mL EP管中(每支200 μL),于-20 ℃保存。
1.5 方法
1.5.1 菌株培养本研究所用鲍曼不动杆菌临床分离株12株,为贵州省人民医院检验科微生物室临床分离惠赠,采用VITEK-compact2全自动微生物鉴定药敏系统,纸片扩散法及E-test条药敏试验,药敏试验判断标准和结果解释参照美国CLSI标准(Clinical and Laboratory Standards Institute,2010),并用标准菌株做药敏质量控制,剔除同一患者重复分离的相同细菌。无菌操作台灭菌30 min后,75%酒精棉球消毒包括手在内的所有物品;用灭菌接种环蘸取1环菌液LB培养平板24 h;挑单克隆菌,放入3 mL LB培养基中,于37 ℃振摇培养12~16 h(150 r/min);经洗涤、悬浮后继续培养至对数生长期,再用新鲜LB悬浮至OD600为0.05。
1.5.2 OmpA基因及鲍曼不动杆菌管家基因DNA扩增将复苏好的鲍曼不动杆菌临床分离株菌液各取200 μL,12 000 r/min,离心2 min收集沉淀的菌体,用含有400 mg/L溶菌酶的100 μL TE缓冲液悬浮菌体。采用 Genbank中的OmpA基因序列设计并合成DNA引物,扩增鲍曼不动杆菌7个管家基因gltA,gyrB,gdhB,recA,cpn60,gpiF,rpoD(Bartual SG,2005),见表1。将DNA模板、Primer Mix、dNTP mix、DTT、RT Buffer、HiFi Script和RNase-Free Water溶解并置于冰上备用。配置反应体系,总体积为20 μL,dNTPmix,2.5 mM Each 4 μL,Primer Mix 2 μL,RNA Template X μL,5XRT Buffer 4 μL,DTT,0.1 M 2 μL,Taq DNA Polymerase,BPI 200 μL 1μL,加入RNase-Free Water至20 μL。反应程序:95 ℃,5 min;95 ℃,40 s,56 ℃,40 s,72 ℃,1 min,共30个循环;72 ℃,10 min。反应产物于-80℃保存。
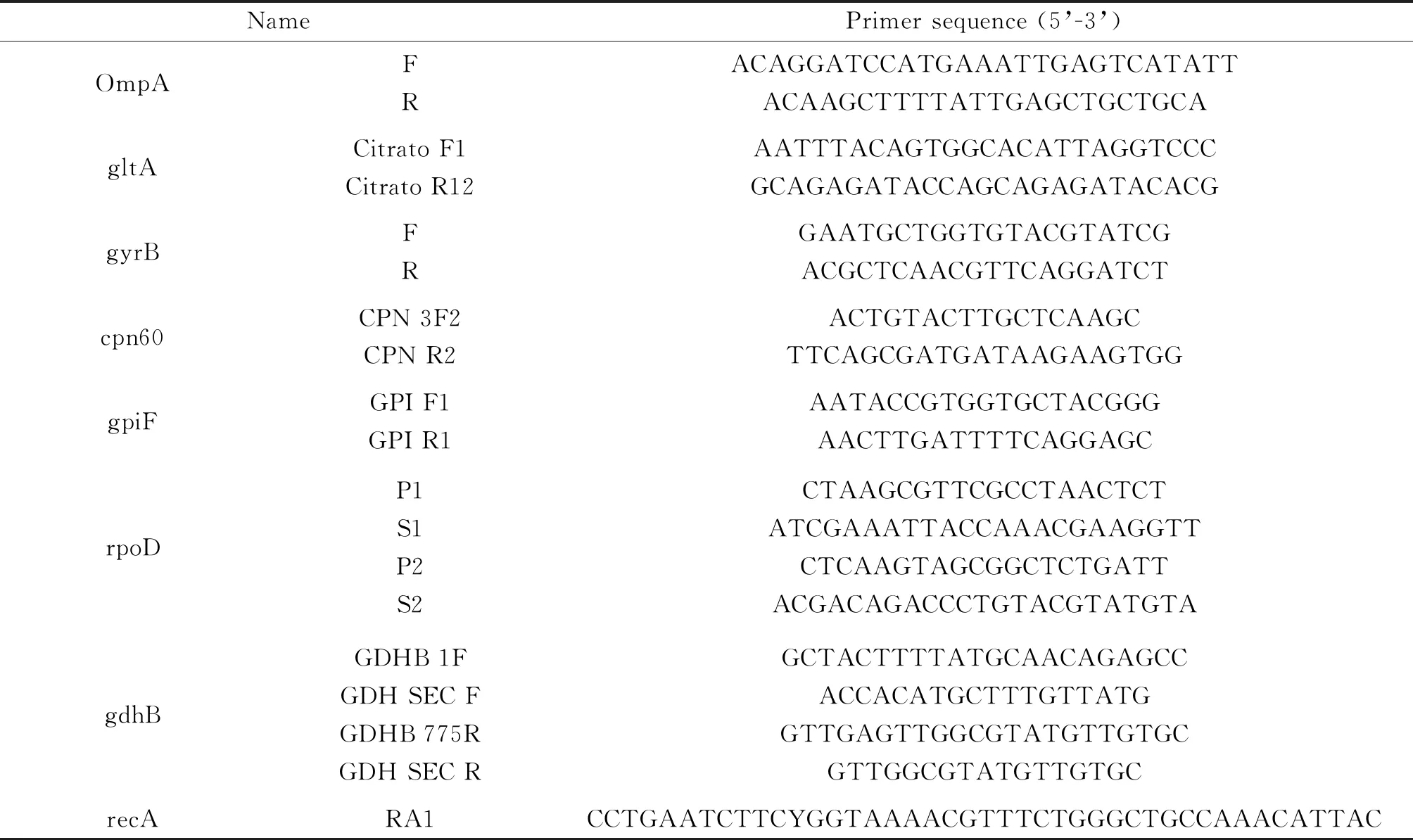
表1 PCR扩增管家基因及OmpA基因引物
1.5.3 PCR产物的琼脂糖凝胶电泳按照琼脂糖凝胶浓度与线形DNA的最佳分辨范围,采取1%浓度制胶,即1.8 g琼脂糖加入180 mL双蒸水于锥形瓶中微波炉加热溶解,使溶液冷却至50~60 ℃左右,加入溴乙锭溶液(终浓度0.5 μg/mL),并充分混匀。将琼脂糖溶液倒入插上齿梳的制胶模中,小胶倒入25~30 mL左右琼脂糖溶液,大胶倒入60~70 mL左右琼脂糖溶液。室温下放置30 min至1 h,待胶凝固。上样,取于PCR反应产物4 μL与20 μL 6×上样缓冲液混匀,用微量移液枪取20 μL小心加入样品槽中。电泳:加完样后,合上电泳槽盖,立即接通电源,控制电压保持在110 V,电流在40 mA以上。当条带移动到距离前沿约2 cm时(约40 min),停止电泳。紫外线下拍照并观察。
1.5.4 PCR产物回收将目的基因DNA条带从琼脂糖凝胶中切下,放入干净的离心管、称质量。加入等倍体积溶液PN,50 ℃水浴至胶块完全溶解。将所得溶液加入500 μL平衡液BL处理的吸附柱CA2中,室温5 min,12 000 r/min,离心30~60 s,倒掉废液,将吸附柱放回收集管。加入600 μL漂洗液PW,12 000 r/min,离心30~60 s,倒掉废液,将吸附柱放回收集管,重复清洗1次。12 000 r/min,离心2 min,弃去废液,室温晾置数分钟,转入新的离心管,吸附膜中间悬空滴加30 μL ddH2O,室温5 min,12 000 r/min,离心2 min,得到DNA溶液。反应产物于-80℃保存。
1.5.5 鲍曼不动杆菌MLST基因分析分别扩增12株临床分离的鲍曼不动杆菌的7个管家基因gltA、gyrB、gdhB、recA、cpn60、gpi和rpoD,多位点序列分型(MLST)引物参照鲍曼不动杆菌的MIST数据库(http://pubmlst.org/abaumanni/),扩增产物双向测序由上海生工生物工程公司进行第二代高通量测序,测序结果与鲍曼不动杆菌MLST数据库进行比对分析(http://pubmlst.org/perl/bigsdb/bigsdb.pl?db=pubmlst_abaumannii_seqdef),获得每个等位基因的数值,然后将每株细菌按照的顺序排列成等位基因谱,对每株细菌进行序列分型及SNP分析。
1.5.6 OmpA的三级结构预测及跨膜结构分析扩增12株临床分离的鲍曼不动杆菌外膜蛋白OmpA基因,DNA产物测序由上海生工生物工程公司完成。OmpA的三级结构预测(https://swissmodel.expasy.org/interactive)、跨膜结构预测(http://www.cbs.dtu.dk/services/TMHMM/)。
2 结 果
2.1 临床分离的鲍曼不动杆菌管家基因鉴定及MLST分型12株临床分离鲍曼不动杆菌管家基因扩增,见图1。7个管家基因gltA、gyrB、gdhB、recA、cpn60、gpiF和rpoD的PCR扩增结果经测序比对后显示,12株鲍曼不动杆菌主要可分为6个ST型(ST 208,1-3-3-12-2-96-3;ST 229,1-3-3-12-2-94-3;ST 191,1-3-3-12-2-94-3;ST 195,1-3-3-12-1-96-3;ST 540,1-3-3-12-1-96-3;ST 1145,1-3-3-12-2-94-3),如表2所示。12株临床分离鲍曼不动杆菌管家基因的MLST分析有24个SNP位点,主要集中cpn60及gpiF基因,见表2及图2。
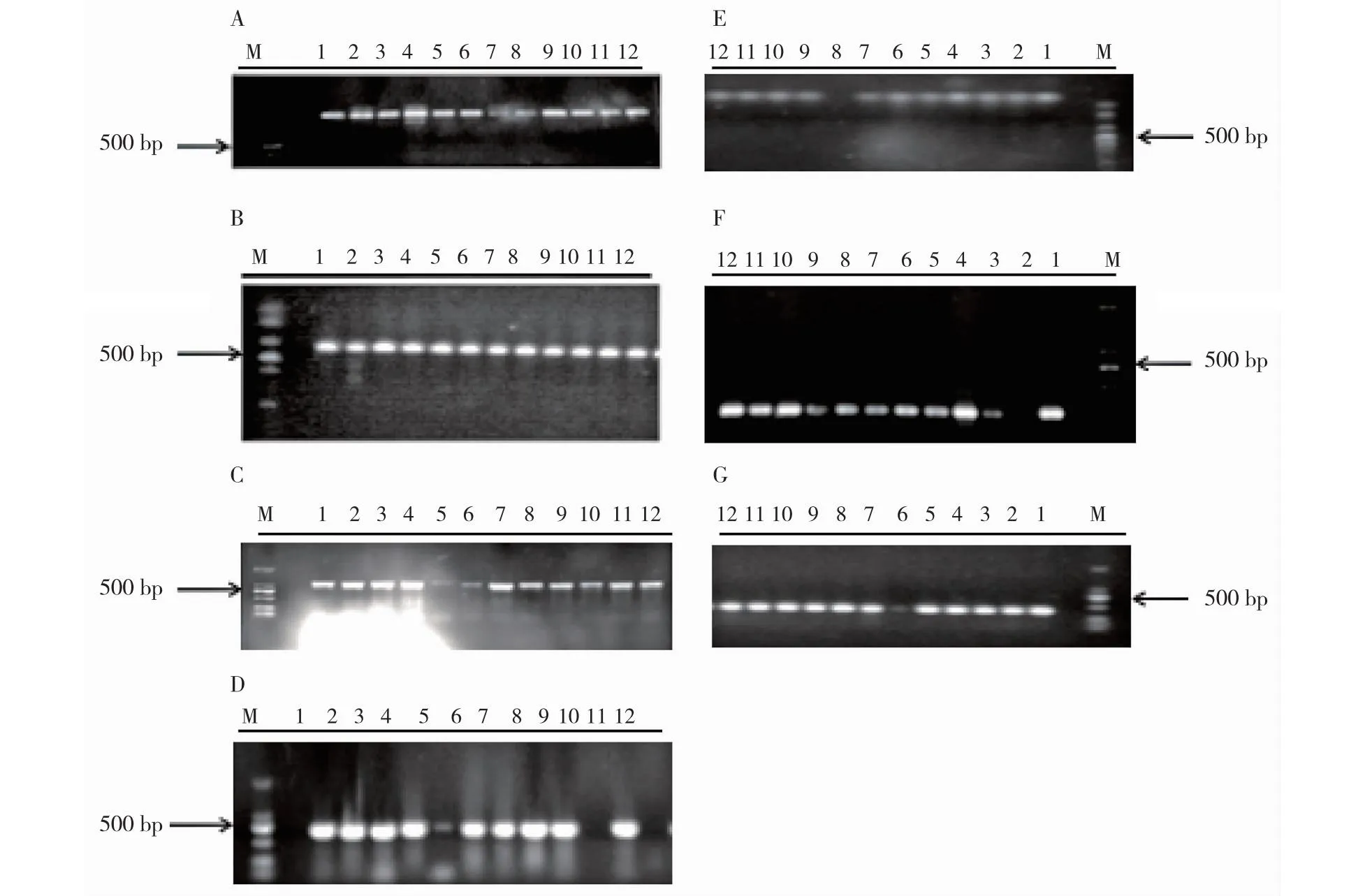
注:A.gltA 基因DNA电泳条带;B.gyrB基因DNA电泳条带;C.gdhB基因DNA电泳条带;D.recA基因DNA电泳条带;E.cpn60基因DNA电泳条带;F.gpiF基因DNA电泳条带;G.rpoD基因DNA电泳条带。

图2 12株临床分离鲍曼不动杆菌SNP位点分析
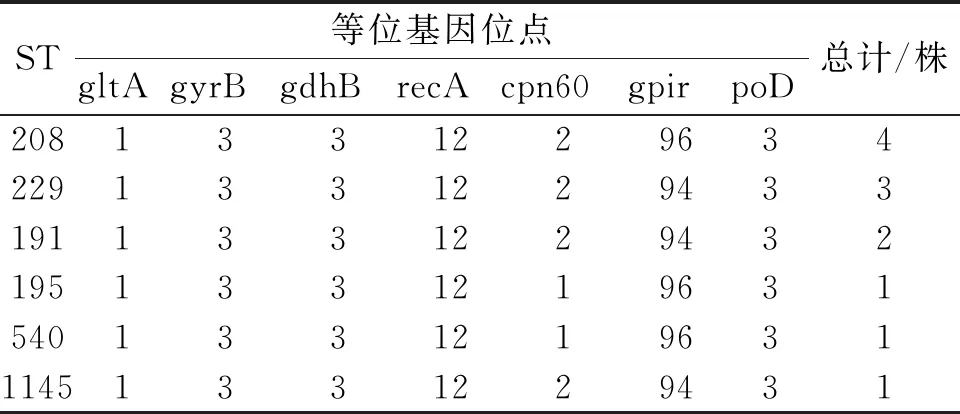
表2 12株鲍曼不动杆菌的MLST基因及构成比(%)
2.2 临床分离的鲍曼不动杆菌OmpA DNA表达水平12株鲍曼不动杆菌均检测到OmpA基因,分子量为1 070 bp ,见图3。
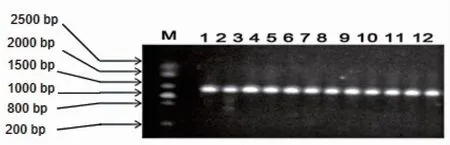
注:从上到下分子量依次为2 500、2 000、1 500、1 000、800、200 bp,其中1 000 bp加亮。
2.3 鲍曼不动杆菌OmpA的三级结构分析OmpA基因测序序列进行三级结构预测提有6种三级结构,均由β-桶状结构组成的保守结构域,见图4。

图4 鲍曼不动杆菌OmpA基因三级结构预测
2.4 鲍曼不动杆菌OmpA的蛋白跨膜结构分析OmpA基因测序序列进行蛋白跨膜结构预测为跨膜蛋白,见图5。
图5 鲍曼不动杆菌OmpA跨膜结构预测
3 讨 论
鲍曼不动杆菌广泛存在于自然界,具有生存及侵袭能力强等特点,能在各级医疗机构广泛流行,是一种重要的条件致病菌,在免疫力较低及长期大量使用抗生素的患者中感染率尤其高,可引起呼吸机相关性肺炎及皮肤、泌尿系、伤口及中枢神经系统等感染。由于地域不同、医院治疗方案不同及环境消毒的差别,鲍曼不动杆菌的临床特征及耐药情况不同[2]。MLST分型可获得等位基因图谱,有群体遗传学分析的功能,且能够准确提供菌种评估的信息,是目前临床中监控鲍曼不动杆菌传播的常用方法[3]。多位点序列分型(sequencetype,ST)是测定鲍曼不动杆菌7个管家基因的部分DNA序列,根据每一序列的特异性赋予一个特定的等位基因编号,每一菌株7个管家基因的7个特异性编号即构成该菌株的序列型,根据ST分型发现菌株的变异[4]。本研究扩增了12株临床分离的鲍曼不动杆菌管家基因gltA、gyrB、gdhB、recA、cpn60、gpiF及rpoD,通过MLST分型结果12株菌株中的6个ST分型均已公布,未发现变异菌株,其中4株为ST 208,3株为ST 229,2株为ST 191,在ST 195、ST 540和ST 1 145中,分别各1株。本研究结果以ST 208为主,SNP等进行预测分析结果显示其SNP突变不多,主要在cpn60及gpir基因中,与既往研究结果一致[5]。
Omp是革兰氏阴性菌的主要成分,大约占外膜结构的50%左右,其位于细菌膜表面或镶嵌其中,主要以磷脂组成内层结构,以脂多糖(lipopolysaccharide,LPS)组成的外层结构所组成。Omp主要起到维持细菌外膜完整性、阻隔细菌等外界物质入侵,同时因其是一个重要的膜孔蛋白[6],通过外膜小泡分泌和传递致病因子给宿主细胞,在细菌对宿主的感染及致病过程中具有重要的病理生理作用[7-9],目前该蛋白已逐渐成为鲍曼不动杆菌的研究热点。鲍曼不动杆菌OmpA是一个分子量大小为38 kD,氨基酸保守性>99%的蛋白质,因此菌种间蛋白差异较小,是目前功能研究最确定的毒力因子[10],本实验研究结果提示鲍曼不动杆菌OmpA基因片段的核苷酸序列长度为1 070 bp,与GeneBank中序列相一致,与张欣等[11]和E.H.Kawther等[12]研究外膜蛋白OmpA核苷酸序列结果相一致。在分离的12株临床菌株中都有OmpA基因的表达,说明外膜蛋白的氨基酸序列高度保守。
OmpA由N-端及C-端两个富含脯氨酸的区域组成,N-端为β-桶状跨膜蛋白区域,为170残基、八链、反向平行的β-桶状结构,模拟的晶体结构可见β-链相对于桶轴平均呈450倾斜,圆桶横截面直径为26A,长为57A,这些短链被连接在细胞质边上,更多以环状连接在细胞膜外。鲍曼不动杆菌的OmpA包含三个不同的结构域:N端信号肽、β-桶状结构和C端OmpA样结构域,模拟的晶体结构可见β-链相对于桶轴平均呈450倾斜。N-端β-桶状跨膜蛋白区域具有线粒体定位信号序列,C-端的细胞周质区为OmpA样区域,由150残基组成,以球状附着在细胞质的间隙[13]。OmpA样区域是一个保守序列,富含OmpA相关的外膜蛋白和MotB蛋白,在结合肽聚糖层和肽聚糖相关磷脂(diaminopimelate,DAP)时具有重要功能,保持外膜蛋白整体的完整性并调控外膜蛋白的产生[13],C-端细胞周质区域具有细胞核定位信号序列。本研究将鲍曼不动杆菌OmpA比对Pubmed上三级空间结构,结果发现6种β-桶状结构,具有维持细胞的形状和稳定性作用,同时也参与生物膜的形成、细菌黏附、侵袭宿主细胞、铁蛋白的获取和免疫逃逸等过程。OmpA蛋白跨膜分析属于跨膜蛋白,与既往的研究结果一致[14]。但其跨膜的同时,中心形成膜孔,可以将复合物从细胞周质泵出细胞外,与内膜蛋白流出泵系统配对,参与鲍曼不动杆菌耐药机制的产生[15]。随着基因编辑技术的发展,当前对OmpA的研究更加深入。既往的研究发现Omps在许多细菌中为有效抗原,能够诱导机体产生强烈的免疫反应,具有作为亚单位疫苗的潜力,因此有报道[16-18]将OmpA原核表达、纯化作为疫苗运用。鲍曼不动杆菌OmpA的结构相对保守,维持细胞的形状和稳定性的同时,参与细菌耐药机制,同时有望成为免疫疫苗运用于临床中。
利益冲突说明/Conflict of Intetests
所有作者声明不存在利益冲突。
伦理批准及知情同意/Ethics Approval and Patient Consent
本研究通过贵州省人民医院伦理委员会批准(伦预审字[2019]090号),为微生物实验研究,故知情同意免除。



