杨 柳,张 超,陈永权,姚卫东,鲁美静,张恺辰,金孝岠
(1. 皖南医学院弋矶山医院麻醉科;2. 皖南医学院弋矶山医院影像科,安徽 芜湖 241000)
吗啡是临床上一种重要的麻醉药物,具有极强的镇痛效果,但它最大的缺点就是易成瘾。有数据表明阿片类药物的滥用现象在产妇中非常严重,滥用阿片类药物可致新生儿发生戒断反应综合征[1]。由于社会环境和家庭因素的双重影响,关于产前阿片类药物暴露对儿童长期影响的数据目前尚不清楚,而这类儿童比其他一般人群更容易接触毒品,因此研究妊娠末期吗啡暴露的子代成瘾性并探索其机制尤为重要。有研究报道,新生大鼠在胚胎期被动接触吗啡会产生行为和神经化学变化,包括对吗啡的心理依赖[2]。我们之前的研究也表明,在妊娠晚期暴露于吗啡会增加子代鼠对吗啡条件部位偏爱的敏感性[3]。近来许多研究发现,N-甲基-D-天冬氨酸(N-methyl-D-aspartate,NMDA)受体调节了突触的可塑性改变,介导长时程增强和减弱的发生和维持,而这些改变都伴随着精神依赖的发生和维持,伏隔核中NMDA 受体亚基的表达和功能会在吗啡成瘾的动物中增强[4]。NMDA 受体的功能特性主要由组成异聚体的NR2 亚基的特异性决定,其中NR2A 因功能上占主导地位而备受关注,发现在慢性吗啡处理后的小鼠伏隔核中NR2A 表达显着增加[5]。故本研究选取妊娠末期即孕14~20 d 为吗啡暴露期,建立孕鼠吗啡暴露模型,选择与吗啡成瘾密切相关的NMDA 受体NR2A 亚基作为主要的研究指标,建立吗啡条件位置偏爱(Conditioned place preference,CPP)模型比较成瘾性不同的子代鼠伏隔核区NR2A 亚基的表达,以揭示吗啡精神依赖的部分神经生物学机制。
1 材料与方法
1.1 材料
1.1.1 实验动物雌性SD 大鼠52 只,雄性SD 大鼠26 只,年龄14~18 周龄,体重250~300 g,单笼饲养。将雄性和雌性动物分开喂养,在动物室内适应1 周后开始实验。本研究已通过本院的动物实验伦理委员会审查。?
1.1.2 实验药物盐酸吗啡注射液由沈阳第一制药有限公司提供。
1.1.3 实验装置CPP 视频分析软件购自上海吉量软件科技有限公司。CPP 实验盒为有机玻璃盒,中间有一个活动隔板,将盒子分成两部分,盒子的一边里面是黑色的,底部是光滑的,另一边的内表面是白色的,粗糙的网状下表面。CPP 箱体放置在隔音室内,箱体顶部装有摄像头,用于录像。
1.2 方法
1.2.1 孕晚期吗啡暴露模型的制备及子代鼠分组动物室适应性喂养1 周后,选择体重相近的雌性鼠52只,雄性鼠26只进行配对。晚上8∶00闭笼,次日8∶00观察带阴道栓的雌鼠,作为妊娠第1天[6]。52 只笼中雌鼠中,36 只雌鼠见阴道栓。将36 只孕鼠随机分为吗啡暴露组(M 组)18只和对照组(N组)18 只,于见到阴道栓后第14 d 分别注射吗啡和生理盐水。吗啡暴露组雌性大鼠头颈部皮下注射吗啡,每日2 次,初始剂量2 mg·kg-1,每天增加1 mg·kg-1至6 mg·kg-1,直到妊娠大鼠分娩。对照组采用同样方法注射等量生理盐水。孕鼠分娩后,母乳喂养3周后,子代和母鼠分开喂养,出生时,每组子代鼠120只,分为M组子代和N组子代。保留两组相似体重的子代鼠各70只,正常喂养至4周龄后进行实验。
1.2.2 建立子代小鼠吗啡CPP 模型和CPP 试验CPP 测试分为以下3个阶段:(1)预测试阶段(1~3 d):将CPP 实验箱的隔板打开,每组子代鼠可以在箱子两边自由移动15 min,每天1 次连续3 d,使子代鼠适应黑白箱两边的环境。第2 天和第3 天分别测量1 次子代鼠在箱体两侧的停留时间,以2 次的平均值作为基线CPP 值(秒)。用停留时间较长的为自然偏好箱和停留时间较短的为伴药箱(即注射吗啡后放入此侧)来训练子代鼠。(2)CPP训练阶段(4~10 d):关闭CPP 实验箱分区的隔板,把每组子代鼠头颈部皮下注射吗啡后立即放在伴药箱内45 min并8 h 后注入同等量的生理盐水放入到自然偏好箱45 min。吗啡剂量维持在3 mg·kg-1,连续7 d。经过CPP 训练后,如果子代鼠在伴药箱停留的时间明显长于预测试的时间,则说明CPP 模型成功建立。(3)测试阶段(11 d)将黑白箱中间的隔板打开,每组的子代鼠可以在箱两边自由移动15 min,记录在伴药箱的停留时间为CPP测试值。对比CPP测试值和基线值证实CPP 形成,采用CPP 差值(CPP 测试值-CPP 基线值)评价子代鼠吗啡的成瘾性。CPP 差值越高,吗啡成瘾的敏感性越高。
CPP 训练期间,吗啡暴露组子代鼠死亡9 只,剔除11 只(根据CPP 基线值剔除停留时间>630 s 的子代鼠[6]),对照组子代鼠(C)死亡0只,剔除6只,为了保证咖啡暴露组和对照组数量的一致性最终每组保留50 只子代鼠继续实验。根据吗啡CPP 训练后的CPP 差值排序,将吗啡暴露组子代鼠的CPP 差值从高到低排列,按20%、60%、20%的比例分为高CPP 差值[高成瘾组(H)]、中CPP 差值(中成瘾组)和低CPP 差值[低成瘾组(L)]。为探讨不同成瘾性的子代鼠之间是否存在神经生物学差异,选取高成瘾组(10只)和低成瘾组(10只)进行分析。
1.2.3 采用Western blotting 方法测定高、低成瘾组和对照组子代鼠伏隔核中NR2A 亚基的表达情况将高、低成瘾组和对照组子代鼠各10只断头处死,分离伏隔核置于细胞裂解液中匀浆,分离提取总蛋白液。初步测定总蛋白浓度后,等量蛋白样品在8%SDS-PAGE胶上电泳2 h后转印到NC膜上。用5%脱脂奶粉封膜3 h,取兔抗NR2A或大鼠抗β-actin一抗(兔抗NR2A稀释浓度为1∶1 000,购于Abcam公司;鼠抗β-actin 稀释浓度为1∶1 000,购于Sigma 公司),4 ℃孵育过夜。TBST 缓冲液洗膜3 次,每次15 min 后置于辣根过氧化物酶标记的二抗溶液中(稀释浓度为1∶5 000,购自北京中杉金桥有限公司)孵育1.5 h。利用ImageJ软件对蛋白条带进行分析,计算NR2A 和β-actin 条带的灰度比值来表示NR2A蛋白的表达水平。
1.2.4 统计学处理采用SPASS 20.0统计软件分析,实验数据以均数±标准差表示。组间比较采用F检验,两两比较采用q检验。P<0.05为差异有统计学意义。
2 结 果
2.1 子代鼠CPP 模型检测预测试时,各组CPP基线值差异无统计学意义(P>0.05);经过7 d 的条件位置偏爱训练,CPP 测试值在高成瘾组和低成瘾组高于基线值(P<0.01);对照组的CPP 测试值显示与基线值相比差异无统计学意义(P>0.05);高成瘾组的CPP 差值高于低成瘾组和对照组,低成瘾组的CPP 值高于对照组,差异均有统计学意义(P均<0.01)。见表1。
表1 吗啡高低成瘾组与对照组子代鼠CPP测试结果的比较/s,±s,n=10
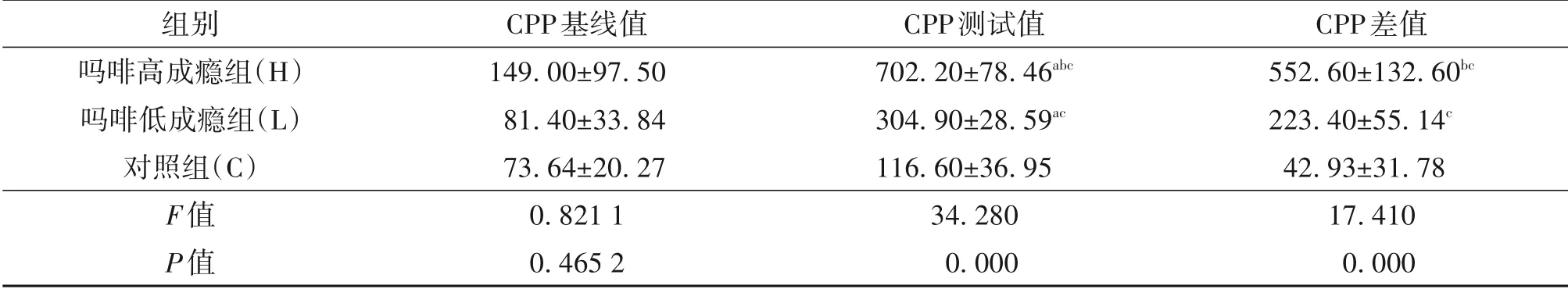
表1 吗啡高低成瘾组与对照组子代鼠CPP测试结果的比较/s,±s,n=10
注:与CPP基线值比较,a P<0.01;与吗啡低成瘾组比较,b P<0.01;与对照组比较,c P<0.01。
组别吗啡高成瘾组(H)吗啡低成瘾组(L)对照组(C)F值P值CPP基线值149.00±97.50 81.40±33.84 73.64±20.27 0.821 1 0.465 2 CPP测试值702.20±78.46abc 304.90±28.59ac 116.60±36.95 34.280 0.000 CPP差值552.60±132.60bc 223.40±55.14c 42.93±31.78 17.410 0.000
2.2 通过Western blotting 法比较三组子代鼠伏隔核NR2A 亚基蛋白表达变化高成瘾组的NR2A 亚基表达水平高于低成瘾组和对照组,低成瘾组的NR2A 亚基表达水平高于对照组,差异均有统计学意义(P均<0.01)。见表2和图1。

表2 三组子代鼠伏隔核中NR2A蛋白表达变化/-x±s

图1 高低成瘾组和对照组子代鼠伏隔核NR2A亚基表达的比较
3 讨 论
本实验选择怀孕晚期(孕14~20 d)作为吗啡暴露时期,参照DAQUILA PS 等[7]、SURMEIER DJ 等[8]报道的模型,以及我们在前期实验阶段发现当吗啡皮下注射剂量达到10 mg·kg-1每天2 次时,会导致孕鼠出现明显的难产、流产及食子现象,因此本实验吗啡以2 mg·kg-1为起始剂量,以后每天增加1 mg·kg-1,至6 mg·kg-1为维持剂量,每天上午9∶00和下午5∶00 于大鼠两耳间头颈部皮下注射。本实验过程中建立孕晚期吗啡暴露模型时使用的吗啡剂量相对以前大剂量吗啡暴露,流产难产及出现食子现象较少,能够顺利观察实验组子代鼠对吗啡成瘾易感性的情况。
经过吗啡条件位置偏爱的训练后,子代鼠在给药地点表现出CPP,形成一种类似于人类吗啡成瘾者的渴望行为。因此,子代鼠的CPP 可用于评价其对吗啡成瘾的敏感性[9]。本实验中,给予3 mg·kg-1恒定剂量的吗啡训练7 d 后,吗啡高成瘾组和低成瘾组子代鼠在白盒内产生稳定的CPP,而对照组子代鼠未出现CPP,说明妊娠末期吗啡暴露对子代鼠的成瘾性有显着的增强作用。研究表明,妊娠期阿片类药物暴露可对子代的脑结构和功能产生长期的负面影响[10],增加对毒品上瘾的敏感性[11]。本实验结果与相关研究报道一致。但值得注意的是,很难排除环境因素对成瘾的影响,不同品系大鼠对药物反应的差异与某些基因的表达水平有关[12]。因此,在本实验中选取相同品系的子代鼠在相同的喂养条件下,给予相同的处理和吗啡剂量,保证了其遗传背景、后天环境和干预因素的一致性。吗啡适应训练后,吗啡暴露组子代鼠表现出吗啡CPP,部分子代鼠在伴药箱停留的时间显着增加,表现出高吗啡CPP;部分子代鼠在伴药箱停留时间增加不明显,表现为低吗啡CPP。以上结果表明,同一品系不同子代鼠对吗啡CPP 的敏感性确实存在差异。在本研究中,CPP 训练中吗啡剂量的选择是基于前人的研究数据[13-14]。值得思考的是,如果剂量过高,CPP的形成和表达可能被药物巨大的奖赏效应所掩盖。然而剂量过小也可能影响实验动物CPP 倾向的形成。
本研究发现,与低成瘾组和对照组相比,高成瘾组子代鼠伏隔核中NR2A 的表达显着增加。高成瘾组的子代鼠比低成瘾组表现出更强的吗啡CPP,说明两组子代鼠伏隔核中NR2A 的表达主要与吗啡精神依赖程度有关。有研究报道吗啡成瘾大鼠伏隔核内NMDA 受体亚基的表达和功能增加[15]。谷氨酸系统活性的变化不仅与NMDA 受体数量的变化有关,还与NMDA 受体复合物NR2 亚基类型的变化有关,慢性吗啡处理后伏隔核的NR2A 亚基表达升高[16]。用Western blot 方法检测吗啡成瘾大鼠NR1 和NR2A 亚基,发现其在大脑前额叶和海马区的表达降低,而在伏隔核区的表达增加[17]。TOMAZILEDIANE 等[18]研究发现NR2A 亚基敲除小鼠纳洛酮催促后表现出的戒断症状明显减轻。此外,NR2A 敲除的小鼠不能表现出条件位置偏爱(CPP)[19]。IAHPOSHT-KHACHAKIALI 等[20]还揭示了谷氨酸能神经递质的运输是通过伏隔核中NR2A亚基发挥作用的,这也证实了选择性的NR2A 受体拮抗剂在阿片药物成瘾和戒断的治疗上开辟了新的思路。NR2A 介导与药物成瘾相关的学习记忆过程和突触可塑性的改变,说明NR2A 作用于大脑奖赏系统,即与药物成瘾密切相关[21]。这些都是在分子水平上长期激活阿片受体对NMDA 受体表达的影响,并为NR2A 参与吗啡成瘾提供了直接证据。本实验结果支持上述结论。
目前,长期阿片类药物治疗将激活蛋白激酶C(PKC)转移到细胞膜内,同时激活NMDA 受体引起钙离子浓度增加,刺激多个信号转导系统进一步诱导突触可塑性变化,表现为阿片药物的成瘾。由于NR2 亚基上存在多个非受体酪氨酸激酶的磷酸化位点,故在表达NR2A 受体的细胞中,非受体酪氨酸激酶可增强NMDA 受体电流,而NR2A 亚基缺失的NMDA 受体无此变化[22]。NR2A 磷酸化水平升高能维持较长时间,这与阿片药物致NMDA 受体电流持续增加是一致的。这可能与NR2A被PKC磷酸化使NMDA 受体功能增强有关,说明NR2A 的磷酸化在调控NMDA 受体依赖的突触可塑性中发挥了重要作用。因此,我们认为NR2A 亚基的磷酸化提高了中脑边缘多巴胺系统(MLDS)的兴奋性从而促使吗啡成瘾形成。
综上所述,妊娠末期吗啡暴露致子代鼠成瘾性增强可能与伏隔核区NR2A 蛋白表达的上调有关,吗啡训练后NR2A 亚基表达的增加可能是导致子代鼠吗啡成瘾的重要原因之一。



