付黎芸,王绍娟
(遵义医科大学珠海校区,广东 珠海 519000)
妇科恶性肿瘤(Gynecologic malignant tumor)主要包括卵巢癌、宫颈癌、子宫内膜癌、绒毛膜癌、外阴癌、阴道癌、输卵管癌等存在于女性生殖系统的癌症,其中卵巢癌、宫颈癌发病率最高,约占妇科恶性肿瘤95%以上[1]。目前,妇科恶性肿瘤发病率逐年增加且呈现年轻化趋势[2],而且缺少有效的生物学诊断标记物和现代分子生物技术指导的基因疗法。寻找有效的生物标记物对于早期妇科肿瘤的诊断与基因治疗具有重要临床意义。
桥粒芯蛋白(Desmoglein,DSG)是广泛存在于上皮和心肌等细胞的细胞间黏附蛋白。DSG 作为一种发挥锚定黏附作用的钙黏着蛋白为细胞间提供机械稳定性,有助于保持组织稳态[3]。DSG 除物理锚定位点和屏障功能外,还可通过传导细胞信号以维持细胞增殖、分化和迁移过程中的稳态[4]。桥粒芯蛋白2(Desmoglein 2,DSG2)是DSG 的一种重要表型,调节细胞间的接触功能,细胞增殖、分化、迁移和凋亡。此外,DSG2基因还具有调节癌细胞黏附性、增殖、分化及耐药性的作用[5],与肿瘤发生发展关系密切且机制复杂[6]。DSG2基因突变也广泛参与调节妇科恶性肿瘤的发生发展。本文主要综述DSG2 的结构、功能及其在妇科恶性肿瘤发病中的作用机制,以期为妇科恶性肿瘤的诊断及靶向治疗提供新的思路。
1 桥粒芯蛋白基因家族的结构及装配
DSG基因家族包括DSG1~66个成员,其编码基因均位于人类染色体18q12.1,DSG家族与有3个亚型的桥粒胶蛋白(Desmocollin,DSC)组成桥粒钙黏着蛋白。桥粒钙黏着蛋白依赖黏附分子Ca2+发挥作用,DSG 与DSC 蛋白之间存在中间纤维网直接介导桥粒钙黏着蛋白相互作用,形成致密的中线,从而加强细胞间紧密结合。DSG 和DSC 的胞质结构域与盘状球蛋白(Plakoglobin,PG)和桥粒斑菲素蛋白(Plakophilin,PP)结合(图1)。
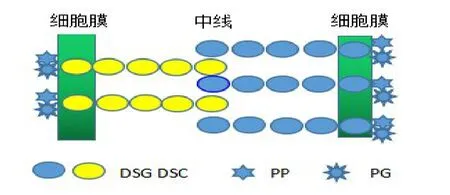
图1 桥粒芯蛋白分子组织示意图
DSG基因家族亚型DSG2 又被称为HDGC、CDHF5,是由1 118 个氨基酸组成的蛋白。DSG2 蛋白包括胞外“钙黏着蛋白”重复序列、跨膜结构区、桥粒特异性衔接蛋白的胞质结构域及脯氨酸连接序列区;另外,DSG2 蛋白还包含一个C 末端的独特区域,该区域可分为接头区域、重复序列(每个重复序列均由29±4 个残基组成)及末端区域[7]。DSG2基因由16 个外显子组成,主要表达在胃黏膜、肠上皮细胞以及非上皮组织如心肌细胞等[8-9]。
2 DSG2生物功能
2.1 DSG2 维持细胞间黏附性桥粒芯蛋白的黏附特性会随着表皮中桥粒的含量而逐渐变化[10]。DSG2突变则导致黏附力破坏,可引起心脏闰盘结构发生变化导致心律失常性右室心肌病或扩张性心肌病[11]。天疱疮自身抗体对人体皮肤及黏膜组织造成破坏引起表皮棘细胞DSG2 结构蛋白断裂,导致细胞间黏附力降低而出现水疱和溃疡等临床表征[12-13]。
2.2 DSG2 调节细胞分化与增殖功能DSG2 过表达转基因小鼠,即使在表皮蛋白启动子(Involucrin promoter-DSG2,Inv-DSG2)通过磷脂酰肌醇3 激酶(Phosphatidylinositol 3-kinase/protein kinase B,PI3K/PKB)、有丝分裂原活化蛋白激酶(Mitogen-activated protein kinase,MAPK)及信号传导与转录激活因子3(Signal transducer and activator of transcription 3,STAT3)等信号通路的控制下,小鼠仍会出现角化过度[14]。可能是因为DSG2基因激活多种促有丝分裂信号通路促进细胞增殖与分化以增加肿瘤易感性,主要过程大致是DSG2 以脂筏模型(Lipid rafts model)作为信号调节平台,通过C-Src 和小窝蛋白(Caveolin-1,Cav1)依赖性机制正向调节表皮生长因子受体(Epidermal growth factor receptor,EGFR)信号通路来刺激细胞生长和迁移[15]。胚胎着床时,DSG2基因缺失引起胚胎干细胞增殖缺陷,从而引起胚胎干细胞死亡[16]。免疫荧光实验结果发现,DSG2基因是正常胚胎干细胞增殖所必需的。
3 DSG2在肿瘤进展中的作用
DSG2基因在不同肿瘤细胞和环境中影响不同的蛋白及信号通路,导致DSG2具有多种效应。
3.1 DSG2 低表达对肿瘤的影响在一些肿瘤中DSG2 低表达时,细胞间DSG2 介导的黏附能力降低影响着HGFR/c-Met/Src/Rac1信号轴传递,促进癌细胞增殖及迁移,从而导致不良结局的发生。研究发现,DSG2基因表达水平降低与肝外胆管癌、乳腺癌等多种原发恶性肿瘤的分化程度、淋巴结转移密切相关[17]。分析比较587 份结肠癌样本、41 份结肠炎组织和114份癌旁组织发现,结肠癌组织中DSG2低表达[6],且DSG2 表达水平越低结肠癌生存率越低。在胰腺导管腺癌中发现DSG2 低表达导致细胞黏附性丧失,促进癌细胞增殖及分化[18]。
3.2 DSG2 高表达对肿瘤的影响DSG2 在一些肿瘤细胞中高表达时,DSG2 调节外泌体旁分泌和外泌体释放促有丝分裂的相关因子从而促进肿瘤细胞增殖[19-20]。体内角质形成细胞影响着上皮发育重要基因发生突变,其最多的为表皮中DSG2 过表达在转基因小鼠中会出现表皮细胞异常增生,从而引起上皮细胞发生癌变。通过TCGA 数据库分析发现,DSG2基因过表达促进喉鳞状细胞癌的发生,且DSG2表达水平与喉鳞状细胞癌生存率呈负相关,与远处转移呈正相关[21]。比较104例肝癌患者肿瘤组织与癌旁组织发现,肝癌组织中DSG2基因明显高表达,且与肿瘤大小及肿瘤分期呈正相关[22]。另外,DSG2 高表达也促进皮肤鳞状细胞癌、基底细胞癌、前列腺癌等发生发展,且其可能成为肿瘤的预后指标[6,17,23]。
4 DSG2突变与妇科恶性肿瘤的关系
4.1 DSG2 蛋白表达与宫颈癌关系研究表明,在宫颈病变发展过程中细胞间连接处发生了实质性(定量和定性)变化,影响着宫颈正常鳞状上皮细胞从低级别到高级别鳞状上皮内病变的转变,但目前尚未有文献报道关于桥粒间蛋白通过哪种方式影响细胞连接导致鳞状上皮内病变的发生。
4.1.1 DSG2蛋白结构改变影响宫颈癌的发生E钙黏蛋白、P 钙黏着蛋白、α 连环蛋白及β 连环蛋白是DSG2 桥粒间隙连接蛋白的结构之一。E 钙黏蛋白在转录水平出现下调后,DSG2 蛋白结构发生改变导致细胞间黏附功能减弱,促进高级别鳞状上皮内病变的发生[24]。P 钙黏着蛋白表达受到抑制导致鳞状细胞终末分化缺乏DSG2、CK13及表皮蛋白,引发鳞状细胞恶化。鳞状上皮内病变进展中DSG2 过表达可能导致黏附连接的组成结构发生实质性变化,比如从E-钙黏蛋白/α 连环蛋白/β 连环蛋白结构转变为PG/PP复合物,从而促进宫颈癌的发生[25]。
4.1.2 DSG2 基因在宫颈癌呈现出高表达利用TCGA和Oncomine数据库中宫颈癌与癌旁样本数据分析发现,DSG2基因在宫颈癌组织中呈现高表达,且根据年龄、病理类型、临床分期和肿瘤情况进行分层分析得出宫颈癌高危患者总体生存率均较低[26]。这一结果在比较150份宫颈癌组织、6份宫颈癌邻近的非癌组织和30 份正常宫颈组织的实验中得到证实[27]。通过细胞增殖/毒性检测和划痕实验比较分析正常宫颈上皮细胞和宫颈癌ECT 细胞、HeLa 细胞发现,降低DSG2 表达可抑制宫颈癌细胞增殖、迁移和侵袭;反之,DSG2 表达增强则起到促进作用,说明DSG2 可能成为控制宫颈癌的新型治疗靶点[28]。对于DSG2基因如何影响宫颈癌细胞,目前研究表明,DSG2基因通过调节细胞间黏附性及MAPK 信号通路从而影响细胞有丝分裂过程,且利用siRNA敲减DSG2在宫颈癌细胞中的表达,有丝分裂原激活的蛋白激酶MAPK 途径所需的p-MEK 和p-ERK 的蛋白表达下调。但最终DSG2基因如何促进宫颈癌细胞的局部侵袭和远处转移,尚无文献报道。
4.2 DSG2 基因与子宫内膜癌关系DSG2 表达与子宫内膜癌恶性程度呈正相关,其可能在子宫内膜癌的侵袭性和转移性中起重要作用。利用31 份正常子宫内膜标本、5 份非典型增生标本和41 份子宫内膜癌标本通过共聚焦激光扫描显微镜对组织中DSG2蛋白进行半定量分析,结果发现,DSG2随着癌细胞分化程度降低其表达逐渐增加,且与临床病理类型、淋巴结转移及肌层浸润程度呈正相关。测定12只发情期小鼠子宫内膜DSG2的表达,结果显示,当DSG2 表达降低时EC1-EC2 结构域存在缺失,引起细胞间隙扩大、黏附性降低[29]。综上,DSG2 过表达及DSG2蛋白结构突变将促进子宫内膜癌发生。
4.3 DSG2 基因与卵巢癌关系DSG2基因在卵巢癌浆液性肿瘤及透明细胞肿瘤等病理类型进展中均发挥促癌基因作用,但具体作用及机制尚不明确。
4.3.1 DSG2 基因及蛋白与卵巢浆液性肿瘤关系比较33 份非固定样品和92 份石蜡包埋的不同病理类型的卵巢浆液性肿瘤标本中DSG2 mRNA 和蛋白质表达,结果发现,DSG2 mRNA 表达水平因卵巢浆液性肿瘤之间恶性程度发病机理不同而不同,恶性程度越高DSG2 mRNA 表达水平越高[30]。免疫组化发现,DSG2 蛋白存在浆液性囊腺瘤组织样本中,在细胞间边界处显示出微弱但清晰完整的染色。浆液性交界性肿瘤和低级别浆液性癌组织样本DSG2 蛋白水平高于卵巢良性组织和高度恶性肿瘤,DSG2 蛋白染色不同可能与肿瘤细胞不同恶性程度和环境有关[31]。DSG2 mRNA 和蛋白表达不一致的情况可能是由于转录后翻译或转运障碍所致。
将131份卵巢浆液性高度恶性肿瘤样本根据存活时间及存活特征不同分为2个亚型(Ⅰ型、Ⅱ型),这2种亚型对铂类药物的敏感性具有显着差异。通过对2 种亚型富集分析发现DSG2 表达增加了卵巢浆液性肿瘤铂类敏感患者预后较差的风险[32],DSG2指导铂敏感患者治疗方案选择[30-31],但具体机制目前尚未阐明。溶瘤腺病毒5/3-D24-粒细胞巨噬细胞集落刺激因子病毒(Ad5/3-D24-granulocyte-macrophage colony-stimulating factor virus,ONCOS-102)是一种双重靶向的嵌合溶瘤性腺病毒。DSG2作为卵巢恶性肿瘤中ONCOS-102复制的主要受体,ONCOS-102通过DSG2 进入细胞进行复制并裂解卵巢癌细胞,实现腔内癌症的局部给药达到肿瘤细胞自溶,达到卵巢癌治疗目的[33]。对于卵巢浆液性癌的治疗可利用DSG2 作为治疗方案选择的一个指标,用以决定何时使用积极治疗策略、预测化学耐药性及作为辅助诊断方法,提高卵巢癌诊疗率。
4.3.2 DSG2 基因与卵巢透明细胞肿瘤关系研究表明,DSG2下调降低卵巢透明细胞癌中细胞黏附及促进肿瘤侵袭等恶性生物学行为的机制主要是CD133与PG相互作用。通过RNA干扰(RNAi)抑制CD133 与PG 功能导致DSG2 下调或直接敲减DSG2表达均可抑制卵巢透明细胞癌恶性生物学行为[34],抑制透明细胞癌的进一步发展。
5 总结与展望
DSG2基因突变、表达水平的变化影响着细胞增殖和恶性转化,有望成为宫颈癌、子宫内膜癌、卵巢癌的早期预警标志。通过利用靶向治疗避免过度扩大手术范围,减小创伤面积的同时加快患者术后康复,预防肿瘤复发。同时可利用化疗药物干扰DSG2基因表达,对其所影响的信号通路进行研究,以便提高化疗药物的治疗效果等,可作为以后研究的新思路。通过深入探讨DSG2 在妇科恶性肿瘤中的作用,将为妇科恶性肿瘤的筛查、早期诊断、治疗和预后的评估提供新的理论依据。此外,截至目前DSG2基因尚未对绒毛膜癌、输卵管癌、阴道癌等妇科恶性肿瘤进行数据分析及实验验证,这可为以后对妇科肿瘤的研究提供新的方向。



