何燕琴,卢珍萍,刘 温
(赣州市中心血站,江西 赣州 341000)
冷沉淀是临床常用的血液成分,采用特定的方法将保存期内的新鲜冰冻血浆在1~6℃融化后分离出大部分的血浆,并将剩余的冷不溶解物质在1 h内速冻呈固态的成分血[1];冷沉淀中有5种主要成分,除了丰富的Ⅷ因子(FⅧ)外,还有血管性血友病因子(vWF)、纤维蛋白原(FIB)、Ⅷ因子和纤维结合蛋白。主要用于儿童甲型血友病、血管性血友病(vWD)、先天性或获得性纤维蛋白原缺乏症、凝血功能障碍等患者[2]。
《全血及成分血质量要求》(GB18469—2012)中新鲜冰冻血浆的定义为:采集后储存于冷藏环境中的全血,最好在6 h(保存液为ACD)或8 h(保存液为CPD或CPDA-1)内,但不超过18 h将血浆分离出并速冻呈固态的成分血[1]。新鲜冰冻血浆和冰冻血浆的临床应用较广泛,新鲜冰冻血浆临床上适用于各凝血因子缺乏的补充。二者的主要区别是新鲜冰冻血浆中保存了不稳定的FV因子、Ⅷ因子活性[3]。
延长制备时间可以节约人力和物力[4],可以提高冷沉淀凝血因子的分离率和血液综合利用率。为了确保新鲜冰冻血浆及冷沉淀凝血因子的质量,有效监控冷沉淀凝血因子。为此,我站对2018年7月—12月期间制备时间在4~10 h的新鲜冰冻血浆制成的冷沉淀凝血因子,随机抽检200袋冷沉淀凝血因子进行Ⅷ因子和FIB含量的检测,验证不同新鲜冰冻血浆制备时限对冷沉淀凝血因子中Ⅷ因子和FIB含量损耗的影响。
1 材料与方法
1.1 对象随机抽检本站200袋制备时间在2018年7月—12月、保存液为ACD配方的400 mL全血。将制备时间在4~10 h的新鲜冰冻血浆制成的冷沉淀凝血因子分成A、B、C三组进行检测。A组:4~6 h制备;B组:7~8 h制备;C组:9~10 h制备。分别计算和比较Ⅷ因子和FIB含量及达标率,并选取三组各20例样本,以原始新鲜冰冻血浆为基础值,分别计算和比较Ⅷ因子和FIB含量及损耗率。
1.2 试剂与设备
1.2.1 血凝试剂希森美康,Ⅷ因子试剂(批号:547658A)、FIB试剂(批号:R8040)、APTT试剂(批号:R7025)、CaCl2试剂(批号:R7023)、缓冲液(批号:R7018)、质控血浆(批号:503259B)。
1.2.2 设备速冻机(MBF-21,卢森堡)、数控水浴装置(4T-4T.6C,美国)、成分离心机(CRYOFUGE 6000i,德国)、血凝仪(CA-50,希森美康)。
1.3 方法血液采集后储存于2~8℃冷藏环境中,选取80袋、60袋、60袋分别在4~6 h、7~8 h、9~10 h 3个时间段通过离心分离血浆并完成速冻,制备成新鲜冰冻血浆。后分别置于1~6℃水浴装置中融化2 h后取出,2~6℃、3 800 r·min-1离心15 min,用分浆夹将大部分上层血浆移至空袋,将留下不溶解的白色沉淀物与少量血浆混合即为冷沉淀(20~30 mL),制成冷沉淀凝血因子并在制备后1 h内完成速冻。
1.4 质量检测用CA-50血凝仪对以上200袋冷沉淀凝血因子进行Ⅷ因子和FIB含量检测,均采用凝固法检测。Ⅷ因子活性检测方法是用不同乏因子血浆和待测血浆混合,测定部分凝血活酶时间,结果用不同稀释度标准血浆、正常和乏因子混合血浆制成参考曲线来测定,FIB含量检测是通过在血浆中加入凝血酶测试凝固时间的凝血酶时间法,进行FIB含量的检测。
1.5 统计学方法采用SPSS 19.0软件进行统计分析,计量资料以均数±标准差表示,三组间比较采用单因素方差分析,两组组间比较采用SNK-q检验。P<0.05为差异有统计学意义。
2 结果
2.1 三种不同时限新鲜冰冻血浆制备冷沉淀凝血因子中Ⅷ因子活性和FIB含量比较单因素方差分析显示,三组之间Ⅷ因子和FIB含量比较,差异有统计学意义(P<0.05)。进一步两两比较显示,A组Ⅷ因子和FIB含量显着高于B组,B组Ⅷ因子和FIB含量显着高于C组(P<0.05)。见表1。
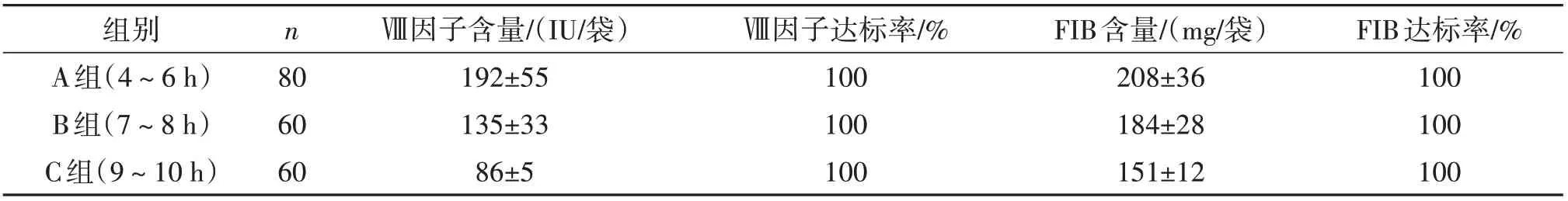
表1 三种不同时限新鲜冰冻血浆制备冷沉淀凝血因子中Ⅷ因子和FIB含量及达标率比较
2.2 三种不同时限新鲜冰冻血浆制备冷沉淀凝血因子中Ⅷ因子和FIB含量损耗情况比较单因素方差分析显示,三组之间Ⅷ因子和FIB含量损耗比较,差异有统计学意义(P<0.05)。进一步两两比较显示,C组Ⅷ因子和FIB平均损耗率高于B组,B组Ⅷ因 子 和FIB平均 损 耗率 高 于A组(P<0.05)。见表2。
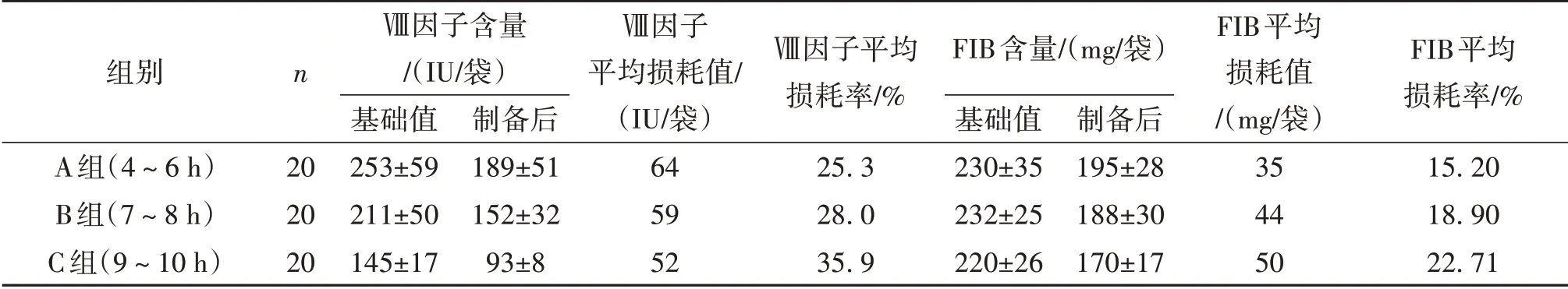
表2 3种不同时限新鲜冰冻血浆制备冷沉淀凝血因子中Ⅷ因子和FIB含量损耗比较
3 讨论
根据《全血及成分血质量要求(GBl8469—2012)》,每袋来源于400 mL全血制备的冷沉淀凝血因子中Ⅷ因子含量应≥80 IU/袋,FIB含量应≥150 mg/袋。保证冷沉淀凝血因子的质量是保证其临床疗效的前提,我站采用平板式速冻机方法对新鲜冰冻血浆和冷沉淀凝血因子进行速冻,采用水浴装置融化新鲜冰冻血浆2 h后取出离心制备,通过比较研究该方法在原料新鲜冰冻血浆不同制备时间段(4~6 h、7~8 h、9~10 h)的冷沉淀凝血因子中的Ⅷ因子和FIB含量均达到国标要求。
从表1中可以看出,C组Ⅷ因子和FIB含量最低,B组其次,A组最高,但均符合国家标准,在质量控制指标范围内,可认为血液采集和制备过程受控。这三组不同制备时间段制备的冷沉淀凝血因子虽然均能满足质量要求,但从表2中看出,Ⅷ因子和FIB含量随着制备时间的延长而下降,损耗率有明显差异。由于Ⅷ因子为不稳定凝血因子,随着保存时间的延长活性明显降低,而FIB为非不稳定凝血因子,其损耗可能与白细胞过滤有关[5]。制备冷沉淀凝血因子冻融时要损失一部分凝血因子,特别是不稳定的凝血因子,冰冻保存的冷沉淀,再次融化时还会再损失一部分凝血因子,易影响临床患者的输注效果[6]。笔者认为10 h内制备的冷沉淀凝血因子,虽然质量均符合国家标准,但Ⅷ因子和FIB含量随着制备时间的延长而下降,特别是不稳定的Ⅷ因子下降幅度明显。因此,在有条件的情况下,应该尽可能缩短制备时间,以保留更多的凝血因子,且保存和输注等过程,也应始终贯穿凝血因子生物保护意识,提升临床输注效果。
另外,既往我站采用过2~6℃大型冷库中过夜融化,可能是大型冷库有两个风机,且风机出风量大,存在循环过快的情况,对该条件融化后制备的冷沉淀凝血因子中的Ⅷ因子和FIB含量进行检测结果并不理想,出现合格率<75%的情况。故我们尝试采用1~6℃水浴装置中融化取出后离心制备,现验证结果远超国家标准,有条件的血站可以优先以上方法制备冷沉淀凝血因子。



