许树权,武 梦,肖秋香,刘志平
(1. 赣南医学院第一临床医学院;2. 赣南医学院第一附属医院病理科;3. 赣南医学院基础医学院;4. 赣南医学院炎症与免疫中心,江西 赣州 341000)
由新型冠状病毒(Severe acute respiratory syndrome coronavirus 2, SARS-CoV-2)引起的新型冠状病毒感染(Corona virus disease 2019, COVID-19)是人类历史上最广泛和最具破坏性的流行病之一,给全球生命健康和安全带来了严重威胁。截至2023年2 月23 日,全球累计确诊757 264 511 例,累计死亡6 850 594例[1]。
众所周知,人体的免疫系统由先天免疫系统和适应性免疫系统两部分组成。先天免疫系统可准确通过模式识别受体(Pattern recognition receptors,PRRs)识别病原体相关分子模式(Pathogen associated molecular patterns, PAMPs)或损伤相关分子模式(Damage associated molecular patterns, DAMPs),是人体抵御病原体入侵的第一道防线。PRRs 是免疫系统的一类关键受体,包括Toll 样受体(Toll-like receptors, TLRs)、视黄酸诱导型基因Ⅰ样受体(RIG-Ⅰ-like receptors, RLRs)、NOD 样受体(NOD-like receptors,NLRs)、C 型凝集素受体(C-type lectin-like receptors, CLRs)等。激活的PRRs 能迅速启动机体防御程序,诱发相应的炎症反应和细胞死亡,从而限制病毒的入侵并且加速适应性免疫系统的激活[2]。然而,先天免疫系统的激活对于人体来说,有时是把“双刃剑”。已有证据表明,局部过度炎症和细胞因子风暴(Cytokine storm, CS)是影响COVID-19 患者预后的重要不良因素[3]。研究发现,重症患者体内的IL-6、IL-1β、IL-18 和TNF-α 等免疫相关炎症因子水平显着高于轻症患者;CS的产生与急性呼吸窘迫综合征(Acute respiratory distress syndrome,ARDS)、凝血功能障碍和多器官衰竭等严重临床并发症密切相关,而这些并发症是COVID-19 患者死亡的主要原因[4-6]。
刺突蛋白(Spike protein, S蛋白)是SARS-CoV-2与宿主细胞识别、结合的主要结构蛋白,研究发现,S 蛋白不仅与血管紧张素转化酶2(Angiotensin-converting enzyme-2, ACE2)结合,介导病毒与细胞膜的融合,引发机体抗病毒反应[7],而且也能作为免疫配体与细胞上的PRRs 结合,引发过度的免疫应答,对机体进一步造成更严重的伤害[8];其次,S 蛋白作为病毒颗粒表面主要的抗原蛋白,也是疫苗开发领域主要的研究靶点[9]。
鉴于S蛋白在病毒感染及致病方面独特和重要的生物学机制,本文从模式识别受体着手,简要总结S 蛋白与宿主先天免疫系统相互作用的机制,以期为后续S蛋白相关的临床研究奠定基础。
1 SARS-CoV-2基因组结构与S蛋白结构和功能
SRAS-CoV-2 是β 冠状病毒属成员之一,与严重急性呼吸综合征冠状病毒(Severe acute respiratory syndrome coronavirus, SARS-CoV)和中东呼吸综合征冠状病毒(Middle East respiratory syndrome coronavirus, MERS-CoV)类似,为具有包膜的单股正链RNA 病毒[10-11]。SRAS-CoV-2 基因组序列长度从29.8 kb 到29.9 kb 不等,有5'非编码区帽结构、3'非编码区poly(A)结构和14 个开放阅读框,共编码4种结构蛋白,包括棘突蛋白(Spike protein,S 蛋白)、包膜蛋白(Envelope protein, E 蛋白)、膜蛋白(Membrane protein, M 蛋白)和核衣壳蛋白(Nucleocapsid protein, N 蛋白)及多种非结构蛋白与辅助蛋白[12](图1A)。结构蛋白主要在病毒组装和感染中发挥作用,而非结构蛋白主要参与病毒的复制过程[13]。
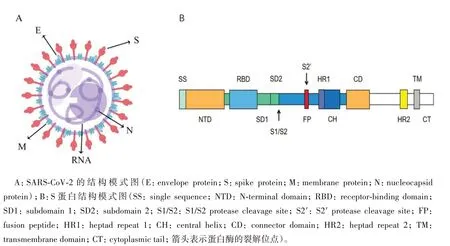
图1 SARS-CoV-2及S蛋白结构模式图
S 蛋白是一类Ⅰ型跨膜蛋白,通过冷冻电镜、X射线晶体学等技术发现,成熟的S 蛋白以相对稳定的三聚体形式存在并通过其跨膜片段锚定在病毒颗粒膜上,在病毒表面形成独特的类似皇冠的刺突结构[14-15](图1B)。每一个S 蛋白单体约为180 kDa,包含1 273个氨基酸,由S1(14-685)和S2(686-1273)两个亚基组成[16]。S1 亚基包含N 端结构域(Aminoterminal domain, NTD)、受体结合结构域(Receptor binding domain, RBD)和2 个C 端结构域(C-terminal domain1 和C-terminal domain2),具有识别与附着靶细胞受体的功能。S2 亚基包含融合肽(Fusion peptide, FP)、融合肽近端区(Fusion-peptide proximal region, FPPR)、七肽重复区1/2(Heptad repeat-1/2,HR1/2)、中心螺旋(Central helix, CH)、接头结构域(Connector domain, CD)、跨膜结构域(Transmembrane, TM)和胞质尾巴(Cytoplasmic tail, CT),在膜融合中起着促进病毒RNA 进入宿主细胞的作用[17-18]。在三聚体状态时,S1 亚基覆盖着S2 亚基,在S1和S2亚基之间存在Furin蛋白酶切割位点称为“S1/S2蛋白酶切割位点”[17,19]。
血管紧张素转化酶2(Angiotensin converting enzyme 2,ACE2)是SARS-CoV-2 的主要宿主细胞受体,广泛分布于人体肺、肾、睾丸、脑等组织器官[20]。首先,S 蛋白通过RBD 结构域与细胞膜上的ACE2结合,形成S-ACE2 复合物。在这个过程中,存在二硫键、氢键、盐桥等化学键的构建,确保复合物的稳定存在[15,21]。其次,在跨膜丝氨酸蛋白酶2(Transmembrane serine protease 2, TMPRSS2)等宿主蛋白酶的作用下,S 蛋白裂解为S1 和S2 两个亚基,随后S2 亚基进一步被裂解[22]。经过S2 亚基一系列显着的结构变化,病毒颗粒与宿主细胞发生膜融合,释放病毒RNA 并于宿主细胞内进行复制和翻译,进一步组装和排出新的病毒颗粒[18]。在这个过程中,可能会导致炎症细胞因子的大量释放,ACEs 与S 蛋白结合后数量下降,反馈性地使血管紧张素Ⅱ升高,激活肾素-血管紧张素系统(Renin angiotensin system,RAS),RAS的激活也是启动细胞因子风暴的原因之一,最终引起器官衰竭,危及生命[23]。通过分子对接和体外细胞实验等方法,发现S 蛋白也能与细胞膜上多种PRRs 直接相互作用,激活下游炎症信号产生大量炎症介质,造成机体先天免疫系统过度激活,对机体正常组织造成严重破坏[24-25]。
2 S蛋白与先天性免疫
S 蛋白作为SARS-CoV-2 关键的结构蛋白,不仅在病毒识别、入侵阶段起关键作用,而且在介导先天免疫信号传导过程及诱导中和抗体产生方面发挥重要作用。S 蛋白与宿主细胞的相互作用往往引发下游各种信号通路表达变化(图2),最终导致机体产生一系列病理生理反应。
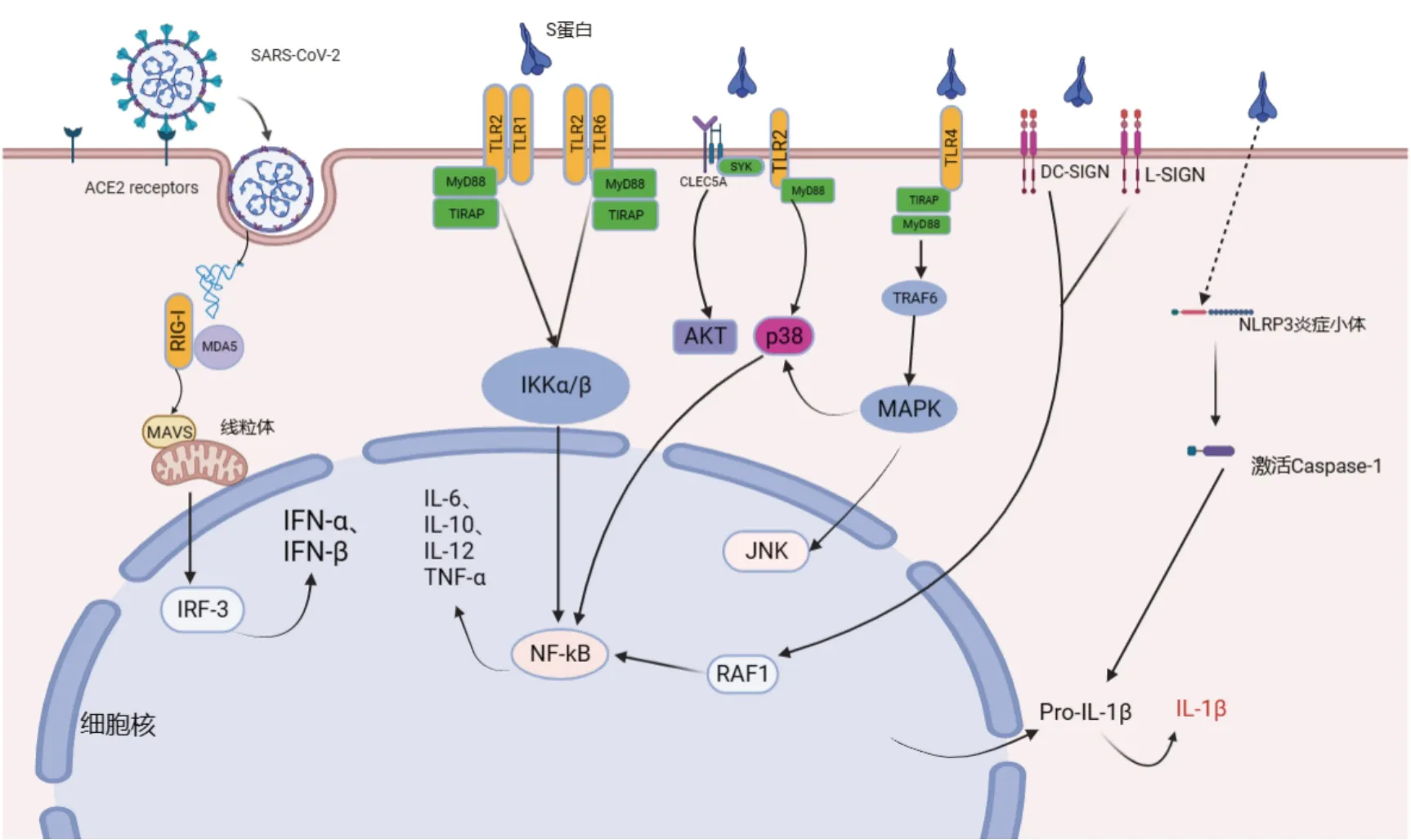
图2 SARS-CoV-2及S蛋白作用的相关信号通路
SARS-CoV-2 表面的S 蛋白与宿主表面受体ACE2 结合后进入细胞内,释放的RNA 在胞内分别被RIG-Ⅰ和MDA5 识别,随后通过定位在线粒体上的接头蛋白MAVS(线粒体抗病毒信号蛋白)激活下游通路,使得IRF-3 发生磷酸化、活化,从而介导Ⅰ型干扰素的产生;S 蛋白与TLR1/2 或TLR2/6 异二聚体结合后激活核因子NF-κB(Nuclear factor-kappa B,NF-κB)途径释放炎症因子;另外S 蛋白可同时结合CLEC5A 和TLR2,随后激活下游MyD88-p38和Syk-AKT 信号通路;S 蛋白通过TLR4 激活髓样分化因子88(Myeloid differentiation factor 88,MyD88)依赖性途径触发早期NF-κB 激活,诱导促炎细胞因子(如TNF-α 和IL-6 等)的释放;C 型凝集素受体DC-SIGN、L-SIGN结合S蛋白,通过RAF-1调节信号传导,并导致NF-κB 释放炎症因子;S 蛋白也可能激活NLRP3 炎症小体,进而激活下游的Caspase-1,激活后的Caspase-1 通过剪切IL-1β 前体蛋白,促进IL-1β的成熟释放。
2.1 TLRs 信号通路在人类呼吸道与各类先天免疫细胞群中广泛分布TLRs。迄今为止,在人体中发现了10 种TLRs,即TLR 1~10。根据TLRs 的分布,可以分为两类:一类包括TLR1、TLR2、TLR 4~6和TLR10,位于细胞膜表面,主要识别病原体的膜成分;另一类包括TLR3,TLR 7~9,存在于细胞内,主要识别来自于细菌和病毒的核酸[26-27]。TLRs 作为一类Ⅰ型跨膜蛋白,由胞外N-末端LRR 区域、跨膜区、C-末端的TIR(Toll/IL-1 receptor,TIR)区域三种结构域构成。与配体结合后,可通过MyD88 和β 干扰素TIR 结构域衔接蛋白(TIR-domain-containing adaptor inducing interferon β, TRIF)两条途径启动胞内免疫信号转导,进而激活NF-κB 和干扰素调节因子(Interferon regulatory factor, IRF)以诱导下游炎症细胞因子和干扰素的产生[28-29]。
S 蛋白能作为TLR1/2 或TLR2/6 异二聚体的配体,在巨噬细胞、单核细胞和人肺上皮细胞中激活NF-κB 和丝裂原活化蛋白激酶(Mitogen-activated protein kinases, MAPK)信号通路,从而诱导炎症反应的产生[30]。SARS-CoV-2感染还会增加TLR2的表达[31-32],并且TLR2 的表达水平与COVID-19 患者的病情严重程度呈正相关[33]。
另一项研究强调S 蛋白可通过与TLR4 结合激活NF-κB 信号通路,从而介导鼠源和人源巨噬细胞产生相应的炎症细胞因子,如TNF-α、IL-6 等[34]。这与前期两项分子对接研究结果相印证[35-36]。S1亚基可在巨噬细胞、人类外周血单核细胞(Peripheral blood mononuclear cell,PBMC)、小胶质细胞或TLR4过表达的HEK293细胞中,激活MyD88依赖性途径,导致炎症细胞因子表达上调。此外,S1 诱导的炎症反应可以被TLR4 特异性抑制剂或TLR4 siRNA 阻断[34,37-39]。S 蛋白与TLR4 的相互作用可能会增加肺泡上皮细胞中ACE2 的表达量,从而增加病毒感染数量并引起过度炎症[40]。这些研究结果表明,TLR2和TLR4可通过识别S蛋白,在炎症反应发生过程中起着重要作用。其次,除了S蛋白可直接与TLR4结合外,肺部感染过程中形成的氧化磷脂也可以激活TLR4,进一步促进免疫细胞活化和炎症细胞因子产生[41]。通过生物信息学技术和体外细胞实验发现,在PBMC 和THP-1 细胞中,S 蛋白能够上调TLR6 的基因表达量,暗示TLR6可能也在S蛋白介导的免疫反应过程中发挥潜在作用。
总的来说,TLRs 的激活可能具有两面性。S 蛋白可通过TLRs 激活先天免疫系统,并介导TLRs 表达的上调,有助于清除病毒。但过度的TLRs激活也可能会促使机体由干扰素主导的抗病毒反应转变为炎症介质释放为主的炎症反应,导致炎症反应失调和组织损伤乃至死亡,对COVID-19 患者的临床观察结果也证实了这一点。因此,进一步探索TLRs与S蛋白之间的作用关系将有助于阐明COVID-19所涉及的免疫发病机制,并有助于实施靶向TLRs的免疫治疗方法。
2.2 CLRs 信号通路CLRs 是一类由C 型凝集素样域(C-type lectin-like domains, CTLD)和信号基序组成的PRRs,主要以膜蛋白形式表达在树突状细胞、巨噬细胞等机体抗原提呈细胞上。其可通过感知基于碳水化合物的PAMP,参与病毒感染、自身免疫、变态反应等各类免疫应答过程[42-43]。大量研究证明,许多包膜病毒可以通过与宿主细胞表面的CLRs结合,促进病毒的入侵[44-45]。
据推测,高度糖基化的S蛋白中大约1/3的N-聚糖属于寡甘露糖类型。除参与维持S蛋白的正常结构,这些聚糖也能直接为免疫细胞上的CLRs 提供合适配体,从而在病毒感染过程中的细胞识别及免疫系统激活过程中发挥重要作用[46-48]。有研究[49]通过对骨髓细胞受体阵列进行高通量筛选,鉴定DCSIGN、L-SIGN、LSECtin、ASGR1 和CLEC10A 可与S蛋白结合。其次,通过与病毒共培养,还发现上述5种CLRs 可于骨髓细胞中介导强烈的炎症反应[49]。LSECtin 和DC-SIGN 可通过与S 蛋白结合,从而参与SARS-CoV-2 的入侵过程[50]。此外,通过CLRs 拮抗剂或基因敲除技术抑制CLRs 的表达后,发现病毒的入侵数量和炎症细胞因子的产生水平都出现减少和下降[51-52]。利用稳定表达DC-SIGN、L-SIGN 与SIGLEC1 的HEK 293T 细胞系进行实验,发现CLRs不仅能促进病毒入侵和炎症细胞因子的产生,还可调控靶向S蛋白位点单克隆抗体的中和活性[53]。
与其他CLRs 不同,在体外模型中发现,甘露聚糖结合的凝集素(Mannan binding lectin,MBL)可与S 蛋白上的聚糖结合激活补体系统,并抑制病毒对人肺源性上皮细胞和原代支气管细胞的入侵[54]。一项多中心研究[55]结果表明,MBL 活性与COVID-19 患者的血栓形成及肺栓塞发病率有关。这可能是由于MBL 在激活机体补体系统的时候,也激活了凝血系统[56]。
过多的中性粒细胞胞外陷阱(Neutrophil extracellular traps, NETs)会导致机体形成大量血栓并造成严重组织损伤,在COVID-19重症患者ARDS 的发病过程中起关键作用[57]。S蛋白可通过激活CLEC5A和TLR2 诱导NETs 形成、阻断CLEC5A 和TLR2,可能有利于降低COVID-19 患者严重并发症的发生率[58]。除此之外,研究人员也发现部分CLRs 与TLRs 之间存在协同关系[59-60],S 蛋白可同时结合CLEC5A 和TLR2 后激活MyD88-p38 和Syk-AKT 信号通路。因此,COVID-19患者体内的免疫紊乱可能是CLRs与TLRs协同作用的结果。
尽管目前对CLRs在SARS-CoV-2感染中的作用已有一定的了解,但对更多潜在的CLRs(如CLEC2、Dectin-2、LOX-1等)的分子机制还需更深入地探究。
2.3 NLRP3 炎症小体信号通路核苷酸结合寡聚化结构域样受体蛋白3(Nucleotide-binding oligomerization domain-like receptor protein3, NLRP3)炎症小体由NLRP3 蛋白、半胱氨酸蛋白酶-1(Caspase-1)和接头蛋白凋亡相关斑点样蛋白(Apoptosis-associated speck-like protein containing a CARD, ASC)组成[61]。当炎症小体被激活时,会促进IL-18 和IL-1β 的成熟与分泌,从而进一步激活机体免疫系统[62]。
COVID-19 患者血清中存在大量炎症小体介导的炎症因子,如IL-1β、IL-18 和乳酸脱氢酶,与患者病情严重程度相关[63-65]。IL-1β 水平的升高可抑制cAMP-CREB信号通路,同时诱导IL-6和血管内皮生长因子的产生,从而影响血管内皮细胞钙黏连蛋白的活性,导致内皮细胞通透性增加,肺泡腔渗出物进一步增多,最终加剧肺组织损伤[66-67]。体外实验表明,SARS-CoV-2在单核细胞中可显着激活NLRP3炎症小体,并引发细胞焦亡过程,这与临床观察的数据一致[65,68]。
S 蛋白本身就可以激活NLRP3 炎症小体,诱导CS 的发生[38,69-70]。利用不同的特异性抑制剂,研究人员证明S1 亚基在PBMC 中激活NLRP3 炎症小体[38]。S1亚基也可在BV2小胶质细胞中激活NLRP3炎症小体,导致炎症细胞因子产生[69]。S 蛋白可通过与TLR4及ACE2结合,介导NLRP3炎症小体依赖性细胞焦亡,损伤造血干/祖细胞[71]。目前尚不清楚S蛋白是通过TLRs-NF-κB信号轴还是通过增加血管生成素2 抑或是补体级联反应,从而激活NLRP3 炎症小体。因此,S 蛋白激活NLRP3 炎症小体的具体分子作用机制有待进一步探索。
2.4 RIG-Ⅰ信号通路RLRs是RNA病毒的主要模式识别受体,其家族有3个成员:遗传与生理实验分子(Laboratory of genetics and physiology 2,LGP2)、视黄酸诱导基因Ⅰ(Retinoic acid inducible gene I,RIG-Ⅰ)、黑色素瘤分化相关基因5(Melanoma differentiation associated gene 5,MDA5),在正常细胞中,RLRs表达量较低,但在被病毒感染的细胞中,可被IFNs 激活。有研究[72]表明,RIG-Ⅰ独立于IFNS干扰SARS-CoV-2复制,且RIG-Ⅰ还可抑制全长ACE2的表达,从而抑制SARS-CoV-2 细胞的进入。S 蛋白通过细胞表面的ACE2 使RNA 进入细胞内,此信号通路的激活在一定程度上可以降低SARA-CoV-2 的病毒数量,在COVID-19的早期感染有潜在的治疗作用。
3 小结与展望
先天免疫系统是人体抵御SARS-CoV-2 入侵的重要防线,在感知病毒和启动免疫反应过程中发挥重要作用。但是包括S蛋白在内的多种SARS-CoV-2蛋白会干扰机体免疫系统的正常激活,诱导CS和其他临床并发症的发生,从而导致患者死亡。由于缺乏安全有效的治疗药物,目前COVID-19 危重患者的死亡率依然较高。在大流行时期,临床医师主要通过抑制患者机体内致命的炎症因子风暴对症治疗,并不能完全治愈和根除病毒。迄今为止,国内外有众多研究人员针对S蛋白对机体先天免疫的作用机制进行了多方面的研究,对COVID-19 的治疗也在不断地改进,部分通过靶向机体免疫系统,抑制病毒复制和过度炎症级联反应发生的免疫疗法已经取得一定的临床疗效,尽管科学界做出了巨大努力,但尚未发现特定的抗病毒药物或疫苗来对抗新型冠状病毒。
综上所述,对SARS-CoV-2 的S 蛋白相关信号通路的研究还在深入,不同信号通路之间的相互作用也导致了一系列炎症级联反应,了解COVID-19 患者免疫应答和免疫系统病理性失调的原因有助于患者的早期治疗,对信号通路中某些关键因子的研究,有助于改善患者预后。机体内被激活的炎症信号通路,例如IL-6/JAK/STAT、NF-κB、TLR 等产生的炎症因子风暴,与患者的严重程度及气管损害程度有关。因此,对于尽快控制器官中涉及的相关细胞因子、受体及信号通路对于疾病治疗至关重要。未来各国研究机构需要加强沟通与合作,共同加强对S 蛋白在先天免疫系统相关机制中的研究,以期找到满足临床需求的免疫治疗药物和新型疫苗,为临床提供新的治疗思路。



