项岑,李耀勇,姜小琴
免疫检查点抑制剂(ICIs)的发展使癌症治疗发生了革命性的变化,目前已成为多种恶性肿瘤治疗模式的一部分,深刻改变了恶性肿瘤的治疗策略。尤其是程序性细胞死亡受体-1(PD-1)和程序性死亡配体-1(PD-L1)的研究最深、最广[1]。尽管ICIs 具有显着的临床获益,但其也表现出与传统化疗常见毒性如恶心和呕吐、黏膜炎和脱发等不同的不良反应,免疫相关不良反应(irAEs)与ICIs 特殊的自身免疫副作用相关。ICIs 治疗中活化T 细胞可导致多个不同器官/部位的健康组织发生自身免疫性破坏[2]。这些irAEs如果管理不当,可能会导致治疗延迟和治疗中断。早期识别和频繁监测这些毒性对于患者继续接受这种免疫疗法至关重要[3]。临床药师可以为ICIs 药物临床应用提供药学监护,在irAEs 管理方面发挥重要作用。本文介绍5例恶性肿瘤患者使用PD-1抑制剂后出现irAEs的讨论及用药监护过程,总结相关经验,以期为临床药师及医护人员处理irAEs 提供参考。现报道如下。
1 资料与方法
1.1 一般资料 收集2020年12月至2021年8月浙江省江山市人民医院临床药师参与诊治过程的接受免疫治疗后发生药物不良反应的5例患者,其中肺癌3例(1例小细胞肺癌,2例肺鳞癌),肝癌2例(肝内胆管腺癌1例,肝细胞癌1例),所有患者均为肿瘤晚期,且既往经过至少一线化疗,ECOG 评分0~2 分,无相关免疫治疗禁忌证。5例患者的临床资料见表1。
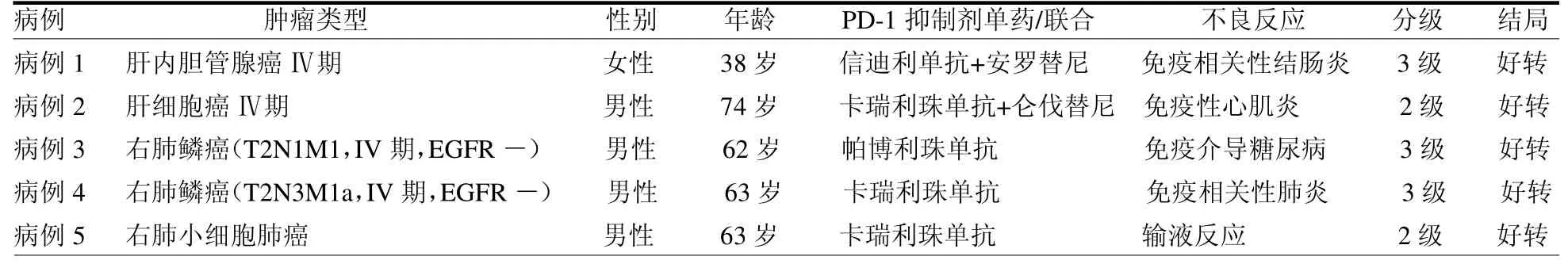
表1 5例患者的临床资料
1.2 治疗方法例1 为晚期肝内胆管腺癌患者,既往曾行局部手术治疗,后因病灶复发转移行SOX 方案化疗4个周期,后因病灶增大开始行信迪利单抗联合安罗替尼治疗,因排水样便20 余次/天来本院就诊,少许鲜血排出,考虑免疫相关性结肠炎,临床药师参考《CSCO免疫检查点抑制剂毒性毒性管理指南》,属于3 级不良反应,予停用PD-1 抑制剂,甲泼尼松40 mg 静脉滴注抗炎,蒙脱石散及洛哌丁胺口服止泻等治疗。例2 为晚期肝癌患者,在卡瑞利珠单抗静滴联合仑伐替尼口服20 d 后出现活动后四肢无力症状,磷酸肌酸激酶(CK)升高,心电图提示ST-T改变,考虑免疫性心肌炎,心肌毒性分级G2,临床药师、心内科专家参与讨论建议予停用PD-1 抑制剂,甲泼尼松80 mg 静脉滴注,控制输液速度、输液量,曲美他嗪片口服,定期复查心肌酶谱及肌钙蛋白等标志物,后逐渐减少激素使用量,并加用厄贝沙坦氢氯噻嗪片降压、比索洛尔逆转心室重构。例3 为EGFR(-)晚期肺癌患者,行白蛋白紫杉醇+卡铂一线化疗3 周期后评估病灶进展,开始二线帕博利珠单抗免疫治疗,4 周期免疫治疗后入院复查血生化相关指标提示患者血糖明显升高,尿酮体阴性,糖尿病相关抗体阴性,无明显多饮多尿口干等症状,临床药师参与病例讨论,考虑免疫介导糖尿病,及时停用帕博利珠单抗,并予阿卡波糖联合胰岛素控制血糖。例4 患者为晚期肺鳞癌,既往曾行紫杉醇+卡铂化疗4 次,后续参与临床试验予卡瑞利珠单抗(SHR-1210)免疫治疗12 次,治疗期间出现皮肤白斑及肌酐升高。2020年12月患者因乏力,活动后胸闷气促入院,查胸部HRCT 示两肺间质性炎性病灶,两侧胸腔积液。考虑患者为免疫相关间质性肺炎,不良反应分级G3,患者使用卡瑞利珠单抗多次后发生肺炎,时间相对较晚,临床药师建议永久停用ICI 治疗,予甲泼尼松静脉滴注及泼尼松片口服治疗,因不能完全排除感染,加用美罗培南抗感染治疗,行无创呼吸机辅助通气。例5 患者为小细胞肺癌,既往行EP方案化疗及放疗治疗。后因病灶进展改用EP方案化疗联合卡瑞利珠单抗免疫治疗,在第7 次卡瑞利珠单抗免疫治疗后3 h左右,出现发热、胸闷气浅,无瘙痒、僵硬、低血压、血管性水肿等症状,查血常规、降钙素原、血培养均正常,经临床药师、肿瘤科专家讨论后考虑为ICIs 输注反应,不良反应分级为G2,予吸氧、物理降温、糖皮质激素及氨茶碱等处理。
2 结果
5例接受免疫治疗的患者中,其中2例患者为免疫治疗联合抗血管生成药物应用,3例患者为免疫治疗单药治疗,结合临床检查及既往治疗经验,排除了其他药物不良反应,考虑该5例患者均为免疫相关不良反应。不良反应类型及级别:1例Ⅲ级免疫性结肠炎,1例Ⅱ级免疫性心肌炎,1例Ⅲ级免疫相关糖尿病,1例Ⅲ级免疫性肺炎,1例Ⅱ级免疫药物输液反应。前4例患者予停用免疫治疗,予以积极对症支持治疗的同时,给予激素治疗,并根据患者情况调整激素用量,患者症状均逐渐缓解,考虑不良反应较重,后续均未再给予免疫治疗。病例5 中在对症处理后症状缓解,继续予ICIs 治疗。
3 讨论
回顾诊疗过程并查阅相关文献,本文结肠炎病例发生在末次使用ICI后3个月左右,与国外相关文献数据相符合[4]。该患者遗憾之处在于未进行结肠镜病理活检以明确临床诊断,并进一步与炎症性肠病相鉴别。目前病理组织活检在irAEs诊断中的价值尚不确切,临床中通常在发生严重的器质性损害不良反应时,为明确病因,医生才会选择组织活检来明确病变性质。现阶段irAEs 的诊断主要基于临床症状、化验及影像学检查,因此,临床上明确诊断irAEs具有滞后性,且确诊时不良反应级别多为Ⅱ级以上,目前仍缺乏简单高效的irAEs 早期诊断标准。最终患者通过积极激素及补液等治疗症状得到缓解,如在激素逐渐减量过程中复发,临床药师应充分做好治疗预案,必要时再次增加皮质类固醇剂量。如患者在使用大剂量激素3 ~5d内症状没有改善,那么应予抗肿瘤坏死因子 抑制剂英夫利昔单抗治疗,直到症状缓解[5-6]。
心肌炎病例其不良反应发生时间、临床表现及检查结果均与既往报道相一致[7],ICIs 相关免疫性心肌炎是免疫治疗相关心脏毒性最常见也是预后最差的类型,在各种irAEs 中也是最致命的,其死亡率达到27%~46%[8]。ICIs 相关的心脏毒性机制尚不完全清楚。在临床前模型中已表明,ICIs可通过释放T细胞对肿瘤的抑制作用,也可以调动心肌细胞对肿瘤的抑制作用,导致心脏T 细胞过度激活。随后,T 细胞过度激活可能导致ICIs 相关的心脏毒性,如心肌炎和心肌纤维化增加,甚至导致心力衰竭[9]。本例患者联用仑伐替尼可能会增加ICI 心脏毒性的风险[10]。
免疫介导的糖尿病是较罕见的内分泌irAEs之一,在ICIs中帕博利珠单抗较常见,而病例3 即发生在使用帕博利珠单抗后,无多尿、烦躁、体质量减轻和呕吐等症状使得临床医生对此类可疑糖尿病的筛查难度有所增加。与其他常见的irAEs不同,ICIs相关内分泌不良反应通常不可逆[11]。根据美国临床肿瘤学会(ASCO)指南建议在基线和12周内的每个治疗周期中测量血糖水平,然后每3 ~6 周监测一次。对于ICIs 所致3 级或更高级别高血糖(定义为空腹血糖>250 mg/dL)和严重症状(具有医学意义或危及生命的后果)的患者,在实现血糖控制之前,暂予停用ICIs。规范血糖监测至关重要,因该患者没有酮症证据或T1DM 血清学证据,考虑可实时继续进行ICIs 治疗。
免疫相关性肺炎较其他irAEs 罕见,但却是有致命威胁的严重不良事件,在PD-1/PD-L1 抑制剂相关死亡事件中约占35%[8]。相对其他irAEs,免疫相关性肺炎发生时间相对较晚,但NSCLC 发生肺炎的时间通常早于恶性黑色素瘤等其他恶性肿瘤[12]。本文患者为鳞癌、既往有慢性阻塞性肺病史,属免疫性相关肺炎的高危人群。患者先后接受伏立康唑、美罗培南抗感染,甲泼尼松抗炎等治疗,症状好转后激素减量。该病例激素使用时间较长,临床药师告知患者长期激素使用风险:胃肠道出血、骨质疏松、增加感染风险、诱发糖尿病等[13],嘱患者定期口服H2 受体拮抗剂或质子泵抑制剂、补充维生素D 及钙片,定期复查血糖。随访患者预后良好,未出现激素相关不良反应。
接受卡瑞利珠单抗单药治疗的患者中,输液相关反应发生率为0.9%,免疫联合治疗可能增加输液反应的复杂性,比如在KEYNOTE-407 研究中,帕博利珠单抗联合化疗组和化疗组3 ~4 级输注反应发生率分别为2.4%和0.6%[14]。
综上所述,ICIs治疗为各种恶性肿瘤带来临床获益的同时,越来越多的患者正在经历免疫治疗带来的不良反应。临床药师需配合临床医生处理免疫检查点抑制剂不良反应,早期识别高危人群,监测生物标志物、动态复查相关检查及并识别其前驱症状,对高危人群实施药学监护,根据相关指南和临床经验做出妥善处理,才能够更好地指导患者和医护人员进行免疫检查点抑制剂治疗。目前国内外虽然有多项免疫治疗药物临床研究,并发布了免疫治疗不良反应处理指南,但临床上仍有一些问题尚待解决,临床药师要及时更新知识,指导临床用药,为接受免疫治疗的恶性肿瘤患者带来最大获益。



