张博,王旭璐,赵杰,赵岱雯
电针疗法是在传统针灸方法基础上通以接近人体生物电的微量电流持续刺激,以防治疾病的一种疗法。研究表明,电针预处理可增加脑缺血耐受,降低脑缺血再灌注损伤(CIRI),但具体影响机制不详[1]。小泛素类修饰蛋白(SUMO)负责真核细胞生物体内蛋白翻译后修饰,称为SUMO 化修饰[2]。SUMO 化修饰主要影响目的蛋白的活性、定位以及蛋白之间的相互作用[3],其主要亚型SUMO2/3 修饰具有神经保护功能[4]。SUMO化修饰特异性蛋白酶3(SENP3)可以对SUMO 化修饰的底物进行可逆的去SUMO化,所以被认为是修饰过程中的关键因子[5]。研究表明,SENP3 在脊髓损伤及脑缺血小鼠模型中高表达,并且证实SENP3 能促进神经细胞凋亡[6]。本研究拟探讨电针预处理对小鼠CIRI 脑组织SENP3 表达的影响,报道如下。
1 资料与方法
1.1 实验动物 选用10 周龄的C57BL/6 健康雄性小鼠72 只,体质量22 ~27 g,由浙江省实验动物中心提供[许可证号:SCXK(浙)2020-0001]。所有小鼠在层流动物房饲养,自由饮食,12 h 交替光照,在实验前适应性饲养2 周。研究获得浙江大学医学院附属第二医院动物伦理委员会审核批准。
1.2 实验分组 随机将小鼠分为3 组(n=24):假手术组(S组),正常暴露双侧颈总动脉,不夹闭;脑缺血再灌注组(I/R 组),动脉夹夹闭双侧颈总动脉15 min 后再开放,建立小鼠CIRI 模型;电针预处理组(EA组),建模前根据“实验动物穴位图谱”取百会穴(头顶部两耳连线中点),每天9:00 使用规格0.25 mm×25 mm 的毫针,于百会穴处皮肤平刺入2 ~3 mm,电针刺激频率为2/15 Hz疏密波,电流刺激强度1 mA,电针刺激时间30 min,以刺激后引起轻微的肌肉收缩判定为有效刺激,1 次/d,连续5 d。
1.3 实验造模 参考文献[7]介绍的方法,造模前小鼠麻醉采用4%水合氯醛(0.15 ml/10 g),麻醉方式采用腹腔注射,在麻醉达成后将小鼠仰卧位固定于操作台上,经门牙栓线以充分暴露颈部。肥皂水消毒颈部,并剃除颈部毛发,碘伏再次消毒。于颈正中切开,仔细分离结缔组织及肌肉组织,显露并分离出双侧颈总动脉,挂线后轻微提起小动脉并使用小动脉夹夹闭,15 min 后松开小动脉夹恢复颈动脉血流。
1.4 染色法测定细胞凋亡率 3 组于再灌注4、8、12及24 h 各处死6 只小鼠,其中每组各取3 只处死的小鼠,麻醉达成后冰台上断头取脑,迅速分离海马组织并转入液氮冻存。每组剩下的3 只处死小鼠,选择大脑海马CA1区组织制片检测凋亡率,采用TUNEL 染色。进行麻醉达成后开胸,显露心脏,经左心室依次灌注0.9%氯化钠注射液和4%多聚甲醛,4 ℃冰面取海马组织,常规固定、脱水、包埋、切片。取3张连续切片常规脱蜡,按照Roche 公司的TUNEL 试剂盒(瑞士)说明书进行操作,DAB显色后在400 倍光镜下观察,细胞核中有棕黄色颗粒染色者标记为凋亡细胞,每张切片随机选取海马CA1 区不重叠的5 个视野。细胞凋亡率=凋亡细胞计数/总细胞计数×100%。
1.5 海马CA1 区SENP3 表达的检测 取出冻存的每组3 只小鼠的海马组织,采用Western Blot方法检测海马区SENP3 表达。加入少量液氮研磨,充分研磨后加入裂解液进行裂解,4 ℃离心后取上清液,BCA 法测定上清液蛋白浓度,加入5×上样缓冲液,置于100 ℃水浴锅变性5 min,置于―20℃冻存。配制10%分离胶和浓缩胶,每孔上样6l后进行电泳,蛋白完全分离后将目的蛋白转移到PVDF 膜上,5%脱脂奶粉室温封闭2 h,1×TBST漂洗3 次,加入1 ∶5 000 稀释的SENP3 兔多克隆抗体(Millipore 公司,美国),4 ℃摇床过夜。次日再次1×TBST 漂洗3 次后加入1 ∶10 000 稀释的山羊抗兔IgG 二抗(北京中杉金桥科技公司,中国),室温摇床孵育1 h,最后经ECL 发光,曝光显影。显影后的条带图像采用Quantity One 分析软件(Bio-Rod 公司,美国)测定灰度值,以SENP3 条带灰度值与内参-actin 条带灰度值的比值反映目标蛋白表达水平。
1.6 统计方法 采用GraphPad prism7 软件进行数据分析和统计绘图,计量资料以均数±标准差表示,多组比较采用F 检验,多重比较采用LSD-t 检验。P<0.05 表示差异有统计学意义。
2 结果
2.1 神经元凋亡率情况 3 组小鼠光镜下海马CA1区的病理结果见图1 ~3。与S 组比较,I/R 组和EA组再灌注各时间点神经元凋亡率显着升高(t≥5.28,均P <0.05);与I/R 组比较,EA 组再灌注各时间点神经元凋亡率明显降低(t≥5.30,均P <0.05),见图4。
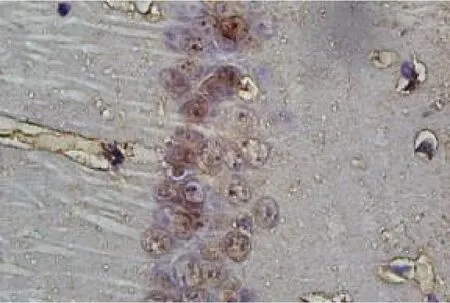
图1 S组小鼠光镜下海马CA1 区的病理结果(HE染色,×400)
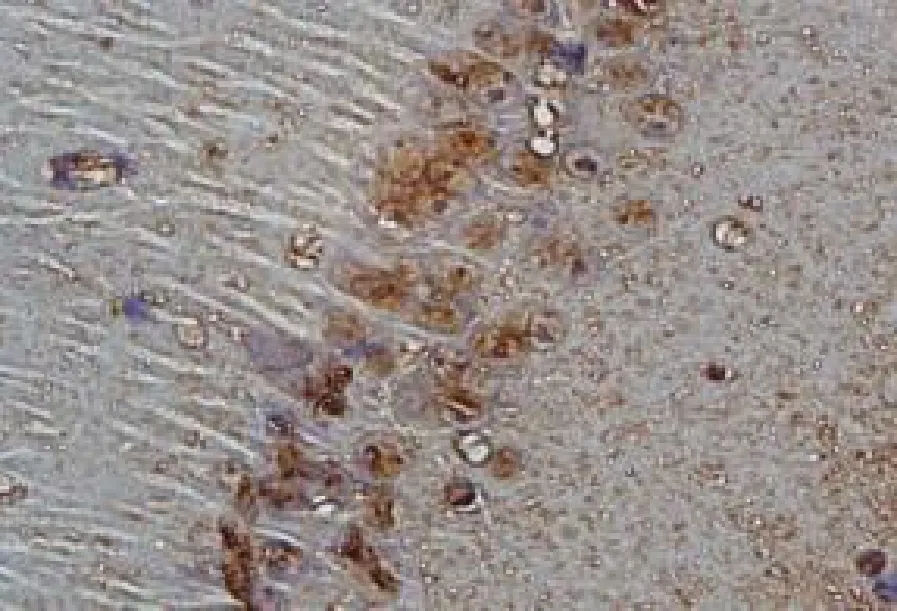
图2 I/R组小鼠光镜下海马CA1 区的病理结果(HE染色,×400)
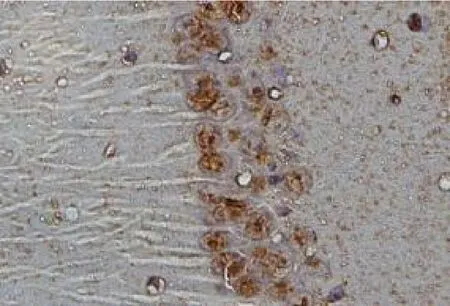
图3 EA 组小鼠光镜下海马CA1 区的病理结果(HE 染色,×400)

图4 3 组小鼠各时间点海马CA1 区神经细胞凋亡率比较
2.2 海马CA1 区SENP3 蛋白表达 与S 组比较,I/R 组和EA 组再灌注各时间点SENP3 表达量均升高(t≥3.33,均P <0.05);与I/R 组比较,EA 组再灌注各时间点SENP3 表达量显着降低(t≥4.51,均P<0.05),见表1。
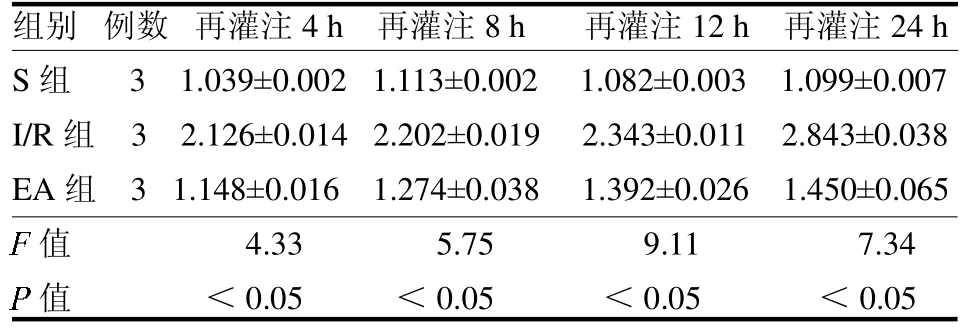
表1 3 组小鼠各时间点海马CA1 区SENP3 蛋白表达水平比较
3 讨论
CIRI 是一种非常敏感且进展迅速的病理生理过程,该过程常由多因素介导,并迅速引起细胞能量代谢障碍、ROS 异常聚集、钙离子超载及炎性因子激活等,最终导致神经功能损伤[8]。研究发现,针刺百会穴可减少CIRI[9],这为临床CIRI的治疗提供了一种新的方向。
SUMO 化修饰是一个高效的蛋白修饰方式,该过程通过与底物的异肽键结合实现,且这一过程是可逆的,打断异肽键结合,阻断这一进程称为去SUMO 化修饰(de-SUMOylation)。de-SUMOylation修饰的过程由SUMO特异性蛋白酶(SENPs或SUSPs)家族催化发生。SENP3 是SENPs 家族中分子量最小的成员,定位于核仁,研究表明SENP3 在CIRI过程中的表达增加并促进细胞凋亡[10]。RNAi 介导的SENP3 基因敲除增强了SUMO2/3 的结合,减少了细胞凋亡的发生[11]。本实验结果表明,与I/R 组比较,EA 组小鼠经电针预处理后CIRI 期间SENP3 表达下调,这意味着增强了SUMO 化修饰,从而增加了细胞存活率。而电针预刺激时SENP3 的表达下调机制仍有待于进一步研究。
综上所述,CIRI 时SENP3 表达升高,弱化了SUMO化修饰,细胞凋亡率增加,而电针预刺激可以减少神经细胞凋亡,其机制可能与SENP3 的表达减少,增强了SUMO 化修饰有关。
利益冲突 所有作者声明无利益冲突
作者贡献声明 赵杰、赵岱雯、张博:实验操作、论文撰写;王旭璐、赵杰:数据整理、统计学分析;张博、王旭璐:研究指导、论文修改、经费支持



