陈慧芬,谢艳萍,梁亦贤,朱文娟
肺癌发病率及死亡率均居于恶性肿瘤前列[1],其早期症状不明显,待患者出现咳嗽、胸痛及气短等症状而就诊时,大多已进入中晚期,尽管目前肺癌的治疗已取得显着进步,但预后仍较差,尤其是肿瘤的侵袭转移及复发,严重影响患者的生存时间及生存质量[2-3]。因此,探寻可用于评估肺癌预后的生物标志物,已成为科研工作者的研究热点。有研究证实,含SH2 结构域的Ⅱ型肌醇5’-磷酸酶(SHIP2)蛋白参与肿瘤的发生及发展过程[4]。类表皮生长因子域7(EGFL7)属于血管内皮表达基因,呈明显特异性,该基因与恶性脑膜瘤发生及发展密切相关[5]。但目前临床上关于SHIP2、EGFL7 表达与肺癌预后关联性的研究尚不多见,本研究通过回顾性收集肺癌患者的病历资料,以探讨组织SHIP2、EGFL7 表达与肺癌患者临床病理参数及预后的关系,现报道如下。
1 资料与方法
1.1 一般资料 回顾性收集2019 年1—12 月湖州市第一人民医院收治的76 例肺癌患者的临床及随访资料。纳入标准:(1)符合《肺癌临床诊疗指南(2018 版)》[6]中的相关诊断标准,且经病理学确诊;(2)年龄≥18 岁;(3)无认知障碍及精神类疾病。排除标准:(1)伴有严重感染、全身免疫系统疾病及其他恶性肿瘤;(2)妊娠期或哺乳期女性;(3)临床资料缺失。本研究经湖州市第一人民医院医学科研与临床试验伦理委员会审批通过。
1.2 方法
1.2.1 检测方法 使用免疫组织化学SP(链霉菌抗生物素蛋白-过氧化物酶)法检测SHIP2、EGFL7 蛋白表达。收集入组患者经手术切除的癌组织及癌旁组织标本,癌旁组织为超过肺癌组织边缘5 cm的无癌组织。SHIP2 蛋白表达:将切下组织予以石蜡包埋,4m 厚连续切片,二甲苯脱蜡,梯度酒精水化及苏木精染色处理。先使用3%H2O2溶液清除内源性过氧化物,予以柠檬酸修复液在高温高压状态下进行抗原修复,待冷却后使用磷酸盐缓冲液(PBS)漂洗3 次,每次漂洗时间为3 min,随后加入一抗兔抗人SHIP2 单克隆抗体,在4 ℃环境中孵育过夜。待使用PBS漂洗后,使用3,3’二氨基联苯胺四盐酸盐(DAB)显色,苏木精复染,脱水,封片。阴性对照组使用PBS 代替一抗进行处理。EGFL7 蛋白表达:以石蜡包埋切片,二甲苯脱蜡,梯度酒精水化,3%过氧化氢孵育处理后,使用磷酸盐缓冲液(PBS)进行洗涤以阻断内源性过氧化物酶;使用微波进行抗原修复,并分别加入正常羊血清和过氧化物酶溶液,待孵育后将一抗(兔抗人EGFL7 多克隆抗体)加入在4 ℃环境中进行孵育过夜,再加入生物素标记二抗和辣根过氧化物酶标记的链霉素卵白素链霉菌抗生物素溶液,最后使用DAB 染色,苏木素复染,脱水及封片处理。阴性对照组使用PBS 代替一抗进行处理。最后在显微镜下观察。
1.2.2 结果判定 免疫结果判定由病理科两位高年资医师独立完成。以细胞膜或细胞浆内出现棕黄色或棕褐色染色,判定为SHIP2、EGFL7 蛋白表达阳性。每个切片随机选择5 个视野,由病理医师在光学显微镜下进行观察。根据二次积分法进行计分,将细胞染色强度与阳性细胞所占比例乘积作为评分,其中阳性细胞染色强度评分标准如下:若未见染色则计为0分,浅黄色计为1 分,浅棕色计为2 分,深棕色计为3 分;阳性细胞所占比例评分具体如下:若<5%则计为0分,5%~25%计为1 分,26%~50%计为2 分,51%~75%计为3 分,若>75%则计为4 分。将上述两项分数的乘积作为总评分,若总评分<3 分,则判定为低表达(阴性);若总评分≥3分,则判定为高表达(阳性)。
1.3 随访 随访时间为3 年,包括电话随访及门诊复诊,收集患者临床资料,截止时间为2022 年12 月,统计所有入组患者的3 年生存率。
1.4 统计方法 采用SPSS 23.0 统计软件进行数据分析,计数资料采用2检验;采用Kaplan-Meier法绘制生存曲线,组间比较采用Log-rank检验;采用多变量Cox 回归分析影响肺癌预后的影响因素。P <0.05 表示差异有统计学意义。
2 结果
2.1 肺癌组织及癌旁组织SHIP2、EGFL7 蛋白表达比较 肺癌组织中SHIP2、EGFL7 蛋白高表达率均高于癌旁组织(均P <0.05),见表1。

表1 肺癌组织及癌旁组织SHIP2、EGFL7 表达情况比较例(%)
2.2 SHIP2、EGFL7 表达与肺癌患者临床病理参数的关系 SHIP2、EGFL7 高表达与低表达组性别、年龄、肿瘤大小、病理类型及分化程度差异均无统计学意义(均P >0.05),但两组TNM 分期及淋巴结转移差异均有统计学意义(均P <0.05),见表2。

表2 SHIP2、EGFL7 表达与肺癌患者临床病理参数的关系例
2.3 预后情况 肺癌患者3 年生存率为46.05%(35/76),其中SHIP2 高表达组3 年生存率为32.65%(16/49),低表达组为70.37%(19/27),SHIP2 高、低表达组3 年生存率差异有统计学意义(=9.968,P<0.05);EGFL7 高表达组3 年生存率为36.17 %(17/47),低表达组为62.07%(18/29),EGFL7 高、低表达组3 年生存率差异有统计学意义(=4.842,P<0.05),见图1 ~2。

图1 SHIP2 表达组生存曲线
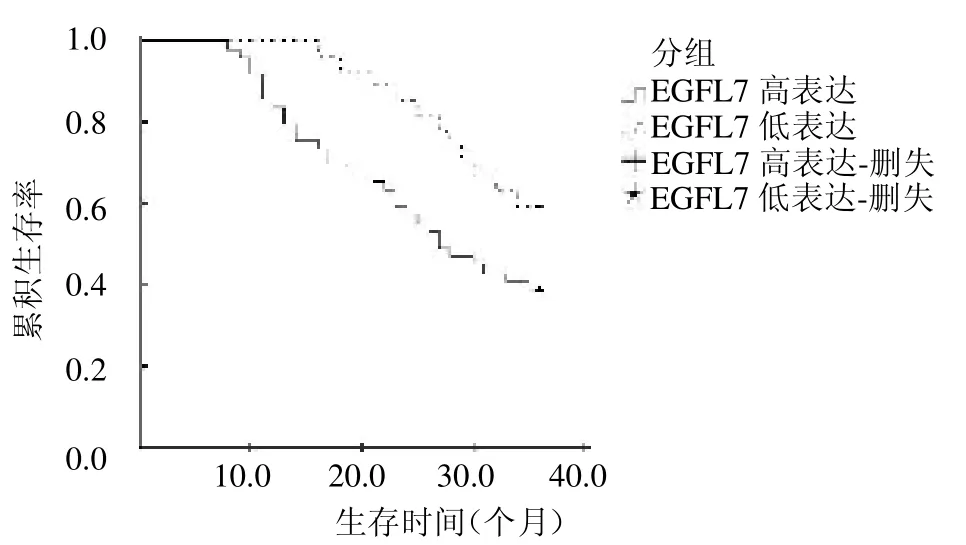
图2 EGFL7 表达组生存曲线
2.4 多因素Cox 回归分析TNM 分期、淋巴结转移、SHIP2 及EGFL7 高表达均为影响肺癌患者预后的独立危险因素(均P <0.05),见表3。

表3 多因素Cox 回归分析
3 讨论
国内外对肺癌致病因素及发病机制已有大量研究,但其发病机制较为复杂,且受多种因素影响,导致临床上对肺癌的诊断及预后评估的准确性仍存在不足。因此,为进一步明确诊断,使患者尽早得到有效治疗,降低复发率及死亡率,有必要继续探索可用于明确早期肺癌诊断的标志物及预后的影响因子。本研究结果显示肺癌组织中SHIP2、EGFL7 蛋白高表达率均高于癌旁组织(均P <0.05),这说明SHIP2、EGFL7 蛋白高表达与肺癌的发生有关。赖世平等[7]研究后发现在卵巢癌组织中SHIP2 蛋白高表达所占比例显着高于癌旁组织;张芳等[8]认为EGFL7蛋白在常见泪腺上皮性肿瘤组织中呈高表达状态,且与血管生成及肿瘤细胞增殖活性呈明显相关性。有研究指出,磷脂酰肌醇3-激酶/蛋白激酶(P13K/Akt)信号转导通路与肿瘤细胞增殖、分化密切相关,该通道在肿瘤细胞恶性增殖和转移及新血管生成过程中具有重要作用[9];SHIP2 通过负向调节P13K/Akt 信号转导通路可达到抑制肿瘤细胞增殖的目的[10]。EGFL7 具有内分泌功能,EGFL7 蛋白介导机体胚胎血管发育及内皮细胞迁移过程,而血管生成是影响恶性肿瘤生长、侵袭及转移的重要因素,在宫颈癌[11]、直肠癌[12]等恶性肿瘤组织中EGFL7 蛋白呈高表达。因此,EGFL7 可能通过参与血管生成而介导肿瘤发生、进展过程。
本研究结果显示肺癌组织中SHIP2、EGFL7 高表达与TNM 分期、淋巴结转移有关(均P <0.05),这提示SHIP2、EGFL7 高表达可能参与肺癌发生、发展过程。刘固等[13]提出EGFL7 蛋白参与结直肠癌(CRC)发生、侵袭及转移等,EGFL7 高表达与TNM分期无关,但与淋巴结转移呈明显相关性,并认为EGFL7 表达可作为CRC术后预后情况的预测因子。SHIP2、EGFL7 高表达组3 年生存率低于低表达组(P <0.05),这表明SHIP2、EGFL7 高表达与肺癌预后有关,且高表达通常提示预后不良。另外,本研究通过多因素Cox 回归分析结果显示TNM 分期、淋巴结转移、SHIP2 及EGFL7 高表达均为影响肺癌患者预后的独立危险因素(均P <0.05)。这进一步说明SHIP2、EGFL7 高表达不仅与肺癌发生及预后明显相关,还可作为评估肺癌预后的预测因子[14]。有研究显示,SHIP2 表达与非小细胞肺癌的转移和血管侵袭密切相关。Feleke 等[15]在报道中提出EGFL7在骨肉瘤(OS)和骨巨细胞瘤(GCTB)中呈高表达,可作为OS 和GCTB 细胞靶向治疗和预后评估的生物标志物。另外,Heissig 等[16]提出EGFL7 表达可能介导肿瘤生长、转移及耐药性。因此,肺癌患者SHIP2、EGFL7 高表达可引起肿瘤细胞增殖、分化,导致疾病进一步恶化,故监测肺癌组织SHIP2、EGFL7 表达水平可评估患者预后情况。
利益冲突 所有作者声明无利益冲突
作者贡献声明 陈慧芬:实验操作、论文撰写;谢艳萍、梁亦贤、朱文娟:数据整理、统计学分析、论文修改



