胡宏波,贾安平,梁秀兰,刘振鹏,杨 建,詹前美
(柳州铁路中心医院:1.检验科;2.消化内科,广西 545007)
CD4+CD25+调节性 T细胞(CD4+CD25+regulatory T cell,Treg)是一类具有免疫调节作用的细胞群,是健康个体T细胞库的组成成分,占CD4+细胞5%~10%[1]。该细胞群在自身免疫耐受的维持中发挥重要作用。有研究发现在肿瘤患者中Treg数目增加,其增加能引起患者生存率下降,并且与患者预后呈负相关[2]。应用抗CD25抗体清除Treg,能够在荷瘤小鼠体内引起有效的抗肿瘤免疫应答,使其存活期延长,表明Treg与肿瘤的发生、发展有密切关系[3]。因此,作者通过检测胃癌组织中T reg分布数量的改变,并以正常组织作为对照,进一步研究T reg在胃癌免疫中的作用。
1 临床资料
1.1 一般资料 胃癌组:本院2007年1月至2009年1月手术切除的15例胃癌标本;对照组:15例正常胃组织来源于同期因非肿瘤性疾病行胃大部分切除距病变边缘2cm正常组织。所有标本均在手术切除后迅速冻存于液氮中,然后置于-80℃低温保存。全部病例术前均未行放、化疗,术后均经病理检查证实。
1.2 主要试剂及仪器设备 抗人 PE-cy5-CD4、FITC-CD25、PE-CD25单抗及同型对照小鼠IgG1抗体购自美国Becton Dickinson公司,CytodetectTM胞内细胞因子刺激/染色试剂盒、抗IL-10-PE、TGF-β-PE单抗及同型对照IgG1抗体均购自荷兰IQ公司,MagCellect人Treg免疫磁珠细胞分选试剂盒购自美国R&D公司,NycoprepTM 1.077密度梯度分离液购自挪威Axis-Shield公司,RPMI l640培养基〔含100mg/L链霉素、1×105u/L青霉素、10%胎牛血清(澳大利Invitrogen公司)、5×10-5mol/L 2-巯基乙醇〕购自美国Gibco公司,FACSCalibur型流式细胞仪为美国BD公司产品。
1.3 流式细胞仪检测T reg 剪碎胃组织,37℃消化2h(消化液含1mg/mL胶原酶、2.5u/mL透明质酸酶、0.1mg/mL DNase),尼龙网过滤,经密度梯度离心法分离出单一核细胞。在上述细胞中,胃癌组加入PE-cy5-CD4单抗、FITC-CD25单抗;对照组加入等量FITC标记同型对照小鼠IgG1,振荡混匀,室温暗处孵育20min,PBS洗涤,上机检测。
1.4 Treg的分离、纯化 用冷免疫磁珠分选缓冲液调整分离出的单一核细胞为(1~2)×107/mL,取2mL细胞悬液加入CD4+T细胞生物素化混合抗体,置冰箱孵育15min后加入被链霉亲和素包被的磁珠,混合反应15min,将试管水平放置于磁分离架上,阴性选择获得 CD4+T细胞,再按每1×107细胞加入磁珠标记抗CD25单抗,阳性选择获得CD4+CD25+T细胞,通过流式细胞仪分析细胞纯度。
1.5 Treg内细胞因子检测 取24孔细胞培养板,每孔加入经免疫磁珠分选法分离、纯化得到的Treg(2×106/mL)悬液1mL,共6孔,往诱导白介素-10(IL-10)产生孔加入10μ L巴豆脂(PMA)、10μ L艾罗霉素、10μ L莫能星;往诱导转化生长因子-β(TGF-β)产生孔加入 20μ L PMA 、10μ L 艾罗霉素、10μ L 莫能星。37℃、5%CO2饱和水汽培养箱孵育5h,使IL-10产生达高峰;孵育24h,使TGF-β产生达高峰。经 HBSS洗涤、4%冷多聚甲醛固定细胞、细胞表面抗原染色、细胞破膜、胞内细胞因子染色后,进行流式细胞仪检测,用Cell Quest软件分析数据,以荧光抗体染色阳性细胞百分率记录结果。
1.6 统计学方法 应用SPSS13.0统计软件进行分析,所有数据以表示,组间均数比较采用 t检验,以 P<0.05为差异有统计学意义。
2 结 果
2.1 胃组织中Treg表达比较 胃癌组Treg表达率为(11.51±0.64)%,对照组为(8.40±0.52)%;胃癌组 Treg分布数量明显高于对照组,差异有统计学意义(P<0.05),见图1。
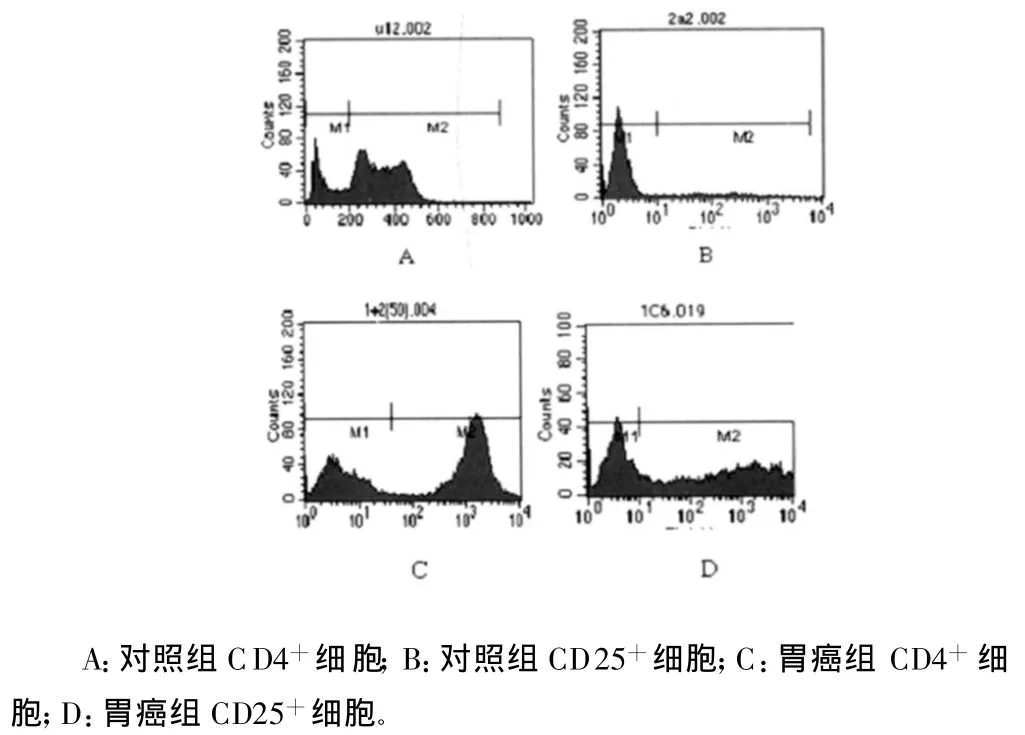
图1 胃组织中Treg表达的比较
表1 Treg抑制性细胞因子表达水平(%,n=20)
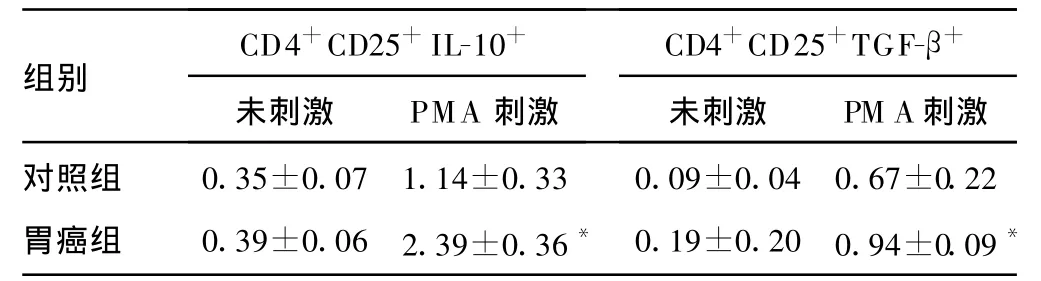
表1 Treg抑制性细胞因子表达水平(%,n=20)
*:与对照组比较,P<0.05。
CD4+CD25+IL-10+CD4+CD25+TGF-β+组别未刺激 PMA刺激 未刺激 PM A刺激对照组 0.35±0.071.14±0.33 0.09±0.040.67±0.22胃癌组 0.39±0.062.39±0.36* 0.19±0.200.94±0.09*
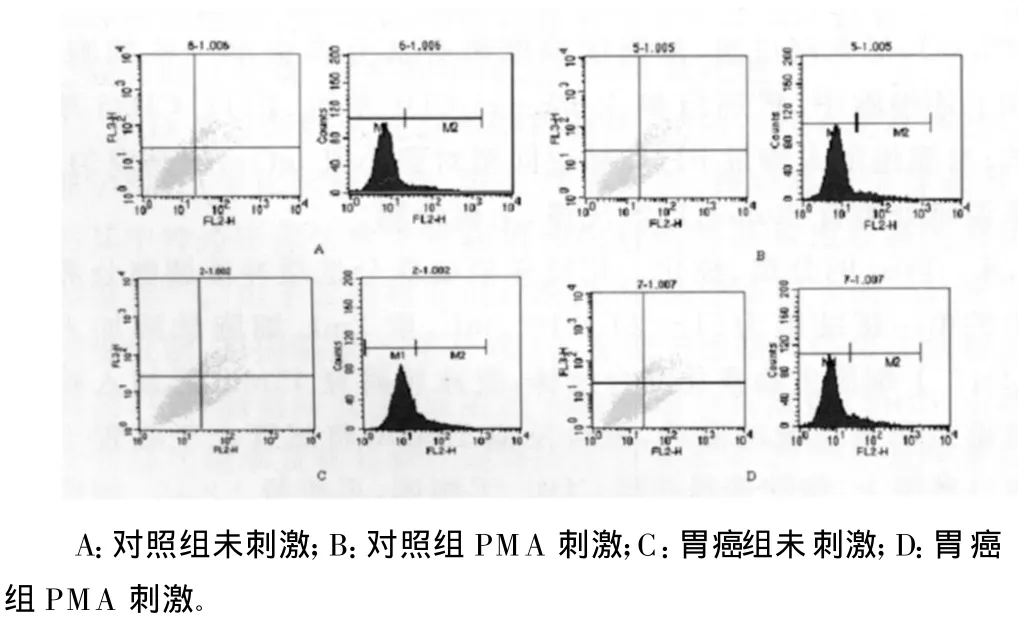
图2 Treg抑制性细胞因子IL-10分泌水平
2.2 T reg抑制性细胞因子的表达 分选出的Treg纯度大于89%。两组比较,刺激前 T reg内IL-10、TGF-β分泌水平差异无统计学意义(P>0.05);经体外PMA和艾罗霉素刺激后,胃癌组T reg内IL-10及TGF-β分泌水平均比对照组明显增加,差异有统计学意义(P<0.05),见表2和图2、3。
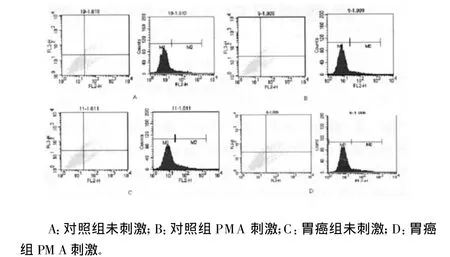
图3 Treg抑制性细胞因子 TGF-β分泌水平
3 讨 论
正常情况下天然产生的Treg在机体内主要作用是动态调节机体免疫平衡,防止免疫反应无限制扩大及抑制自身免疫反应的发生。然而,在肿瘤患者的肿瘤组织、肿瘤浸润淋巴细胞或外周血中T reg数目增加,并且Treg增加与患者生存率下降有关。有研究发现给鼠接种肿瘤或自身抗原后,诱导出大量活化Foxp3+T reg,同时提高了该鼠对于化学诱导致癌以及接种成瘤的敏感性和肿瘤转移率[4-5];如果选择性清除T reg,则致瘤敏感性和肿瘤转移率与正常鼠无差异;同样Treg数量增加可以加快移植瘤生长速度,降低胃癌细胞凋亡,说明Treg在体内也能抑制机体对肿瘤的杀伤活性[6]。上述现象表明,Treg能通过不同机制抑制一系列免疫反应,促使肿瘤细胞免疫耐受、逃逸,其机制可能涉及以下几个方面:TCR信号所激活的Treg能够抑制 CD4+CD25-和CD8+T细胞活化、增殖,并且这种抑制作用为非抗原特异性[7];Treg具有抑制NK细胞增殖、细胞因子分泌和细胞毒作用,以及对单核/巨噬细胞、树突状细胞、B细胞等免疫活性细胞起抑制或杀伤作用[8-9];Treg通过分泌IL-10、TGF-β等抑制性细胞因子和细胞接触依赖的抑制途径,抑制免疫效应细胞功能等[10];而封闭Treg功能后,免疫活性细胞的活性得以释放,且杀伤活性明显增强,同时,Treg分泌的抑制性细胞因子表达下调[11-12]。
本研究结果显示胃癌组织内Treg分布数量明显高于对照组。同时,通过免疫细胞磁珠分选出高纯度 Treg,经体外PMA和艾罗霉素刺激活化后产生多种细胞因子(如IL-10、TGF-β等),同时用蛋白质转运抑制剂——莫能星抑制细胞分泌细胞因子至胞外,使其在胞内高尔基体积聚,以利于细胞因子的检测。本研究还发现CD4+CD25+IL-10+T细胞、CD4+CD25+TGF-β+T细胞数量在胃癌组中明显增加,说明活化后的T reg可通过分泌IL-10和TGF-β来抑制Th1介导的免疫反应、Th2介导的抗体产生以及CD8+细胞毒性T细胞的活化[13]。IL-10可通过直接和间接机制明显降低抗原特异性T细胞增殖。IL-10对T细胞的直接作用包括抑制IL-2的产生以及延长细胞增殖周期等;间接机制包括下调单核细胞CD80、CD86以及CD28的配体表达和有效抑制IL-12的产生,而IL-12是TH1细胞分化的关键因子;此外,IL-10还可阻止T细胞受体介导的CD4+T细胞活化。TGF-β家族成员也是维系Treg数量和功能的重要因子[14];它还能诱导表达Foxp3,使外周CD4+CD25+初始 T细胞转变为 T reg[15];有研究表明,TGF-β家族成员可以通过剂量依赖方式,在体内外促进Treg转化为CD4+CD25+Foxp3T细胞,后者被认为是真正起作用的Treg,从而实现对T reg的反馈调节作用[16-17]。TGF-β也可通过抑制免疫效应细胞的增殖、分化以及抑制细胞因子的产生而发挥作用。由此可知,Treg在胃癌中通过分泌抑制性因子等,使胃癌细胞从机体抗肿瘤免疫反应体系中逃逸,从而促进胃癌的形成与发展。
[1]Sakaguchi S,Sakaguchi N.Regulatory T cells in immunologic self-tolerance and autoimmune disease[J].Int Rev Immunol,2005,24(3~4):211.
[2]Beyer M,Schultze JL.Regulatory T cells in cancer[J].Blood,2006,108(3):804.
[3]Ohmura Y,Yoshikawa K,Saga S,et a1.Combinations of tumor-specific CD8+CTLs and anti-CD25 mAb provide improved immunotherapy[J].Oncol Rep,2008,19(5):1265.
[4]Zaccone P,Burton O,Miller N,et a1.Schistosoma mansoni egg antigens induce Treg that participate in diabetes prevention in NOD mice[J].Eur J Immunol,2009,39(4):1098.
[5]Nishikawa H,Kato T,Tawara I,et a1.Accelerated chemically induced tumor development mediated by CD4+CD25+regulatory T cells in wild-type hosts[J].Proc Natl Acad Sci USA,2005,102(26):9253.
[6]曾冬竹,余佩武,雷晓,等.CD4+CD25+调控T细胞对小鼠胃癌的影响[J].中华胃肠外科杂志,2007,10(4):368.
[7]Thornton AM,Piccirillo CA,Shevach EM.ActⅣation requirements for the induction of CD4+CD25+T cell suppressor function[J].Eur J Immunol,2004,34(2):366.
[8]Banerjee DK,Dhodapkar MV,Matayeva E,et a1.Expansion of FOXP3 high regulatory T cells by human dendritic cells(DCs)in vitro and after injection of cytokine-matured DCs in myeloma patients[J].Blood,2006,108(8):2655.
[9]Larmonier N,Marron M,Zeng Y,et a1.Tumor-derived CD4(+)CD25(+)regulatory T cell suppression of dendritic cell function involves TGF-beta and IL-10[J].Cancer Immunol Immunother,2007,56(1):48.
[10]Shevach EM,Dipaolo RA,Andersson J,et a1.The lifestyle of naturally occurring CD4+CD25+Foxp3+regulatory T cells[J].Immunol Rev,2006,212:60.
[11]杨晓鲲,郑峻松,张新,等.GITR抗体介导增强NK细胞杀伤活性的实验研究[J].重庆医学,2006,35(18):1649.
[12]Smyth MJ,Teng MW,Swann J,et al.CD4+CD25+T regulatory cells suppress NK cell-mediated immunotherapy of cancer[J].J Immunol,2006,176(3):1582.
[13]Nakamura K,Kitani A,Fuss I,et al.TGF-beta1 plays an important role in the mechanism of CD4+CD25+regulatory T cell activity in both humans and mice[J].J Immunol,2004,172(2):834.
[14]Tonkin DR,Haskins K.Regulatory T cells enter the pancreas during suppression of type 1 diabetes and inhibit effector T cells and macrophages in a TGF-beta-dependent manner[J].Eur Immunol,2009,39(5):1313.
[15]Shevach EM,Davidson TS,Huter EN,et al.Role of TGFBeta in the induction of Foxp3 expression and T regulatory cell function[J].J Clin Immunol,2008,28(6):640.
[16]Huber S,Stahl FR,Schrader J,et al.Activin a promotes the TGF-beta-induced conversion of CD4+CD25-T cells into Foxp3+induced regulatory T cells[J].J Immunol,2009,182(8):4633.
[17]Moo-Young TA,Larson JW,Belt BA,et al.Tumor-derived TGF-beta mediates conversion of CD4+Foxp3+regulatory T cells in a murine model of pancreas cancer[J].J Immunother,2009,32(1):12.



