郑 超,吴海涛,孙晓川△
(1.重庆市江北区第一人民医院神经外科 400020;2.重庆医科大学附属第一医院神经外科 400016)
小胶质细胞NF-κ B与AQP4协同表达的研究
郑 超1,吴海涛2,孙晓川2△
(1.重庆市江北区第一人民医院神经外科 400020;2.重庆医科大学附属第一医院神经外科 400016)
目的观察原代培养的小胶质细胞划痕损伤后NF-κ B与水通道蛋白质4(AQP4)表达的相关性。方法 原代培养小胶质细胞,用免疫细胞化学鉴定其特异性表面标记物巨噬细胞分化抗原-1(Mac-1)抗体。采用划痕致伤构建细胞损伤模型。于伤后12 h及1、3、5、7 d用RT-PCR检测 NF-κ B mRNA 的表达,Western blot检测AQP4蛋白的表达。结果伤后 12 h,NF-κ B、AQP4表达不显着,1 d时表达达高峰,后逐渐降低,5、7 d时几乎无表达。结论致伤后,NF-κ B与AQP4的表达具有协同性,炎症反应在创伤后脑水肿的发生、发展中发挥了重要作用。
小神经胶质细胞;NF-κ B;水通道蛋白质4;协同表达
创伤性脑水肿是创伤性脑损伤(traumatic brain injury,TBI)后主要的继发性病理改变之一,也是导致颅内压增高和伤者死亡的主要原因。近年来,水通道蛋白4(aquaporin 4,AQP4)与创伤性脑水肿的相关性逐渐引起人们重视。另有研究[1]表明,TBI急性期的炎症反应加重了脑组织水肿,介导了继发性的组织损伤。本实验拟从介导炎症反应重要的转录因子——核因子-κ B(NF-κ B)与AQP4的协同表达进行初步探讨。
1 材料与方法
1.1 小胶质细胞的原代培养 取出生2 d内的sprague-dawley乳鼠4只(购自北京大学医学部),按McCarthy和 De Vellis[2]创立的区别接种技术,分离纯化小胶质细胞,并对其特异性表明标志物巨噬细胞分化抗原-1(Mac-1)抗体进行检测。
1.2 细胞划痕损伤模型的建立 参照文献[3]的方法,将纯化的小胶质细胞计数达3×106~4×106后,以细小的微量移液器塑料滴头于各培养孔内划伤培养小胶质细胞,划伤长度为20 mm,划伤间距为3~4 mm,四横四竖共八条划痕,每孔划伤位置尽量保持一致,划伤宽度约1 mm。
1.3 半定量RT-PCR检测NF-κ B mRNA的表达 分别在伤后12 h及1、3、5、7 d向细胞培养板中加入 TaKaRa RNAiso Reagent,反转录至cDNA;查阅Genebank,设计NF-κ B引物序列如下:上游引物 5′-TGT CAC TCA GGC TCT TCA CCC A-3′,下游引物 5′-TAG GCT CCC GTA TGC CCT CAC C-3′,使用Taq Mix(广州东盛公司),PCR扩增,片段长度350 bp;GAPDH 上游 引物 序列 5′-TGA TGA CAT CAA GAA GGT GGT GAA-3′,下游引物序列 5′-TCC TTG GAG GCC ATG TAG GCC AT-3′,片段长度 249 bp;取 PCR扩增产物 5 μ L,1%琼脂糖凝胶电泳,运用凝胶成像系统(美国Bio-Rad公司)成像并进行分析,结果以NF-κ B/GAPDH吸光度比值表示。
1.4 Western blot检测AQP4蛋白的表达 分别在伤后12 h及1、3、5、7 d向细胞培养板中滴加细胞裂解液(购自上海生工),冰浴匀浆,离心取上清液;用 BCA法定量蛋白浓度,取 30 μ g上样于SDS-PAGE中电泳2 h,转移到PVDF膜,室温封闭2 h;加入AQP4多克隆抗体(购自武汉博士德,1∶200),4℃过夜,加入HRP标记的二抗(1∶4 000),室温孵育1 h,加ECL试剂显色;采用 4.1版本 Quantity one软件(美国 Bio-Rad公司)分析各条带面积灰度值,β-action表达水平为内参照。
2 结 果
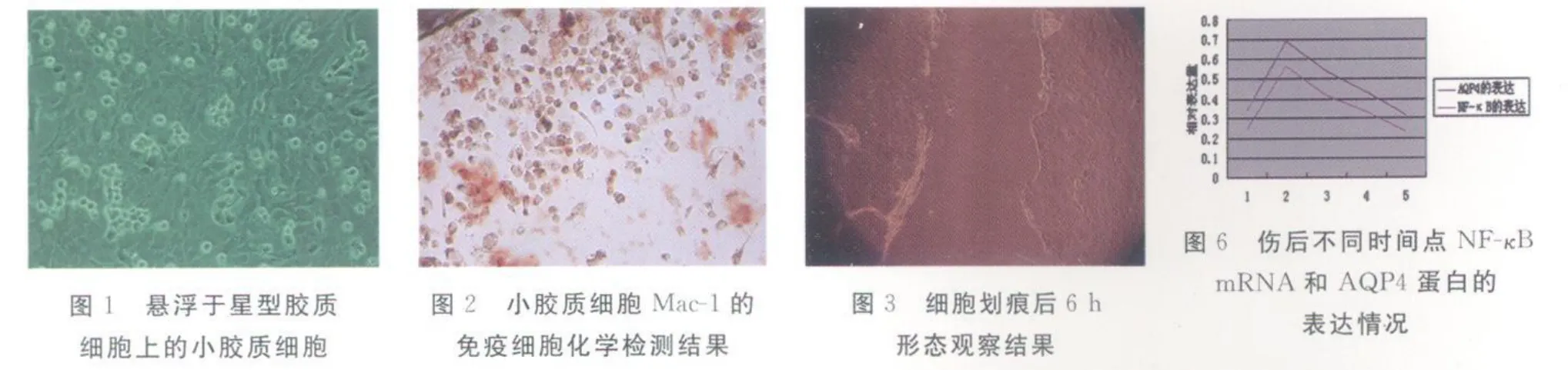
2.1 小胶质细胞的分离、培养、鉴定结果 通过小胶质细胞原代培养,纯化后的细胞纯度达95%以上。倒置显微镜进行形态学观察及免疫细胞化学方法观察其特异性化学标志物Mac-1抗体,均确认为小胶质细胞无误,见封3图1~3。
2.2 伤后小胶质细胞NF-κ B mRNA表达的变化 伤后12 h NF-κ B表达不明显,1 d时表达水平达到最高峰,3 d时表达量逐渐回落,5、7 d几乎无表达,见图4。
2.3 伤后AQP4蛋白表达的变化 伤后12 h APQ4蛋白表达不明显,1 d时表达水平达高峰,从第3天开始,表达量逐渐回落,见图5。

图4 小胶质细胞NF-κ B mRNA表达的检测结果
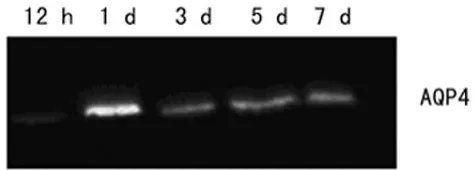
图5 小胶质细胞AQP4蛋白表达的检测结果
2.4 伤后不同时间点小胶质细胞NF-κ B mRNA和AQP4蛋白表达的相关性 伤后12 h及1、3、5、7 d NF-κ B mRNA 和AQP4蛋白表达变化趋势相同,两者具有明显的相关性,见封3图6。
3 讨 论
AQP4是分布在脑组织的主要水通道蛋白,具有选择性水转逆功能[4]。Gresz等[5]研究结果显示,AQP4 mRNA在胶原纤维酸性蛋白(GFAP)免疫活性阴性及阳性细胞上都有表达,提示小胶质细胞也可能表达少量AQP4。AQP4通常以四聚体的形式发挥生物学效应,具有高速转运水的能力,比其他AQPs对水的通透性高3~4倍。
TBI后中枢神经系统(CNS)的细胞释放具有神经毒性的内源性炎症因子,引发继发性炎症反应,可促进脑水肿的发生。颅内创伤性炎症反应过程包括细胞因子的活化,补体系统的激活,趋化因子、黏附分子的分泌和白细胞聚集等。Schuhmann等[6]研究鼠皮质冲击伤后脑脊液白三烯与脑水肿、脑细胞炎症反应的关系,发现白三烯B4(LTB4)的变化与白细胞侵入的时间过程相一致,提示 LTB4与细胞毒性水肿密切相关。Lu等[7]观察到鼠闭合性头外伤后广泛的小胶质细胞表面抗原上调,包括补体3受体(CR3)和主要组织相容性复合物(MHC)Ⅱ级抗原,以及星型细胞免疫反应增强伴血-脑屏障(BBB)的破坏。Whalen等[8]发现细胞间黏附分子-1(ICAM-1)和血小板选择素的同时缺失可以显着减轻创伤后脑水肿,但没有改善伤后脑功能,黏附分子在脑水肿产生机制中的作用似乎不依赖于脑内白细胞的聚集。
TBI可导致死亡或残疾,但临床上对于TBI的治疗及控制的方法却很有限[9]。近年来随着对TBI后脑水肿发病机制的深入研究,炎性细胞因子在 TBI中的作用成为研究热点。目前炎性细胞因子已发展成为一个家族,它包括白细胞介素(ILs)、肿瘤坏死因子(TNF)、干扰素(INF)、生长因子(GFs)、化学趋化因子等,其中与脑水肿关系最密切的包括IL-lβ、TNF-α。小胶质细胞是脑内参与炎症反应的主要免疫细胞[10],细胞因子在正常情况下不能通过BBB,但在脑损伤时BBB往往被破坏,同时细胞因子也可直接损害BBB,并且它还可通过饱和转运机制进入脑内[11]。TBI后早期,BBB通透性的增加是参与脑水肿形成的重要因素。炎性细胞因子可通过被破坏的BBB或直接破坏BBB,使其通透性增加,直接或间接作用于神经细胞和神经胶质细胞,诱发其分泌更多的细胞因子或使其表面表达更多的细胞因子受体,引起脑细胞肿胀,释放各种神经毒性因子(如氧自由基),从而加重BBB的破坏和细胞膜的损伤,产生和加重血管源性及细胞毒性脑水肿。
NF-κ B是由两个蛋白亚基(p50和 p65)组成的二聚体,在胞浆中还有一种相对分子质量为36 000~37 000的蛋白,对NF-κ B具有抑制作用,成为 I-κ B(inhibitory kappa B,I-κ B)。I-κ b与 NF-κ B结合成三聚体。有研究显示 NF-κ B广泛参与炎症介质和前炎症介质、黏附分子、趋化因子和一些炎性相关酶类等基因的调控[12]。正常时,一般处于静止状态,当受到某些理化刺激时,通过特定的蛋白激酶,使 I-κ B磷酸化后降解,NF-κ B得以激活,NF-κ B活化后诱导多种炎性因子,进而编码相应产物。在这些 NF-κ B的诱导物中,促炎因子 IL-1β和 TNF-α反过来又能直接刺激 NF-κ B,形成正反馈环。
本实验以小胶质细胞为研究对象。小胶质细胞是定居脑内的巨噬细胞,数量约占脑内胶质细胞总数的4%~10%。最近的一项研究表明,神经毒性物质,例如β-淀粉样前体蛋白(βamyloid precursor protein,APP)通过募集酪氨酸激酶和丝裂原活化蛋白激酶(mitogen-activeted protein kinase,MAPK)介导原代小胶质细胞和一种单核细胞系的促炎症激活[13]。据报道,直接损伤可诱导小胶质细胞的活化、增生和肥大[14];由于活化的神经胶质细胞产生细胞因子,后者又进一步刺激胶质细胞增生,因此两者形成一种恶性循环[15]。
本实验观察到NF-κ B和AQP4的表达时相基本吻合,且表达高峰时相为伤后 1、3 d,这与临床上TBI后脑水肿第一个高峰时相即伤后24 h是吻合的。推测NF-κ B这一核转录因子在伤后的表达促进了AQP4的协调表达,共同促进TBI后脑水肿的发生。这一发现,也为临床通过抑制NF-κ B而减轻脑水肿提出了依据,但仍需要做进一步的基础和临床研究。
[1] Nimmo AJ,Cernak I,Heath DL,et al.Neurogenic inflammation after human brain contusion[J].Neurosurgery,1998,42:291-298.
[2] McCarthy KD,De Vellis J.Preparation of separate astroglial and oligodendroglia cell cultures from rat cerebral tissue[J].J Cell Biol,1980,85(3):890-902.
[3] 黄卫东,费舟,章翔,等.体外培养大鼠脑皮层神经元机械性损伤模型的建立[J].第四军医大学学报,2004,25(4):307-309.
[4] 黄敏东.创伤性脑水肿的分子机制[J].广东医学,2007,28(1):161-162.
[5] Gresz V,Kwon TH,Hurley P,et al.Identification and location of aquaporin water channels in hunman salirary glands[J].American Jouanal Physiology,2001,281(1):247-254.
[6] Schuhmann MU,M kohtarzadeh M,Stichtenoth DO,et al.Temporal profiles of cerebrospinal fluid leukotrienes,brain edema and inflammatory response following experimental brain injury[J].J Neurol Res,2003,25(5):481-491.
[7] Lu J,M oochhala S,Kaur C,et al.Cellular inflammatory response associated with breakdown of the blood-brain barrier after closed head injury in rats[J].J Neurotrauma,2001,8(4):399-408.
[8] Whalen MJ,Carlos TM,Dixon CE,et al.Reduced brain edema after traumatic brain injury in mice deficient in Pselection and intercellular adhesion molecule[J].J Leukoc Biol,2000,67(2):160-168.
[9] 杨叶猗.水通道蛋白 4与脑水肿的研究进展[J].中国医药导报,2008,5(6):21-22.
[10]陈实,朱刚.缺氧对小鼠小胶质细胞IRA K21表达的影响[J].重庆医学,2008,37(11):1186-1188.
[11]耿艺,刘荣耀,王健,等.水通道蛋白4在创伤性脑水肿中的表达及其对血脑屏障通透性的影响[J].中华临床医师杂志,2009,3(5):762-770.
[12] 罗真春,黄燕,秦开秀,等.核转录因子-κ B在急性肺损伤小鼠中的动态表达[J].重庆医学,2009,38(16):2005-2006.
[13]Snodag CM,Combs CK.Amyloid precursor protein mediates proinflammatory activation of monocytic lineage cells[J].J Biol Chem,2004,279:14456-14463.
[14]Perry WH,Gordon S.Macrophages and the nervous system[J].Int Rev Cytol,1991,125:203-244.
[15]Barone FC,Feuerstein GZ.Inflammatory mediators and stroke:new opportunities for novel therapeutics[J].J Cereb Blood Flow Metab,1999,19:819-834.
The study of coordinate expression of NF-κ B and AQP4 on microglial cells postinjury
ObjectiveTo investigate the coordinate expression of NF-κ B and AQP4 on microglial cells postinjury.MethodsMicroglial cells were removed from 1-day-old newborn rat the cultured in vitro,Mac-1 was identified with immunocytochemistry method.Cell injury model was constructed by scrarification.On the time point 12 h and 1,3,5,7 d after injury,the expression of NF-κ B mRNA was detected by RT-PCR.On the same time point the expression of AQP4 was detected with Western blot.Results12 h after injury,the expression of NF-κ B could hardly be observed.The maximal expression of NF-κ B was detected at 1 d postinjury.Afterwards,it declined gradually.The expression of AQP4 was analogous to NF-κ B.ConclusionThe expression of NF-κ B and AQP4 is of coordination,which indicats that traumatic inflammatory response contributes to cerebral edema posttrauma.
microglial;NF-kappa;Aquaproin4;coordinate expression
10.3969/j.issn.1671-8348.2011.01.012
A
1671-8348(2011)01-0030-02
△通讯作者,电话:(023)89011151;E-mail:sunxch1445@gmail.com。
2010-01-14
2010-06-23)
•调查报告•



