张司兰,谭朝阳,陈世伟,韩 威
(1.重庆市璧山县人民医院心血管内科 402760;2.成都医学院医学检验系实验中心 610083)
低压缺氧对兔动脉粥样硬化斑块中HIF-1α、VEGF及MMP-9表达的影响
张司兰1,谭朝阳1,陈世伟1,韩 威2
(1.重庆市璧山县人民医院心血管内科 402760;2.成都医学院医学检验系实验中心 610083)
目的观察低压缺氧对兔动脉粥样硬化斑块低氧诱导因子-1α(HIF-1α)、血管内皮生长因子(VEGF)及基质金属蛋白酶-9(MMP-9)表达的影响。方法将日本大耳兔随机分为常氧对照组和低压缺氧组,高胆固醇饮食12周建立兔动脉粥样硬化(atherosclerosis,AS)病变模型后,取主动脉内膜组织分别采用免疫组织化学方法和real-time PCR检测斑块组织中 HIF-1α、VEGF、MMP-9蛋白和mRNA表达。结果低压缺氧组高斑块中HIF-1α、VEGF、MMP-9蛋白和mRNA的表达明显升高,与常氧对照组比较,差异有统计学意义(P<0.05)。结论低压缺氧能明显升高斑块中 HIF-1α、VEGF、M MP-9蛋白和mRNA表达,可降低兔动脉粥样硬化斑块的稳定性。
动脉粥样硬化;缺氧诱导因子1,α亚基;血管内皮生长因子;基质金属蛋白酶-9
随着人们物质生活水平的提高,心血管疾病的发病率已名列各种疾病之首。据预测,2020年全球范围内因心血管疾病造成的死亡有可能达到总死亡数的36%,从而在人类历史上心血管疾病将首次成为第1位的致死原因[1]。其中,动脉粥样硬化(atherosclerosis,AS)及其并发症是多种心脑血管疾病的主要病理基础和共同病理过程。特别是动脉粥样硬化斑块破裂后产生的一系列并发症,如心、脑血管栓塞等,严重威胁患者的生命安全。血管内皮生长因子(VEGF)和基质金属蛋白酶能降低AS斑块稳定性[2]。本研究拟探讨低压缺氧对兔动脉粥样硬化斑块中低氧诱导因子-1α(HIF-1α)、VEGF及基质金属蛋白酶-9(MM P-9)表达的影响,为进一步研究低压缺氧与AS斑块稳定性的关系奠定基础。
1 材料与方法
1.1 实验动物 日本大耳兔(SPF级)10只[雄性,体质量(2.0±0.2)kg]由第三军医大学实验动物中心提供,许可证号为 SYXK(军)2002-029。
1.2 试剂 小鼠抗兔HIF-1α、VEGF及MM P-9一抗为美国Santa公司产品,山羊抗小鼠二抗、DAB试剂盒为北京中杉金桥生物技术公司产品,TRIzol为德国 Roche公司产品,RNasin为Takara公司产品,逆转录试剂盒、荧光定量Real-time PCR试剂盒为上海东洋坊科技有限公司产品。
1.3 仪器 紫外分光光度计(上海亚研公司)、MiniBISTM凝胶成像系统(美国 Labnet公司)、Light CyclerⅡ型实时荧光定量基因扩增系统(德国 Roche公司)等。
1.4 实验分组 将10只日本大耳兔随机分为常氧对照组和低压缺氧组。(1)常氧对照组 5只:高胆固醇饲料(含 1%胆固醇、8%猪油和7.5%蛋黄粉的粗颗粒饲料)150 g/d喂养12周。(2)低压缺氧组5只:高胆固醇饲料150 g/d喂养12周,低压缺氧实验参照Fagan[3]的方法并加以改进。压缩空气与混合气体(90%N2+10%O2)在电磁阀控制下分别以2 L/min的流速输入低氧舱,间隔 30 s,1 min为1个循环,每天 8 h,其余时间置饲养笼,室温、空气、正常摄食、水。低压缺氧实验过程中舱内混合气体浓度由测氧仪检测,并随机采样送气体成分分析。常氧对照组每日同时置相同规格有机玻璃舱内,空气输入,无缺氧。各组实验结束当日取标本。
1.5 免疫组织化学法 主动脉经4%中性甲醛固定后,石蜡切片进行免疫组织化学法测定HIF-1α、VEGF和 MMP-9表达(SP法,阴性对照一抗用磷酸盐缓冲液代替)。显微镜下拍照后用Image Pro Plus4.5软件进行图像分析,测定阳性物质的表达面积和积分光密度[4]。
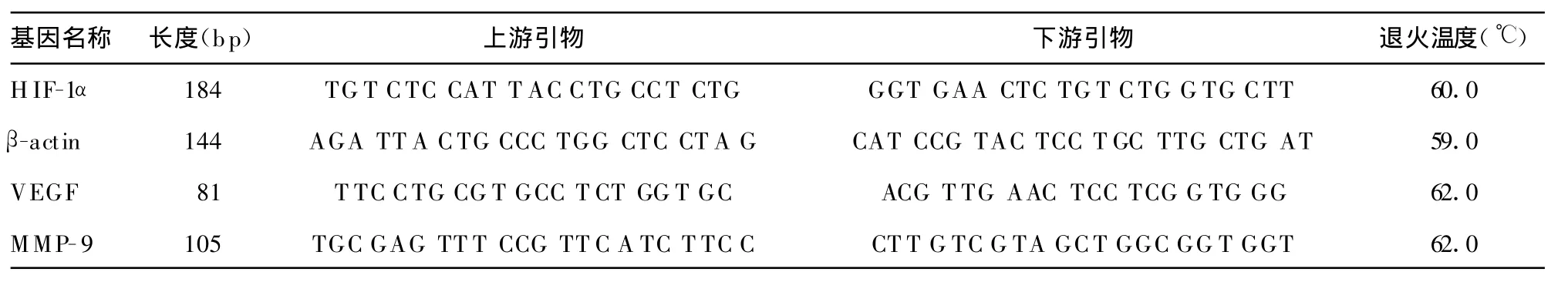
表1 引物序列
表2 低压缺氧对斑块中HIF-1α、VEGF及MM P-9 mRNA表达的影响( ±s)

表2 低压缺氧对斑块中HIF-1α、VEGF及MM P-9 mRNA表达的影响( ±s)
*:P<0.05,与常氧对照组比较。
组别 HIF-1αmRNA/β-actin mRNA VEGF mRNA/β-actin mRNA M MP-9 mRNA/β-actin mRNA常氧对照组 0.026±0.004 1 0.029±0.000 5 0.096±0.018低压缺氧组 0.038±0.005 2* 0.048±0.009 3* 0.130±0.021*
表 3 低压缺氧对斑块中HIF-1α、VEGF及MMP-9蛋白表达的影响( ±s)

表 3 低压缺氧对斑块中HIF-1α、VEGF及MMP-9蛋白表达的影响( ±s)
*:P<0.05,与常氧对照组比较。
HIF-1α蛋白组别VEGF蛋白MMP-9蛋白表达面积(×103/μ m2) 积分光密度(×106)表达面积(×103/μ m2) 积分光密度(×106)表达面积(×103/μ m2) 积分光密度(×106)常氧对照组 9.16±1.52 16.85±2.93 25.85±4.23 12.36±3.08 49.62±7.10 58.33±6.09低压缺氧组 12.42±2.04* 21.55±4.01* 32.59±5.49* 15.72±3.41* 61.81±8.29* 73.92±9.24*
1.6 real-time PCR检测 从血管内膜上刮取约30 mg粥样组织,置于研磨钵中加入液氮研磨。匀浆移入1.5 mL EP管中,加入1 mL TRIzol,用加样枪吹打混匀,室温静置 5 min。加入0.2 mL氯仿,摇匀,室温下静置15 min。4℃、10 000×g离心15 min,将上层水相转移至新的离心管,加入等体积的异丙醇,摇匀,室温下静置10 min后,4℃、10 000×g离心 10 min,弃上清液,用75%乙醇清洗2次,将RNA沉淀晾干,用20 μ L无RNA酶去离子水溶解,―70℃保存待用。逆转录反应按试剂盒说明书进行。荧光定量聚合酶链反应:1 μ L cDNA样本作为PCR扩增模板,阴性对照扩增模板为去离子水。扩增条件为94℃5 min,1个循环;94℃30 s、72℃20 s,35个循环;72℃延伸10 min。采用premier5.0软件设计引物,见表 1,由上海生物工程公司合成。
2 结 果
2.1 低压缺氧对斑块中 HIF-1α、VEGF及MMP-9 mRNA的影响 低压缺氧明显升高了斑块中 HIF-1α、VEGF及M MP-9 mRNA的表达,分别为 46.15%、65.52%及45.83%(P<0.05),见表 2。
2.2 低压缺氧对斑块中 HIF-1α、VEGF及 MMP-9蛋白表达的影响 低压缺氧明显升高了斑块中 HIF-1α、VEGF及MMP-9蛋白的表达面积和积分光密度,与常氧对照组比较,差异有统计学意义(P<0.05),见表 3。
3 讨 论
VEGF可由内皮细胞、巨噬细胞、成纤维细胞和平滑肌细胞等多种细胞产生,正常组织中VEGF表达不明显,其表达增加可能是机体对不同刺激的反应受病理生理学状态、代谢产物和细胞因子等多种因素的调控[4],有多种生物学活性,如促进血管内皮细胞增殖和血管新生、促进多种血管活性物质合成、促进血管舒张、抑制血栓形成等,其中促进血管内皮细胞增殖作用具有高度特异性,是迄今为止发现的惟一一种血管内皮细胞特异性有丝分裂原。急性冠状动脉综合征(ACS)主要是由不稳定性AS斑块破裂而继发血栓形成所致,VEGF可能在这一过程中起重要的作用。VEGF可使AS斑块内膜微血管新生,新生的血管也可引起血浆渗出、斑块内出血和血栓形成,加速AS斑块生长、斑块重构及斑块破裂[5-6],从而引起ACS的发生。
AS斑块内的金属基质蛋白酶(M MPs)主要来源于中性白细胞和巨噬细胞,M MPs的活性很大程度上决定了纤维帽厚度及其胶原含量,斑块中的MMPs能有效降解纤维帽的强度。有研究证明,MM P-2和MMP-9在不稳定性斑块,特别是易发生破裂的斑块肩部区域合成和活性明显增加,过度分泌的MMP-2和M MP-9,通过降解纤维帽内的胶原,促进动脉粥样硬化斑块的破裂[7-8]。
HIF-1α在正常氧分压时极不稳定,易被泛素依赖的蛋白水解酶降解。在缺氧、癌基因的激活、抑癌基因的失活、生长因子等因素的刺激作用下,细胞中的HIF-1α稳定,使组织细胞对缺氧产生适应性调节[9-11]。HIF-1α是广泛存在于哺乳动物和人体内的一种转录因子,它可调节多种靶基因,如 VEGF、红细胞生成素(erythropoietin,Epo)等的表达,其活性在维持肿瘤细胞的能量代谢、新生血管形成,以及促进肿瘤增殖和转移中起重要作用[12-13]。有研究表明,HIF-1α和MMP-9在胃癌组织中阳性表达率呈正相关[14-15]。
本研究结果显示,在低压缺氧状态下,兔 AS斑块中的HIF-1α表达增加,VEGF与MM P-9的表达也增加。VEGF与MMP-9表达的增加则表明斑块的稳定性降低,提示在低压缺氧状态下,AS斑块的稳定性下降,其机制可能与低压缺氧状态下斑块内HIF-1α表达增加有关。
[1]Brauwald E,Shttuck.Lecture-cardiovascular medicine at the turn of the millennium triumpH,concerns and opportunities[J].N Engl J Med,1997,337(19):1360-1369.
[2]Celletti FL,Hilfiker PR,Ghafouri P,et al.Binant vascular endothelial growth factor 165 on progression of atherosclerotic plaque[J].J Am Coll Cardiol,2001,37(8):2126-2130.
[3]Fagan KA.Selected Contribution:pulmonary hypertension in mice following intermittent hypoxia[J].J Appl Physiol,2001,90(6):2502-2507.
[4]Saint Geniez M,M aharaj AS,Walshe TE,et al.Endogenous VEGF is required for visual function:evidence for a survival role on muller cells and photoreceptors[J].PLo S ONE,2008,3(11):e3554.
[5]Testa U,Pannitteri G,Condorelli GL,et al.Vascular endothelial growth factors in cardiovascular medicine[J].J Cardiovasc Med,2008,9(12):1190-1221.
[6]黄山,许健,令狐颖,等.流式细胞术检测 VEGF在急性冠状动脉综合征诊断中的应用[J].实用心脑肺血管病杂志,2010,18(10):1420-1422.
[7]Ii H,Hontani N,Toshida I,et al.Group IVA phospholipase A2-associated production of MMP-9 in macrophages and formation of atherosclerotic lesions[J].Biol Pharm Bull,2008,31(3):363-368.
[8]陈力量,王守力.急性冠脉综合征患者血清基质金属蛋白酶-2、基质金属蛋白酶-9水平及其临床意义[J].安徽医学,2010,31(9):1087-1090.
[9]马雅銮,宋剑南.缺氧诱导因子:一种缺氧条件下被激活的转录因子[J].中国动脉硬化杂志,2007,15(7):528.
[10]赵吉清,吴强,蔡颖,等.缺氧对PC12细胞 HIF-1/JAK2/NF-KB信号级联的影响[J].重庆医学,2009,38(5):536-538.
[11]唐利群,周国平.低氧诱导因子1α对钾-氯协同转运子1启动子调控作用的研究[J].实用医学杂志,2010,26(18):3282-3284.
[12]Shui YB,Arbeit JM,Johnson RS,et al.HIF-1:an age-dependent regulator of lens cell proliferation[J].Invest Ophthalmol Vis Sci,2008,49(11):4961-4970.
[13]曹桂明,杨梅.VEGF-C和VEGFR-3对乳腺癌淋巴管生成和淋巴结转移的影响[J].中国肿瘤临床,2006,33(6):310-313.
[14]张辉,黄江梅,陈艳昕,等.胃癌组织中 HIF-1α和 MMP-9的表达及意义[J].山东医药,2008,48(15):81-82.
[15]常静,薛歆,刘爱中,等.MM P-2和 MM P-9在胃癌患者组织和血清中的表达及临床意义[J].中国实验诊断学,2010,14(3):394-397.
Effects of periodicity hypoxia on contents of HIF-1α,VEGF and MMP-9 in rabbit atherosclerotic plaques
Zhang Silan1,Tan Zhaoyang1,Chen Shiwei1,Han Wei2
(1.Department of Cardivascular Internal Medicine,Bisan People′s Hospital of Chongqing,Chongqing 402760,China;2.Experimental Center,Department of Medical Laboratory,Chengdu Medical College,Sichun 610083,China)
ObjectiveTo observe effects of periodicity hypoxia on contents of hypoxia inducible factor-1(HIF-1α),vascular endothelial growth factor(VEGF)and matrix metalloproteinase-9(MM P-9)in atherosclerotic plaques.MethodsRabbit atherosclerotic models were set up by hypercholesterolemia diet.Contents of HIF-1α,VEGF and MMP-9 protein and mRNA in plaque were detected by immunohistochemistry and Real-time PCR methods,respectively.ResultsIn periodicity hypoxia groups,HIF-1α,VEGF and MMP-9 protein and mRNA in atherosclerotic plaques were increased markedly.ConclusionPeriodicity hypoxia could increase contents of HIF-1α,VEGF and MM P-9 protein and mRNA in rabbit atherosclerotic plaques.This maybe decreased stability of atherosclerotic plaques.
atherosclerosis;hypoxia-inducible factor 1,alpha subunit;vascular endothelial growth factor;matrix metalloproteinase-9
10.3969/j.issn.1671-8348.2011.06.008
A
1671-8348(2011)06-0542-03
2010-08-25
2010-11-25)
·调查报告·



