王剑华,周庭永,吕发金,张本斯,王 勇,张 慧,许 伟
(1.大理学院解剖学教研室,云南大理 671000;2.重庆医科大学解剖学教研室 400016;3.重庆医科大学附属第一医院放射科 400016)
直接性肝内门腔分流术(direct intrahepatic portacaval shunt,DIPS)是在肝后下腔静脉与门静脉之间建立肝内分流,将部分门静脉血液直接分流入粗大的下腔静脉。它扩大了介入性门腔分流的适应证,可使部分难以进行经颈静脉肝内门腔分流术(transjugu lar intrahepatic portosystem ic shunt,TIPS)的患者也能接受介入性门腔分流[1-2],并成为介入性门腔分流的新热点[3-4]。而如何进一步提高DIPS穿刺准确性,减少肝内胆管损伤将成为今后的研究方向[5]。现利用64层容积CT(64-slice vo lume CT,64-VCT)对 DIPS术中穿刺定位进行探讨。
1 资料与方法
1.1 一般资料 选择因各种原因在重庆医科大学附属第一医院放射科行上腹部64-VCT扫描检查的60例患者,其中男26例,女34例;年龄 81~21岁。将其分为非肝病组(n=43,非肝病患者)与肝硬化组(n=17,肝硬化患者)。非肝病组纳入标准:无严重心、肝、肺疾病,肝功能正常,肝脏单发小囊肿直径不超过2 cm,肾功能正常,能持续屏气6~8 s,并能反复屏气;精神无异常。肝硬化组纳入标准:无严重心、肺疾病,肾功能尚可,无其它严重内科疾病;临床确诊为肝硬化或肝脏平扫具有肝硬化影像学表现,而肝脏无囊肿等占位性病变;临床资料完整,能进行肝功能Child-Pugh分级。上述患者均碘过敏试验阴性,上腹部无外伤或手术史,签署增强扫描知情同意书。
1.2 检查设备及材料 采用美国GE公司64-VCT扫描仪(Light Speed VCT),日本Nemoto双筒CT专用高压注射器进行检查操作,并将所得数据在GE ADW 4.2工作站进行图像处理。用高压注射器经右肘正中静脉注射对比剂碘普罗胺注射液(370 mg/m L),注射总量为 90~100 m L,注射速率为 3~4 m L/s。
1.3 CT平扫及增强扫描参数 全视野轴位螺旋式扫描,旋转速度为每转0.5 s,Pitch值为0.984,X线管每旋转1周沿Z轴方向覆盖范围为 40 mm,电压120 kV,电流 300~350 m A,实时显示的轴位图像重建层厚和层间距均为5mm。扫描图像矩阵为512×512。所有被检查者均使用智能追踪技术(Smart Prep)启动肝动脉期(hepatic arterial phase,HAP)扫描。肝门静脉和肝静脉期扫描间隔时间为35~40 s。
1.4 测量表示方法 (1)以肝后下腔静脉上、下边界为基准,通过上、下等分线将其3等分;(2)连接2条等分线与肝后下腔静脉前壁交汇处到门静脉左、右支1、2 cm间的模拟穿刺途径;(3)分别测量模拟穿刺途径与肝后下腔静脉间的顺行角度(经股静脉穿刺途径)与逆行角度(经颈内静脉穿刺途径);(4)分别测量模拟穿刺途径与门静脉左、右支间的角度;(5)分别测量肝后下腔静脉上、下等分线穿刺点的入口角度,门静脉穿刺点的出口角度。
表1 非肝病组与肝硬化组模拟穿刺途径的入口顺、逆行角度(±s,度)
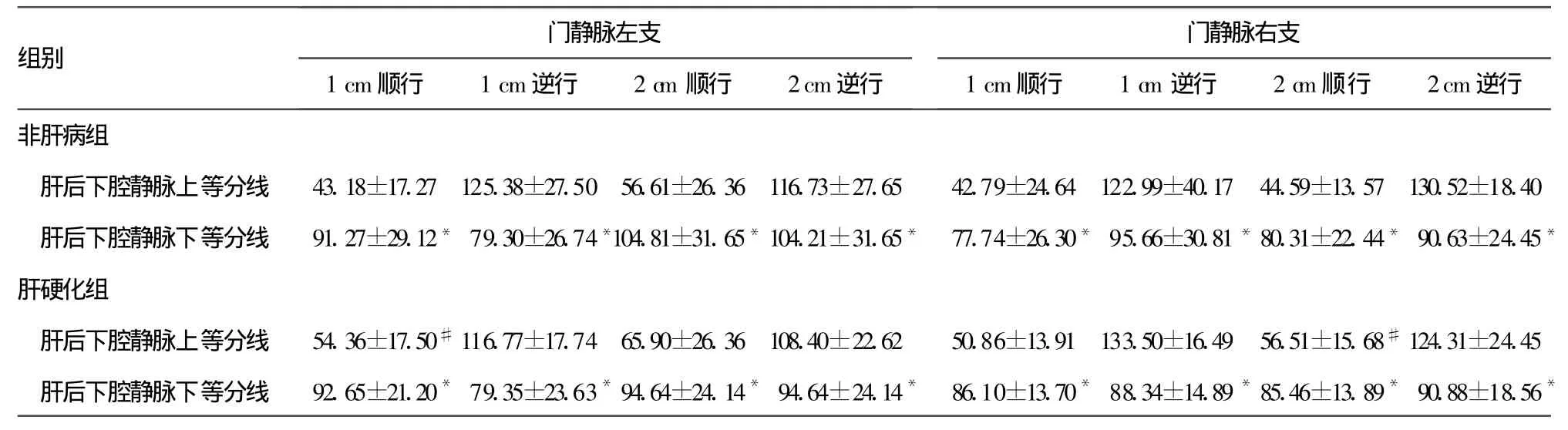
表1 非肝病组与肝硬化组模拟穿刺途径的入口顺、逆行角度(±s,度)
*:P<0.05,与肝后下腔静脉上等分线相应途径角度比较;#:P<0.05,与非肝病组比较。
门静脉左支组别门静脉右支1 cm顺行 1 cm逆行 2 cm顺行 2 cm逆行1 cm顺行 1 cm逆行 2 cm顺行 2 cm逆行非肝病组肝后下腔静脉上等分线 43.18±17.27 125.38±27.50 56.61±26.36 116.73±27.65 42.79±24.64 122.99±40.17 44.59±13.57 130.52±18.40肝后下腔静脉下等分线 91.27±29.12*79.30±26.74*104.81±31.65*104.21±31.65* 77.74±26.30*95.66±30.81*80.31±22.44*90.63±24.45*肝硬化组肝后下腔静脉上等分线 54.36±17.50#116.77±17.74 65.90±26.36 108.40±22.62 50.86±13.91 133.50±16.49 56.51±15.68#124.31±24.45肝后下腔静脉下等分线 92.65±21.20*79.35±23.63*94.64±24.14*94.64±24.14* 86.10±13.70*88.34±14.89*85.46±13.89*90.88±18.56*
表2 非肝病组与肝硬化组模拟穿刺途径出口角度(±s,度)
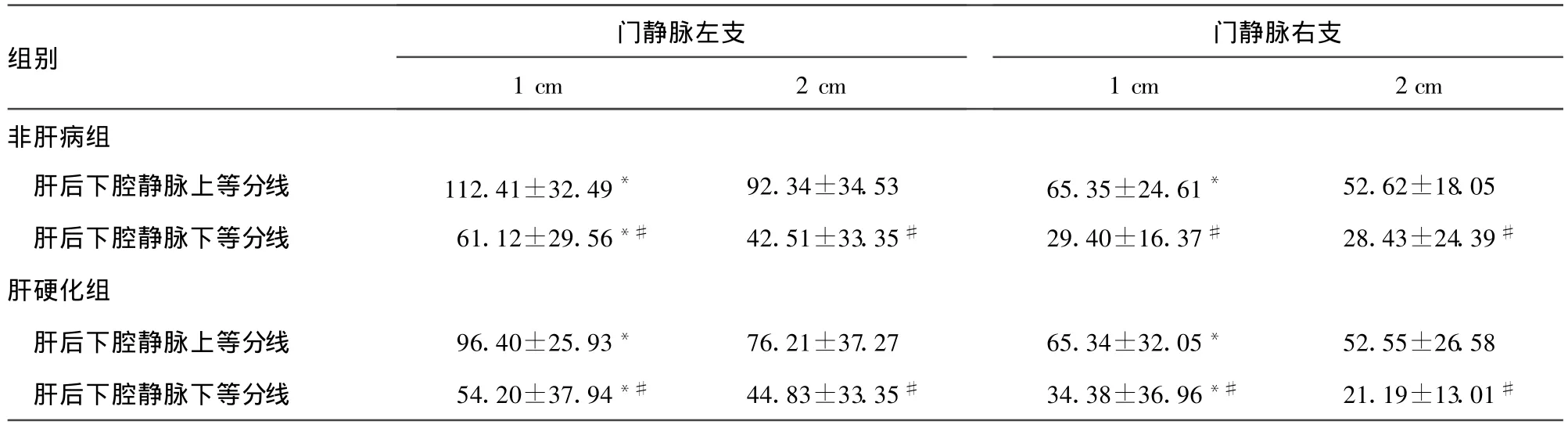
表2 非肝病组与肝硬化组模拟穿刺途径出口角度(±s,度)
*:P<0.05,与相应门静脉左、右支2 cm比较;#:P<0.01,与相应肝后下腔静脉上等分线比较。
门静脉左支组别门静脉右支1 cm 2 cm 1 cm 2 cm非肝病组肝后下腔静脉上等分线 112.41±32.49* 92.34±34.53 65.35±24.61* 52.62±18.05肝后下腔静脉下等分线 61.12±29.56*# 42.51±33.35# 29.40±16.37# 28.43±24.39#肝硬化组肝后下腔静脉上等分线 96.40±25.93* 76.21±37.27 65.34±32.05* 52.55±26.58肝后下腔静脉下等分线 54.20±37.94*# 44.83±33.35# 34.38±36.96*# 21.19±13.01#
1.5 统计学处理 所有数据均用SPSS15.0统计软件进行处理,所有计量资料用±s表示,采用独立样本t检验,以P<0.05为差异有统计学意义。
2 结 果
2.1 非肝病组与肝硬化组模拟穿刺途径的入口顺行角度 非肝病组或肝硬化组门静脉支左、右支1、2 cm处与肝后下腔静脉的模拟穿刺途径,下等分线入口顺行角度均大于上等分线相应途径角度(P<0.05)。独立样本t检验结果显示肝硬化组,门静脉左支1 cm和右支2 cm处与上等分线间模拟途径入口顺行角度和非肝病组相应途径比较,差异有统计学意义(P<0.05),见表 1。
2.2 非肝病组与肝硬化组模拟穿刺途径入口逆行角度 非肝病组或肝硬化组,门静脉左、右支静脉1、2 cm处与肝后下腔静脉上等分线的模拟穿刺途径入口逆行角度大于下等分线相应途径角度(P<0.05),见表1。
2.3 非肝病组与肝硬化组模拟穿刺途径出口角度 从表2可知非肝病组与肝硬化组患者门静脉左、右支1 cm处与肝后下腔静脉上、下等分线间的模拟穿刺途径出口角度大于门静脉左、右支2 cm间相应途径角度(P<0.05),且门静脉左、右支1、2 cm与上等分线间模拟穿刺途径出口角度均大于其与下等分线相应途径的出口角度(P<0.05)。
3 讨 论
64-VCT与传统CT、一般容积CT相比具有扫描速度快、层面极薄及各向同性等功能特点,能够获取高质量图像[6]。64-VCT的应用有助于改善传统肝血管的解剖学资料主要来自尸体标本,所获得的管道数据与活体肝脏管道存在差异的局面[7],采用64-VCT技术还能提供功能活体状态下的DIPS穿刺相关解剖学数据。
DIPS的最佳穿刺点在肝后下腔静脉中段前壁,因其紧贴于下腔静脉沟内,是门静脉分叉处到肝后下腔静脉间最短距离,没有小分支[8],且中段有利于避开上段的肝静脉及下段的副肝右静脉(出现率为76.6%)[9],下腔静脉肝后的上段与下段被肝实质环抱的角度较中段小,且静脉壁与肝实质之间的连接亦不够紧密,在这些区域进行经下腔静脉肝后的肝内穿刺风险较大[10]。为了介入操作的安全性,将肝后下腔静脉3等分,取上、下等分线与肝后下腔静脉前壁交汇处为模拟穿刺点进行,见图1~3。

图1 肝后下腔静脉上、下边界及其间的上、下等分线
根据Petersen等[11]和 Gasparini等[12]的观点,在 DIPS术中应适当增加从肝后下腔静脉向肝内门静脉进行穿刺的角度,这样不仅便于穿刺,也利于穿刺针的固定。从表1可知肝硬化组下等分线与门静脉左支、右支1 cm、2 cm间入口顺行、逆行角度能较好的满足上述要求。

图2 肝后下腔静脉上等分线与门静脉左支1 cm处模拟穿刺途径的出口角度

图3 肝后下腔静脉下等分线与门静脉右支2 cm处穿刺途径的入口逆行角度与出口角度
按照颜志平[4]和杨有[13]的观点,支架与引流静脉纵轴之间的夹角越小,越符合局部血流动力学要求,分流道越通畅,其再狭窄、闭塞的发生率就越低。从表2可知门静脉左、右支2 cm处与肝后下腔静脉上、下等分线间的模拟穿刺途径的出口角度小于门静脉左、右支1 cm相应模拟途径的角度。门静脉左、右支血液分别来自脾静脉和肠系膜上静脉,沿门静脉主干两侧壁流入,且血液尚未充分混匀的血流动力学现象[14]是介入治疗所需要达到的状态。门静脉左支主要供应占肝脏体积20%~25%的左叶,即便将左支血液完全性分流,也只有约1/4的肝功能受到损害[15]。从表1~2均显示门静脉左支模拟途径入口及出口角度均较理想,按流体力学分析属血流切应力,而不是易对血管内膜产生强刺激而致假性内膜过度增生的正应力[16]。故以门静脉左支作为穿刺点既不会过多影响门静脉分支血流,也不会过多增加体循环的血氨浓度和肝性脑病的发生率,还较右支能减小分流道狭窄和血栓形成风险。
以往的肝脏解剖学资料多经尸体解剖的肝脏标本获得。近年来,随着影像技术的发展,64-VCT等数字医学的兴起使活体肝内管道的研究成为可能。但肝内Glisson系统还涉及肝内胆道和肝动脉,D IPS操作时还需予以考虑。但目前要获得正常胆道的清晰显影、一级肝动脉、门静脉的同期显示在技术上还有一定难度,还需有待影像技术的进一步提高。
[1] Petersen B.Intravascular ultrasound-guided direct intrahepatic portacaval shunt:description o f technique and technical refinements[J].JVasc Interv Radiol,2003,14(1):21-32.
[2] 褚建国,孙晓丽,吕春燕,等.经皮经肝门腔静脉分流术[J].介入放射学杂志,2005,14(4):367-371.
[3] 时利民,何少武,刘新,等.经皮穿刺直接性门腔静脉分流术的影像学研究[J].实用医药杂志,2007,24(7):769-774.
[4] 颜志平.经皮穿刺直接性门腔静脉分流术[J].中国介入影像与治疗学,2005,2(5):325-328.
[5] 罗剑钧,颜志平,王建华,等.直接性肝内门腔分流治疗门静脉高压症的中期疗效[J].介入放射学杂志,2009,18(8):576-580.
[6] 胡志华,项劲驰,罗天友,等.64层容积CT冠状位重组图像在副鼻窦检查中的价值[J].重庆医学,2007,36(9):838-839.
[7] 方驰华,钟世镇,吴坤成,等.适用于CT薄层扫描和三维重建肝脏管道系统的灌注和铸型的建模研究[J].第四军医大学学报,2003,24(22):2076-2080.
[8] Yu SP,Chu GL,Yang JY,et al.Direct intrahepatic portocavalshunt through transhepatic puncture via retrohepatic inferior vena cava:applied anatom ical study[J].Surg Radiol Anat,2009,31(5):325-329.
[9] 刘本菊,周庭永,钱学华,等.副肝右静脉的应用解剖[J].第三军医大学学报,2009,31(19):1881-1883.
[10]余深平,初国良,杨建勇,等.经下腔静脉肝后段肝内穿刺介入的相关解剖学研究[J].中国临床解剖学杂志,2008,26(1):35-37.
[11]Petersen B,Uchida BT,Timmermans H,eta l.Intravascular US-guided direct intrahepatic portacaval shunt with a PTFE-covered stent-graft:feasibility study in sw ine and initial clinical resu lts[J].JVasc Interv Radio l,2001,12(4):475-486.
[12]Gasparini D,Del Forno M,Sponza M,et al.Transjugu lar intrahepatic portosystem ic shunt by direct transcaval approach in patientsw ith acute and hyperacute Budd-Chiari synd rome[J].Eur JGastroenterol H epato l,2002,14(5):567-571.
[13]杨有.经颈静脉肝内门腔分流术治疗门静脉高压症的临床研究[D].昆明:昆明医学院,2009.
[14]Deng D,Liao MS,Qin JP,etal.Relationship betw een pre-TIPS hepatic hemodynam ics and postoperative incidence o f hepatic encephalopathy[J].Hepatobiliary Pancreat Dis Int,2006,5(2):232-236.
[15]褚建国,孙晓丽,朴龙松,等.门静脉左支分流降低术后肝性脑病的临床研究[J].中华肝脏病杂志,2002,10(6):437-440.
[16]褚建国,孙晓丽,徐晓明,等.经皮经肝门腔静脉分流术[J].空军总医院学报,2004,20(2):63-69.



