谭 兵,詹廷西,李 青,李 成,吕 莉,邢 燕,张国珍
(重庆医科大学附属第一医院输血科 400016)
艾滋病是我国重点防治的重大传染病。艾滋病病毒(HIV)抗体检测是艾滋病防治工作的基础。我国现行艾滋病抗体检测程序是先初筛(筛查和复检)再确证。初筛是采用高敏感性筛查试剂最大限度地发现所有HIV抗体阳性者,目前我国常用的是酶联免疫试验(ELISA)和快速检测试剂;确证则须用高特异性方法和试剂纠正所有假阳性标本,得出正确结论,常用免疫印迹试验(WB)。为了解筛查阳性标本与确证结果之间的关系,现将本院近7年287例初筛阳性与确认试验结果对比分析如下:
1 资料与方法
1.1 研究对象 2003年1月至2009年12月,本院住院患者术前、输血前,疑似艾滋病感染者以及部分普通门诊患者,共158451例。均抽取静脉血3 mL,进行HIV抗体检测。
1.2 试剂与仪器 HIV抗体初筛(ELISA法)试剂盒由珠海丽珠试剂有限公司和北京华大吉比爱生物技术有限公司提供,胶体硒法试剂为日本雅培公司生产,确证试剂为新加坡MP生物医学亚太私人有限公司生产的HIV(1+2)型抗体免疫印迹试剂。上述试剂均在国家食品药品监督管理局注册,批检合格,并在有效期内使用。Multiskan M K3酶标仪和Wellwash4 MK2洗板机,由热电上海仪器有限公司生产。Autoblot System 20全自动蛋白印迹仪由M P生物医学亚太私人有限公司生产。
1.3 检测方法 初筛采用双抗原夹心ELISA法或胶体硒法。初筛阳性标本用原试剂及另外一种不同原理试剂复查,将两法检测阳性或一阴一阳标本按照《全国艾滋病检测技术规范》要求送重庆市疾病预防控制中心艾滋病确证实验室进行WB确证。确证结果按试剂盒说明书进行判断,HIV-1抗体阳性:检测出两条env带(gp160/gp41和 gp120)及 gag(p17、p24、p55)或pol(p31、p51、p66)带;阴性:没有病毒的特异性条带,或只检出p17抗体没有其他条带;不确定:出现任何病毒特异条带,但不足于被判断为阳性。HIV-2抗体阳性:在 HIV-1阳性或不确定基础上见如HlV-2清晰条带,提示HIV-2阳性感染。
1.4 统计学处理 采用 SPSS13.0软件进行描述性统计分析。
2 结 果
2.1 初筛试验与确证试验结果 初筛试验阳性结果与WB确认结果见表1。初筛阳性标本共287例,其中ELISA和胶体硒法均为阳性有 270例,ELISA阴性胶体硒法阳性有 8例,ELISA阳性胶体硒法阴性有9例。287例HIV抗体初筛阳性标本,经 WB确证,其中 251例为 HIV-1型抗体阳性,占87.46%;16例为不确定,占 5.57%;20例确证为阴性,占6.97%。
ELISA、胶体硒法与WB的阳性符合率分别为89.96%(251/279)和90.29%(251/278),初筛试验与确证试验的阳性符合率为87.46%(251/287),两种方法同时呈阳性反应标本与WB的阳性符合率为92.96%(251/270)。
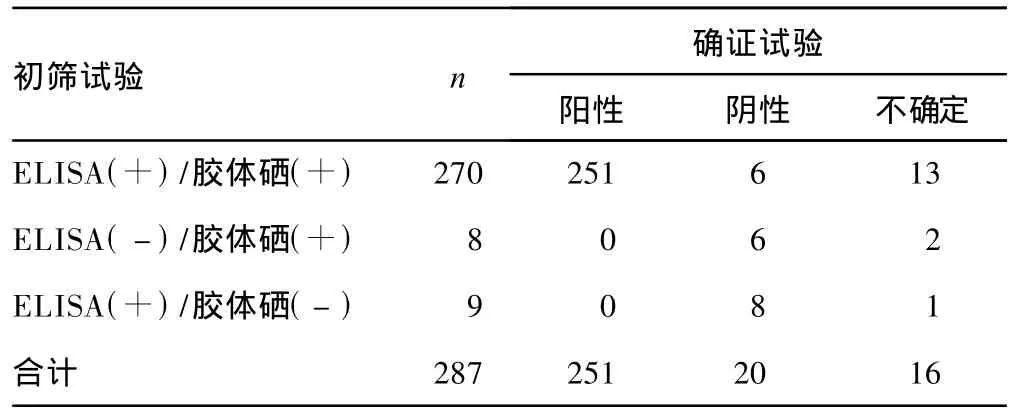
表1 初筛试验阳性结果与WB确认结果
2.2 初筛阳性标本ELISA(S/CO值)与确证试验结果的关系 251例确证为HIV-1型抗体阳性标本的平均S/CO值为16.93,16例不确定标本的平均S/CO值为6.996,20例阴性标本的平均S/CO值为5.568。ELISA(S/CO值)与确证试验结果比较,见表2,有8例初筛阳性标本的 S/CO值小于 1,确证试验为阴性或不确定结果;16例标本的S/CO值大于或等于1而小于6,与确证试验阳性符合率为18.75%;26例标本的S/CO值大于或等于6而小于10,与确证试验阳性符合率为69.23%;237例标本的S/CO值大于等于10,与确证试验阳性符合率为97.05%。
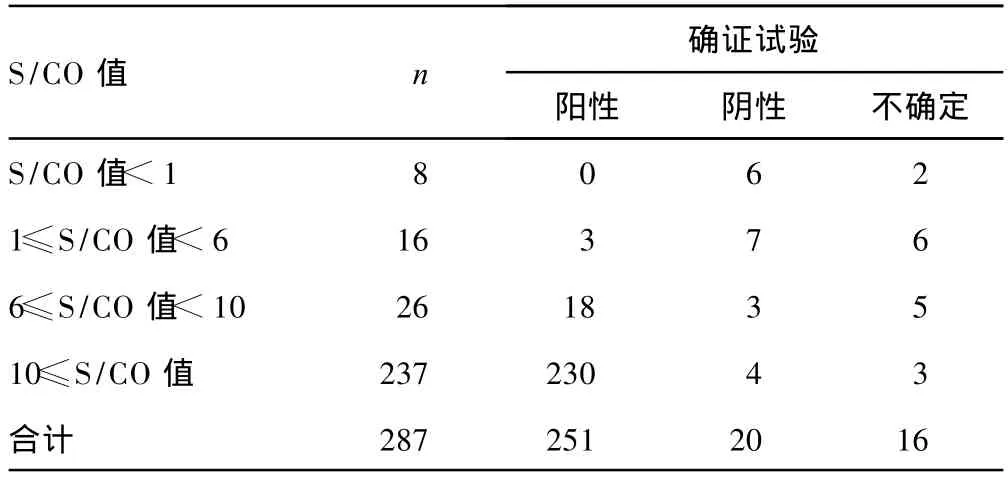
表2 ELISA(S/CO值)与确证试验结果比较
2.3 WB确证试验带型结果 WB试验确证为HIV-1型抗体阳性的251例标本中,呈现10条带的有130例(51.79%),9条带23例(9.16%),8条带 44例(17.53%),7条带 34例(13.33%),6条带10例(3.98%),5条带6例(2.39%),4条带3例(1.20%),3条带 1例(0.40%)。gp160、gp120、gp41、p66、p51、p24条带出现的概率都在95%以上,其中gpl60和gp120出现概率为100%;而p39出现概率最低,只有55.38%,见表3。
16例确证为不确定标本中,p24出现概率最高,为75.00%;其次是gp160,为 43.75%。出现1条带的7例;2条带6例,分别为 2例p24和gp160,2例p24和 gp120,1例gp160和gp120,1例 p24和p51;3条带的3例,带型分别为p24、gp160和 p31,p24、gp160和p66,gp160、p66 和p51。

表3 WB确证试验带型分布[n(%)]
3 讨 论
初筛HIV抗体阳性287例标本,经WB试验确证有251例为HIV-1型抗体阳性。ELISA、胶体硒法与WB试验的阳性符合率分别为89.96%和90.29%,两种方法同时呈阳性反应的标本与WB试验阳性符合率较单一方法高,为92.96%。以上结果还表明,即使ELISA、胶体硒法均呈阳性反应的标本,仍然存在一定的假阳性反应,所以初筛呈阳性反应的标本必须按《全国艾滋病检测技术规范》[1]要求进行WB确证,最终结果以WB试验为准。
分析比较ELISA与WB确证试验结果,可见WB确证为阳性标本的S/CO平均值高达16.93,明显较不确定标本6.996和阴性标本5.568高。进一步比较分析S/CO值与确证试验阳性符合率的关系表明:随着S/CO值增高,确证试验阳性符合率也随之升高,但是高S/CO值样品并不代表感染HIV,即使S/CO值大于或等于6的标本其确证结果也有可能是不确定或阴性,这与国内相关文献报道一致[2-3]。分析其原因,可能与ELISA试剂的特异性、样品的质量等有关。疾病预防控制中心(CDC)每周做1次确证实验,初筛阳性送检样品往往保存时间过长,同时运输环节较多,从而影响确证结果。另一方面S/CO值大于或等于1而小于6的标本与确证试验阳性符合率为18.75%,这与一些报道确证试验阳性标本的S/CO值均大于或等于6不一致[4],而与黎锋等[2]的报道相同。
在确证为HIV-1抗体阳性的251份标本中,197份(78%)出现8条以上带型结果,表明绝大多数阳性患者体内病毒繁殖活跃,病毒含量高,具有较强传染性,在检测过程中应注意加强防护。
自1986年HIV抗体免疫印迹法试剂问世以来,有关WB结果解释一直存在争议,全世界尚无统一标准。《全国艾滋病检测技术规范》[5]2004版规定我国的阳性标准是:至少有2条env带(gp41和gp160/gp120)出现,或至少 1条 env带和 p24同时出现,判为 HIV-1抗体阳性(+);而MP公司试剂盒对于HIV-1抗体阳性的判断标准与之有些差异:检测出两条env带(gp160/gp41和 gp120)及 gag(p17、p24、p55)或 pol(p31、p51、p66)。本试验中呈现(p24和gp160,p24和 gp120,p24、gp160和p31,p24、gp160和p66)带的标本,按检测技术规范应判为阳性,按试剂盒说明则判为不确定。2009版的《全国艾滋病检测技术规范》则避免了这种情况发生,规定同时符合我国使用的WB确证HIV感染判定标准和试剂盒提供的阳性判定标准方可判为HIV-1抗体阳性,这使HIV-1抗体阳性判定标准更为严格。即使这样,使用WB法确证仍有可能出现假阳性结果。国外学者对低危人群进行了回顾性研究,发现过去一些标本被错误判断为阳性,这部分人群或仅有包膜蛋白(gp41+gp120/gp160)或gag+包膜(p24+gp41和/或 gp120/gp160)带型而被蛋白印迹试验判断为HIV-1阳性,个别蛋白印迹假阳性率甚至高达8%(52/683)[6-7]。杨成勇和刘翌[8]也研究发现 1例受检标本有 gp160、gp120、p66、p24条带,经 NASBA 和RT-PCR进一步进行核酸检测却为阴性。
由于阳性判定标准更为严格,随之而来的则是不确定结果的增加。各种不同研究发现,在保证检测质量的基础上,造成不确定原因主要有:HIV新近感染不久出现的血清转换期、肝病、自身免疫性疾病、输入血制品、肾功能衰竭和血液透析、注射某些药物、妊娠、肿瘤、免疫接种、疟疾、病毒感染等[9-13]。本次研究对象中,16例为不确定,占初筛阳性的5.57%。对于不确定标本,需要4~8周甚至更长时间随访检测,并根据复查结果来最终判定是阴性还是阳性。这也是实践工作中,WB确认方法的局限性。不确定结果标本的存在,给检验人员检测工作带来难度;同时由于长时间随访给受检者带来困惑和巨大的心理压力,影响入伍、入学、求职、就医等关系个人前途命运的大事[14-15]。这些都是需要解决的问题。
总之,在进行HIV感染的诊断中,不仅要依据实验室确证试验结果,还需要结合流行病学资料、核酸检测等辅助诊断手段,以及定期随访复查等综合因素加以判断。既要防止出现假阳性,也要防止出现假阴性。
[1]中国疾病预防控制中心.全国艾滋病检测技术规范[S].2009-11-30.
[2]黎锋,刘伟,梁富雄,等.2472例 HIV抗体筛查(ELISA)与免疫印迹试验的对比研究[J].应用预防医学,2009,15(5):302-304.
[3]彭庭海,陈慧萍,汤恒,等.HIV抗体筛查阳性与免疫印迹试验结果对比分析[J].医药论坛杂志,2006,27(17):52-54.
[4]杨育红,陈杰毅,陈明春,等.泉州市318例HIV抗体筛查阳性的确认结果分析[J].实验与检验医学,2010,28(1):37-38.
[5]中国疾病预防控制中心.全国艾滋病检测技术规范[S].2004-08.
[6]Healey DS,Bolton WV.Apparent HIV-1 glycoprotein reactivity on Western blot in uninfected blood donors[J].AIDS,1993,7(5):655-658.
[7]Sayre KR,Dodd RY,Tegtmeier G,et al.False-positive human immunodeficiency virus type 1 Western blot tests in uninfected blood donors[J].Transfusion,1996,36(1):45-52.
[8]杨成勇,刘翌.HIV-1抗体蛋白印迹确认与核酸检测复核对比研究[J].病毒学报,2006,22(2):114-117.
[9]Walensky RP,Rosenberg ES,Ferraro M J,et al.Investigation of primary human immunodeficiency virus infection in patients who test positive for heterophile antibody[J].Clin Infect Dis,2001,33(4):570-572.
[10]Ghosh K,Javeri KN,Mohanty D,et al.False-positive serological tests in acute malaria[J].Br J Biomed Sci,2001,58(1):20-23.
[11]Silverstein DM,Aviles DH,Vehaskari VM.False-positive human immunodeficiency virus antibody test in a dialysis patient[J].Pediatr Nephrol,2004,19(5):547-549.
[12]高凯,李燕,梁彩云,等.用蛋白印迹确认实验检查“人类免疫缺陷病毒抗体不确定”结果的分析[J].微生物与感染,2007,2(1):16-18.
[13]郑晓虹,潘启超,张玮,等.人类免疫缺陷病毒确认试验不确定结果分析[J].上海预防医学杂志,2007,19(8):373-376.
[14]杨晓莉,李敬云.HIV感染确认的现状和发展趋势[J].中国艾滋病性病,2007,13(6):585-587.
[15]张国珍,谭兵,詹廷西,等.住院患者HIV抗体检测结果分析及防范[J].重庆医学,2009,38(12):1427-1428.



