彭 力,钟礼立,黄 寒,厉 娟,梁 沫,李 云
(湖南省人民医院儿科,长沙410005)
婴幼儿喘息是小儿呼吸道疾病的一种常见症状,有反复发作倾向,其中30%~50%患儿可发展成哮喘。而判断哪些婴幼儿喘息最终会发展为哮喘,需要早期干预治疗仍然是目前喘息性疾病防治的一个难点。CD4+CD25+调节性T细胞(regulatory T cells,Treg),具有低反应性和免疫抑制两大功能特性,但具有免疫调节或抑制活性的细胞主要是高表达CD25+的CD4+T细胞(CD4+CD25higTreg)。人转录因子Foxp3是Treg分化发育的关键基因,主要表达于CD4+CD25higTreg。Treg在儿童支气管哮喘和过敏性疾病的发病中表达是下调的,但在婴幼儿喘息中的表达研究甚少。本研究试图通过对首次喘息婴幼儿CD4+CD25+Treg、CD4+CD25higTreg及叉头/翼状螺旋转录因子(Foxp3)mRNA表达的研究,探讨有特应征和非特应征喘息婴幼儿CD4+CD25+Treg、CD4+CD25higTreg及Foxp3mRNA表达变化及与IgE的关系。
1 资料与方法
1.1 一般资料 选择本院2010年10月至2011年1月因喘息性疾病住院的婴幼儿(首次发作)55例,两肺听诊有喘鸣音,其中4例(后来经胸部CT、纤维支气管镜检查有支气管软化2例、呼吸道异物2例)除外,共51例患儿,其中男36例,女15例;年龄1个月至3岁(中位年龄8个月)。其中特应征组28例,男22例,女6例;有湿疹、过敏性鼻炎等特应征及特应征家族史。非特应征喘息组23例,男14例,女9例;无湿疹、过敏性鼻炎等特应征及特应征家族史。对照组20例,为门诊健康体检者,无家族过敏史及近期无呼吸道感染婴幼儿。采血前2周均未用过糖皮质激素、抗组胺药及免疫调节剂。
1.2 方法
1.2.1 CD4+CD25+Treg和CD4+CD25higTreg测定 CD4+CD25+Treg和CD4+CD25higTreg的测定分别采集喘息婴幼儿及健康患儿外周静脉血2mL,肝素抗凝;取肝素抗凝的全血100μL,加入CD4-PE和 CD25-FITC单克隆抗体20μL,IgG1-PE和IgG1-FITC作为同型对照,室温闭光反应30min;加2mL溶血剂在室温下溶解红细胞约10min,磷酸盐缓冲液(phosphate buffered saline,PBS)洗涤,离心 5min(1 500r/min),弃上清;每份标本加入1%多聚甲醛500μL后用流式细胞仪检测。流式细胞仪为Beckman-CoulterXL100(Coulter公司产品)。
1.2.2 RT-PCR检测 PBMCsFoxp3mRNA 的表达 分离外周血中单个核淋巴细胞,用PBS洗涤2次,加入Trizol提取细胞总RNA,经紫外线分光光度法定量后,取5μgRNA在寡聚脱氧胸苷酸(oligo-dT)和Moloney鼠白血病病毒逆转录酶(MMLV)存在的情况下进行逆转录反应合成互补DNA(cDNA),以cDNA为模板进行PCR扩增。引物序列为:Foxp3(176bp)正义5′-CAG CAC ATT CCC AGA GTT CCT C-3′,反义5′-GCG TGT GAA CCA GTG GTA GAT C-3′,内参基因三磷酸甘油醛脱氢酶(GAPDH)(598bp)正义5′-CCA CCC ATG GCA AAT I′CC ATG GCA-3′,反义5′-TCT AGA CGG CAG GTC AGG TCC ACC-3′。反应条件:94℃预变性5min,94℃变性1min,60℃退火2min,72℃延伸2min,32个循环后PCR产物在1.5%的琼脂糖凝胶上电泳。电泳图像用英国UVP公司GDS8000型全自动图像分析系统处理,以同一标本的Foxp3与内参照GAPDH扩增条带的光密度比值。
1.2.3 血清总IgE水平测定 取另外2mL外周血,取血清用瑞典玛西亚公司UniCAP变应原检测系统酶联免疫吸附法(ELISA)测定血清总IgE水平。
2 结 果
2.1 喘息组和对照组 CD4+CD25+Treg、CD4+CD25higTreg百分率及Foxp3mRNA比较 喘息患者外周血CD4+CD25+Treg和CD4+CD25higTreg细胞占CD4+T细胞的百分比及Foxp3mRNA均明显低于健康对照组。性别、年龄与CD4+CD25+Treg、CD4+CD25higTreg及Foxp3mRNA表达不相关。见表1和图1。
表1 喘息组和对照组CD4+CD25+、CD4+CD25hig Treg百分率及Foxp3mRNA比较(±s)

表1 喘息组和对照组CD4+CD25+、CD4+CD25hig Treg百分率及Foxp3mRNA比较(±s)
*:P<0.01,与对照组比较。
组别 nCD4+CD25+Treg(%)CD4+CD25higTreg(%)Foxp3m RNA/GAPDH喘息组 51 6.31+2.96* 3.52+1.46* 0.27+0.11*对照组20 9.28+2.40 4.81+1.50 0.39+0.19
表2 两组CD4+CD25+、CD4+CD25higTreg百分率及Foxp3mRNA与总IgE比较(±s)

表2 两组CD4+CD25+、CD4+CD25higTreg百分率及Foxp3mRNA与总IgE比较(±s)
*:P<0.05,**:P<0.01,与非特应征喘息组比较。
组别 n CD4+CD25+Treg(%) CD4+CD25higTreg(%) Foxp3mRNA/GAPDH 总IgE特应征喘息组 28 4.66+1.17* 2.50+0.52* 0.24+0.13* 102.00+47.43**非特应征喘息组 23 7.96+3.33 4.56+2.01 0.30+0.08 26.85+15.30
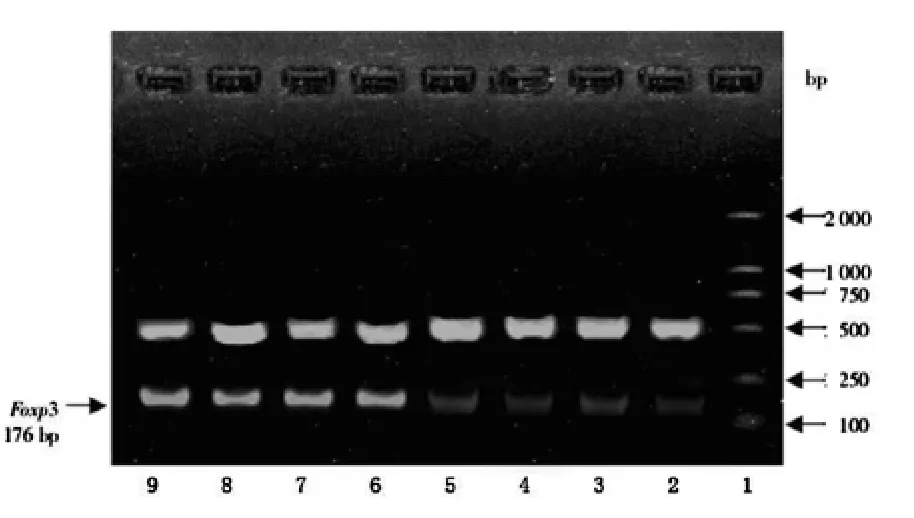
图1 喘息婴幼儿外周血Treg Foxp3mRNA和参比基因电泳图
2.2 特应征喘息与非特应征喘息婴幼儿CD4+CD25+Treg、CD4+CD25higTreg百分率及Foxp3mRNA、IgE比较 特应征喘息组外周血CD4+CD25+Treg、CD4+CD25higTreg比率及Foxp3mRNA均明显低于非特应征喘息组,而总IgE较非特应征喘息组高,且各组差异均有统计学意义(P<0.05)。见表2和图2、3。
2.3 CD4+CD25+Treg、CD4+CD25higTreg百分率及 Foxp3 mRNA与总IgE相关分析 CD4+CD25higTreg及Foxp3mR-NA与总IgE相关分析呈负相关(r=-0.75,r=-0.61,P<0.01);而该组CD4+CD25+Treg与总IgE相关分析呈正相关(r=0.36,P<0.05)。

图2 特应征喘息组和非特应征喘息组CD4+CD25+Treg占CD4+T细胞的比率与对照组比较
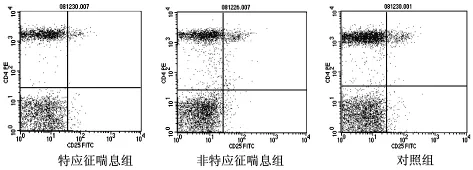
图3 特应征喘息组和非特应征喘息组CD4+CD25higTreg占CD4+T细胞的比率与对照组比较
3 讨 论
Sakaguchi[1]于1995年首先描述 CD4+CD25+Treg是一个有免疫抑制特性的T细胞群,在应答单克隆抗-CD3或抗原刺激不会增殖,且能够抑制CD4+CD25-T细胞的增殖应答,占未免疫的小鼠和健康人外周CD4+T细胞总数的5%~10%。根据CD4+T细胞表达CD25的程度不同,CD4+CD25+Treg又可分为CD4+CD25higTreg和CD4+CD25lowTreg,在小鼠中,两类细胞都有免疫活性,而有人认为在外周血中起免疫活性的是前者[2]。Foxp3是鉴别Treg的一个特异性标志物[3-4],也是CD4+CD25+Treg发展和功能维持的关键转录因子。Foxp3基因缺失使CD4+CD25+Treg抑制活性消失,而Foxp3在CD25-Treg异位表达则可恢复抑制活性[3-5]。目前研究表明,Foxp3主要表达于CD4+CD25higTreg,达97%左右[6]。人Foxp3基因突变表现为IPEX(免疫失调、多内分泌腺病、肠病、X连锁综合征),包括上升的IgE应答和变应性皮炎[7-8]。
目前研究显示支气管哮喘是Th2介导的以气道高反应、可逆的气流受阻、气道嗜酸粒细胞侵润、气道黏液高分泌及血清高IgE为特征的气道慢性炎症性疾病。目前一般认为,哮喘患者体内存在有Th1/Th2平衡改变,Th1细胞受到抑制,而Th2细胞异常活化,通过分泌IL-4、IL-5、IL-13等细胞因子促进B细胞合成IgE分子,刺激内皮细胞表达更多黏附分子,使炎性细胞向病变局部浸润。随研究深入,Treg可能在支气管哮喘和其他过敏性疾病中也起重要作用。长期暴露在哮喘发生时CD4+Treg向Th2细胞偏移是因为Treg未形成,减少Treg数量或削弱Treg功能都可能导致哮喘的发生[9]。Hartl等[10]则认为,哮喘儿童肺泡灌洗液中CD4+CD25higTreg值是下降的,其吸入糖皮质激素与外周血和肺泡灌洗液CD4+CD25higT细胞比例上升相关。同样有研究表明,与对照组相比,哮喘儿童 CD4+CD25+Treg细胞、IL-10分泌型 CD4+CD25+Treg及 TGF-β分泌型CD4+CD25+Treg、Foxp3mRNA的数目是下降的,CD4+CD25+Treg下降可能与哮喘发病机制相关[11]。
婴幼儿喘息多有反复发作的可能,它的发病机制目前仍不十分清楚,与特应性体质、环境因素等有关,与哮喘可能存在相似的免疫学发病机制[12]。婴幼儿哮喘早期即存在气道炎症反应和气道重塑,而早期干预可防止肺功能长期、不可逆的损害。如何在喘息发作初期发现潜在的哮喘患儿成为当今研究的关键。本实验结果显示,喘息婴幼儿CD4+CD25+Treg、CD4+CD25higTreg百分率及外周血Foxp3的表达明显低于对照组,Treg及Foxp3可能在婴幼儿喘息的疾病活动中起重要作用,可能参与婴幼儿喘息的发病机制。
特应征是由IgE介导的,以Th2占优势的免疫应答所表达。特应征个体针对致敏原的Th2应答而非特应征个体不会,目前一个可能的解释是Treg的影响,其有助于提高对变应原和其他炎症刺激的免疫耐受[13]。本研究显示,喘息特应征组CD4+CD25+Treg、CD4+CD25higTreg比非特应征组显着降低,与朱亚飞等[14]研究报道呼吸道合胞病毒感染毛细支气管炎特应征喘息组CD4+CD25+Treg比非特应征组降低一致,表明变应原特异的Treg在婴幼儿变应性喘息个体是有缺陷的。另外,本实验发现喘息特应征组CD4+CD25higTreg与总IgE呈负相关,为此他推测CD4+CD25higTreg参与婴幼儿变应性喘息的发生发展过程,外周血下降的CD4+CD25higTreg数目导致免疫抑制功能下降,从而导致Th2细胞大量增殖活化,IgE抗体分泌增加,产生大量致炎因子从而引起喘息发作,外周血CD4+CD25higTreg比例可能是一个较好反映细胞免疫功能的参考指标,有可能对首次喘息婴幼儿预后的早期预测有重要价值,今后有必要增加病例数及进行进一步随访和相关研究。而有趣的是,作者同时发现特应征喘息组CD4+CD25+Treg与总IgE呈正相关,这表明CD4+CD25+Treg有可能与特应征状态相关,在变应原暴露和随后的Treg激活下表达增加。已有报道在特应性皮炎个体,具有正常的抑制活性的CD4+CD25+Treg有正常的或相对高的数值[15-16];哮喘个体,在急性加重期CD4+CD25+Treg是显着增加的[17-18]。作者这部分研究与该两篇报道存在相似性。Lee等[19]认为,来自相对严重特应征表型的个体,其CD4+CD25+Treg升高有可能代表在过敏性疾病加重时,作为一种免疫应答产生的诱导的或适应性T调节细胞。作者的进一步研究将对这些Treg进行更深入的认识,识别哪些部分Treg是真正的效应性T调节细胞。此外,本实验与朱亚飞等[14]报道呼吸道合胞病毒感染毛细支气管炎CD4+CD25+Treg与总IgE呈负相关不一致,可能原因为本实验为首次喘息患儿,发病机制与呼吸道合胞病毒这种单一特殊病毒感染并非完全一致。同样作者发现,Foxp3的表达也与IgE呈负相关,因此推测在婴幼儿喘息的发病中可能存在Foxp3基因表达降低而导致Treg主要是CD4+CD25higTreg下降而不能发挥正常的免疫抑制功能,而诱导Foxp3基因表达增加,进而诱导Treg增加是治疗婴幼儿喘息的重要机制之一。
综上所述,喘息婴幼儿有下降的CD4+CD25+Treg、CD4+CD25higTreg及Foxp3表达,特应征组更为显着,表明下降的Treg有可能代表喘息婴幼儿尤其是特应征喘息儿的一种缺陷。
[1] Sakaguchi S.Naturally arising Foxp3-expressing CD4+CD25+T regulatory T cells in immunological tolerance to self and non-self[J].Nat Immunol,2005,6(4):345-352.
[2] Baecher-Allan C,Brown JA,Freeman GJ,et al.CD4+CD25higregulatory cells in human peripheral blood[J].J Immunol,2001,167(3):1245-1253.
[3] Hori S,Nomura T,Sakaguchi S.Control of regulatory T cell development by the transcription factor Foxp3[J].Science,2003,299(5609):1057-1061.
[4] Fontenot JD,Rudensky AY.A well adapted regulatory contrivance:regulatory T cell development and the forkhead family transcription factor Foxp3[J].Nat Immunol,2005,6(4):331-337.
[5] Fontenot JD,Gavin MA,Rudensky AY.Foxp3programs the development and function of CD4+CD25+regulatory T cells[J].Nat Immunol,2003,4(4):330-336.
[6] 焦志军,尤海燕,陈蕾,等.流式细胞术检测表达Foxp3的CD4+CD25+Treg[J].临床检验杂志,2008,26(3):161-163.
[7] Wildin RS,Freitas A.IPEX and FOXP3:clinical and research perspectives[J].J Autoimmunity,2005,25Suppl:56-62.
[8] Wildin RS,Smyk-Pearson S,Filipovich AH.Clinical and molecular features of the immunodysregulation,polyendocrinopathy,enteropathy,X linked(IPEX)syndrome[J].J Med Genet,2002,39(8):537-545.
[9] Umetsu DT,DeKruyff RH.The regulation of allergy and asthma[J].Immunol Rev,2006(212):238-255.
[10]Hartl D,Koller B,Mehlhorn AT,et al.Quantitative and functional impairment of pulmonary CD4+CD25hi regulatory T cells in pediatric asthma[J].J Allergy Clin Immunol,2007,119(5):1258-1266.
[11]Zu Y,Li CR,Zheng YJ,et al.The role of CD4+CD25+regulatory T cells in the pathogenesis of asthma in children[J].Zhonghua Yi Xue Za Zhi,2006,86(1):35-38.
[12]Legg JP,Hussain LR,Warner JA,et al.Type 1and type2cytokines imbalance in acute respiratory syncytial virus bronchiolitis[J].AmJ Respir Crit Med,2003,168(6):633-639.
[13]Tournoy KG,Hove C,Grooten J,et al.Animal models of allergen-induced tolerance in asthma:are T-regulatory-Tcells(Tr1)the solution for T-helper-2cells(Th-2)in asthma[J].Clin Exp Allergy,2006,36(1):8-20.
[14]朱亚非,朱建央,李卫武,等.毛细支气管炎CD4+CD25+Treg和Foxp3mRNA表达及与IgE关系[J].中国当代儿科杂志,2009,11(5):349-353.
[15]Ou LS,Goleva E,Hall C,et al.T regulatory cells in atopic dermatitis and subversion of their activity by superantigens[J].J Allergy Clin Immunol,2004,113(4):756-763.
[16]Vukmanovic-Stejic M,McQuaid A,Birch KE,et al.Relative impact of CD4+CD25+regulatory T cells and tacrolimus on inhibition of T-cell proliferation in patients with atopic dermatitis[J].Br J Dermatol,2005,153(4):750-757.
[17]Gemou-Engesaeth V,Bush A,Kay AB,et al.Inhaled glucocorticoid therapy of childhood asthma is associated with reduced peripheral blood T cell activation and"Th2-type"cytokine mRNA expression[J].Pediatr,1997,99(5):695-703.
[18]Shi HZ,Li S,Xie ZF,et al.Regulatory CD4+CD25+T lymphocytes in peripheral blood from patients with atopic asthma[J].Clin Immunol,2004,113(2):172-178.
[19]Lee JH,Yu HH,Wang LC,et al.The levels of CD4+CD25+regulatory T cells in paediatric patients with allergic rhinitis and bronchial asthma[J].Clin Exp Immunol,2007,148(1):53-63.



