甘 露,黄明元,蒙子君,张 哲,罗炳德△
(1.南方医科大学公共卫生与热带医学学院预防医学实验教学中心,广州 510515;
2.广东医学院公共卫生学院劳动卫生与环境卫生教研室,广东东莞 523808)
14-3-3σ是14-3-3蛋白家族的一个成员,它可与多种蛋白结合,参与细胞信号转导、增殖和死亡调控及细胞的迁移运动等,在体内发挥重要的生物学功能,在肿瘤的发生、生长、演化过程中发挥重要作用。研究者发现14-3-3σ在正常皮肤的基底细胞高表达,在多种上皮来源的肿瘤中发挥了作用[1-2]。14-3-3σ基因受到包括P53在内的多种转录因子的直接调控,14-3-3σ蛋白反过来又能与P53等转录因子相螯合,影响转录因子发挥作用[3]。但直至目前,14-3-3σ是否与另一个转录因子激活蛋白(activator protein-2α,AP-2α)发生相互作用尚未见报道。因此,本研究对转录因子 AP-2α调控14-3-3σ的作用进行了探讨。
1 材料与方法
1.1 材料 真核表达载体pCMV-Myc购自Clontech公司,pGL3-Basic质粒购自Promega公司,pMD18-T载体、限制性内切酶、T4DNA连接酶、T4聚合酶购自NEB公司,Lipofectamine 2000转染试剂盒、Trizol试剂购自Invitrogen公司,化学合成的AP-2αsiRNA和siRNA control购自上海吉玛公司。
1.2 细胞培养和转染 人宫颈上皮细胞癌细胞系HeLa细胞由本实验室保存,在含10%胎牛血清的高糖型DMEM培养基中培养,培养条件为37℃、5%CO2,相对湿度95%。细胞用0.25%胰蛋白酶-EDTA进行消化传代。细胞转染利用Invitrogen公司的Lipofectamine 2000试剂盒,按照试剂盒提供的实验方法进行转染。转染所用的质粒均由本实验室提供。
1.3 载体构建 为获得AP-2α过表达质粒,AP-2α全长编码序列由PCR扩增得到,T载体克隆后酶切连入pCMV-Myc真核表达载体构建成 pCMV-Myc/AP-2α,在细胞转染后表达Myc/AP-2α。进行双荧光素酶报告基因分析试验,以人血液基因组DNA为模板,通过PCR扩增得到人14-3-3σ基因启动子区域-1 050~+299总长度为1 349bp的片断,将该片断经XhoⅠ/HindⅢ酶切位点插入pGL3-Basic质粒,获得pGL3/14-3-3σ质粒,PCR 引 物 为:5′-CCG CTC GAG TCT GTG AGC CCC GCT GGT AC-3′(sense)和5′-CCC AAG CTT GTA CTC ACG CAC CTC GGG CC-3′(antisense)。
1.4 荧光定量RT-PCR HeLa细胞接种在6孔板,转染细胞后48h收集细胞,用Trizol提取总RNA,按Promega的反转录试剂盒说明书进行反转录,用SYBR Green PCR Master Mix试剂盒进行荧光定量PCR。反应条件为95℃5min;95℃预变性15s,60℃退火15s,72℃延伸32s;40个循环(最后72℃延伸32s收集荧光信号)。PCR引物为如下:CAC TGT CCT CCC TTA AAA GCA(AP-2αsense),ATC TGG GCA ACA AAG GAC TA(AP-2αantisense);GAA CTT TTC CGT CTT CCA CTA C(14-3-3σsense),TCC ACA GTG TCA GGT TGT CT(14-3-3σantisense);CCT GGA TAC CGC AGC TAG GA(内参照18srRNA sense),GCGGCGCAATACGAATGCCCC(内参照18srRNA antisense)。
1.5 Western blot HeLa细胞接种在6孔板,转染细胞后48h收集细胞,加入含蛋白酶抑制剂的细胞裂解液(pH7.5的25mmol/L Tris-HCl,137mmol/L NaCl,2.7mmol/L KCl和1%Trixon X-100)充分裂解,离心收集上清液。聚丙烯酰胺凝胶垂直电泳分离,转移蛋白质到聚偏氟乙烯(polyvinylidene flroride,PVDF)膜上,5%脱脂奶粉4℃封闭过夜,用 AP-2α和14-3-3σ鼠单克隆抗体(Santa Cruz公司)室温孵育1h,膜洗3次,辣根过氧化物酶标记的二抗(武汉博士德)室温孵育1h,膜洗3次,增强化学发光法(普利莱基因技术有限公司)显影。
1.6 软件分析14-3-3σ的启动子 应用UCSC基因组浏览器查找人14-3-3σ基因的启动子序列并进行转录因子 AP-2α的结合位点分析。
1.7 双荧光素酶报告基因分析试验 用Promega公司的Dual-Luciferase Reporter Assay System (E1910)进行样品荧光素酶活性检测,方法:转染前1d,细胞以1×104/cm2的密度接种于24孔板上,细胞转染48h后加入PBS清洗细胞,再加入100μL被动裂解缓冲液,室温轻微振摇15min,收集细胞裂解液。转染48h后加入PBS清洗细胞,再加入100μL PLB,室温轻微振摇15min,收集细胞裂解液。使用手动的双荧光检测仪(Promega,GloMax生物发光检测仪)读值。
1.8 统计学处理 采用SPSS12.0统计软件进行多组均数间比较,结果数据以±s表示,方差齐性检验后进行单因素方差分析,以P<0.05为差异有统计学意义。
2 结 果
2.1 AP-2α对14-3-3σmRNA 水平的影响 在 HeLa细胞内转染pCMV-Myc/AP-2α过表达质粒后,与转染空质粒pCMVMyc相比较,AP-2α的 mRNA 水平显着增高,同时14-3-3σ的mRNA水平也上升。当转染AP-2αsiRNA干扰AP-2α后,与转染对照siRNA相比,AP-2α的mRNA水平明显降低,同时14-3-3σ的mRNA水平也降低,1组和2组相比差异有统计学意义(P<0.01,P<0.05)。同时转染pCMV-Myc/AP-2α过表达质粒和 AP-2αsiRNA,与单独转染pCMV-Myc/AP-2α过表达质粒相比,结果显示AP-2αsiRNA能明显干扰AP-2α的过表达,同时14-3-3σ的mRNA水平也降低,3组和6组相比差异有统计学意义(P<0.01,P<0.05),见图1。
2.2 AP-2α对14-3-3σ蛋白水平的影响 在 HeLa细胞内转染pCMV-Myc/AP-2α过表达质粒后,与转染空质粒pCMVMyc相比较,AP-2α的蛋白水平显着增高,同时14-3-3σ的蛋白水平也上升。当转染AP-2αsiRNA干扰AP-2α后,与转染对照siRNA相比,AP-2α的蛋白水平明显降低,同时14-3-3σ的蛋白水平也降低。同时转染pCMV-Myc/AP-2α过表达质粒和 AP-2αsiRNA,与单独转染pCMV-Myc/AP-2α过表达质粒相比,结果显示AP-2αsiRNA能明显干扰AP-2α的过表达,同时14-3-3σ的蛋白水平也降低,见图2。
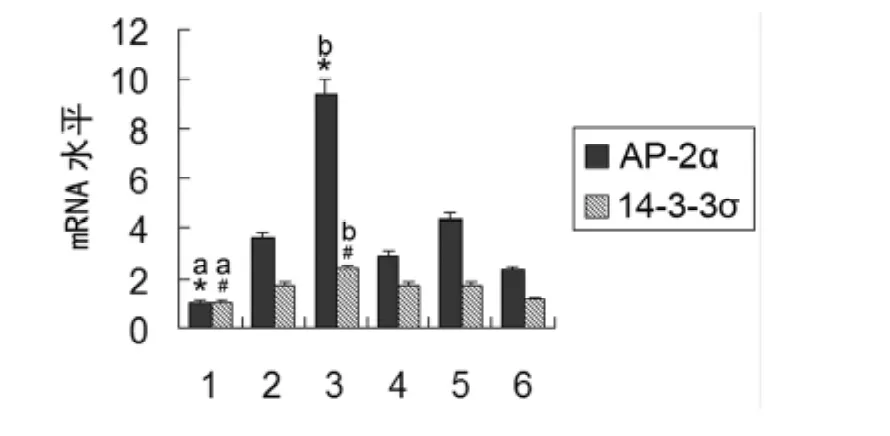
图1 荧光定量RT-PCR结果
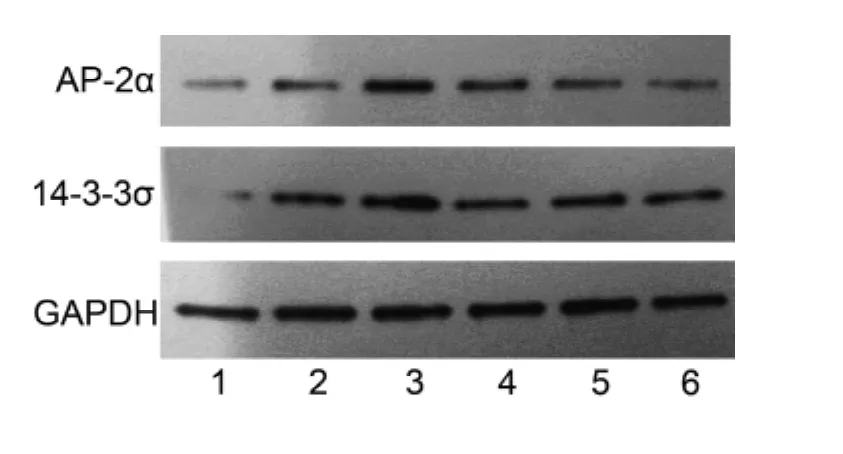
图2 Western blot结果
2.3 人14-3-3σ基因启动子软件分析结果 应用UCSC基因组浏览器查找人14-3-3σ基因的启动子序列并进行转录因子AP-2α的结合位点分析,显示了人14-3-3σ基因启动子区域转录起始位点上游-1 050bp至转录起始位点下游299bp共1 349bp长度的基因序列。在这1 349bp的启动子区域预测到有10个AP-2α结合位点,见图3。
2.4 AP-2α对人14-3-3σ基因转录活性的影响 HeLa细胞被转染以pGL3-Basic质粒时,检测到的荧光素酶活性极低,pGL3-Basic质粒与pCMV-Myc/AP-2α质粒共转染时,荧光素酶活性仍然很低,说明AP-2α蛋白的过表达对pGL3-Basic质粒的转录活性没有明显影响。细胞被转染以pGL3/14-3-3σ质粒后,与对照组pGL3-Basic组相比较,荧光素酶活性显着增高(3组和1组),说明14-3-3σ启动子在HeLa细胞中有很强的转录活性。pGL3/14-3-3σ质粒和 pCMV-Myc/AP-2α质粒共转染时,与单独转染pGL3/14-3-3σ质粒相比较,荧光素酶活性显着增强,说明 AP-2α蛋白可以增强14-3-3σ启动子的转录活性,见图4。

图3 UCSC基因组浏览器在线分析人14-3-3σ基因启动子结果
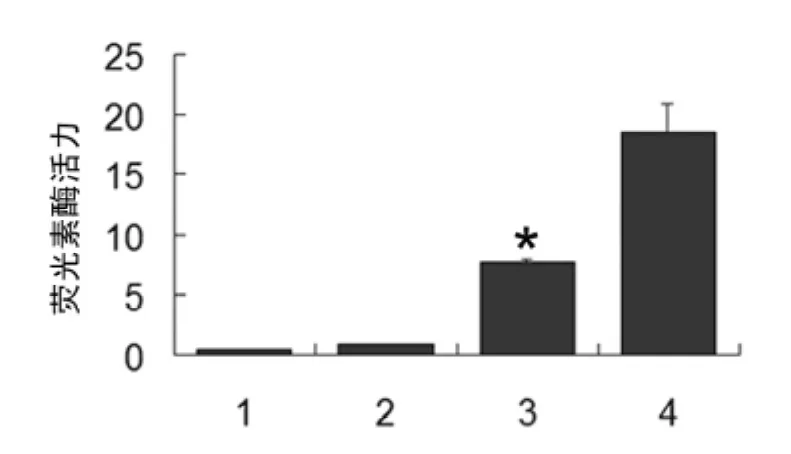
图4 双荧光素酶报告基因分析试验结果
3 讨 论
哺乳动物的14-3-3蛋白家族至少有7种异构体,即β、γ、ε、ζ、η、σ和τ,它们能与磷酸化蛋白相结合,从而调节细胞活性,在应激反应后发生的细胞DNA损伤——有丝分裂前期的周期阻滞中发挥着重要作用[4]。14-3-3家族的成员σ在正常皮肤的基底细胞高表达,是上皮类细胞的标志分子[5];并且已经证实14-3-3σ在多种上皮来源的肿瘤中发挥了作用,通过与CDC2、cyclinB结合形成复合物影响细胞周期与细胞凋亡[6-8]。
有文献报道14-3-3σ基因受到包括P53在内的多种转录因子的直接调控,14-3-3σ蛋白反过来又能与P53等转录因子相螯合,通过以下3种可能途径影响转录因子发挥作用:(1)14-3-3σ蛋白与转录因子相螯合影响了转录因子与下游基因的DNA结合;(2)14-3-3σ蛋白与转录因子相螯合影响了转录因子自身的蛋白水解;(3)14-3-3σ蛋白与转录因子相螯合影响了转录因子与其他蛋白的相互作用[7,9-10]。但直至目前,14-3-3σ是否与另一个转录因子AP-2发生相互作用尚未见报道。
AP-2是一个重要的转录因子家族,它参与脊椎动物生长发育、细胞周期与细胞凋亡调节,病理状态下参与肿瘤的发生、发展。哺乳动物 AP-2家族存在5个亚型:AP-2α、AP-2β、AP-2γ、AP-2δ和 AP-2ε,其中,AP-2α与上皮组织关系密切,在成年小鼠中,AP-2α的表达主要集中在皮肤、前列腺、胸腺、眼睛和骨骼肌,AP-2β的表达主要集中在肾脏,AP-2γ主要在胎盘表达。在正常人上皮组织中,AP-2α在基底细胞层表达,AP-2γ在基底细胞、棘细胞和颗粒细胞层表达,而在上皮内未检测到 AP-2β的表达[11]。最近 研究 发 现 AP-2与乳腺癌[12,13]、卵巢癌[14]、肺癌[15]、睾丸癌[16]、黑色素瘤[17]等上皮来源的肿瘤相关,并通过调控细胞周期与凋亡途径参与肿瘤发生、发展。以前的研究也证实,AP-2α能促使宫颈鳞状上皮癌细胞系He-La细胞凋亡[18]。
由于AP-2α与14-3-3σ均在正常上皮组织高表达,它们在上皮来源的肿瘤中发挥了重要作用,因此,AP-2α与14-3-3σ可能在肿瘤发生、发展中存在密切联系。本研究对AP-2α在宫颈癌细胞系 HeLa细胞中调控14-3-3σ的作用进行了初步探讨,发现 AP-2α在 HeLa细胞内正调控14-3-3σ的 mRNA水平和蛋白水平。由于AP-2α是转录因子,通常是通过其蛋白的DNA结合域与下游基因启动子区域的AP-2结合位点相结合来直接调控下游基因的转录,因此,用软件分析了人14-3-3σ基因的启动子,结果发现在人14-3-3σ基因启动子区域转录起始位点上游-1 050bp至转录起始位点下游299bp之间,存在10个潜在的AP-2结合位点,双荧光素酶报告基因分析试验结果证实了AP-2α可以增强14-3-3σ启动子的转录活性。
本研究结果首次证实了AP-2α正调控HeLa细胞内14-3-3σ的表达,并揭示了这种调控作用可能是通过AP-2α增强14-3-3σ启动子的转录活性来完成的。为深入探讨AP-2α调控14-3-3σ的作用奠定了基础,为阐明 AP-2α和14-3-3σ在上皮肿瘤中的作用提供了新思路。
[1] Lodygin D,Hermeking H.The role of epigenetic inactivation of 14-3-3sigma in human cancer[J].Cell Res,2005,15(4):237-246.
[2] Kilani RT,Medina A,Aitken A,et al.Identification of different isoforms of 14-3-3protein family in human dermal and epidermal layers[J].Mol Cell Biochem,2008,314(1/2):161-169.
[3] Hermeking H,Benzinger A.14-3-3proteins in cell cycleregulation[J].Semin Cancer Biol,2006,16(3):183-192.
[4] van Heusden GP.14-3-3Proteins:insights from genome wide studies in yeast[J].Genomics,2009,94(5):287-293.
[5] Medina A,Ghaffari A,Kilani RT,et al.The role of stratifin in fibroblast-keratinocyte interaction[J].Mol Cell Biochem,2007,305(1/2):255-264.
[6] Xing H,Zhang S,Weinheimer C,et al.14-3-3proteins block apoptosis and differentially regulate MAPK cascades[J].Embo J,2000,19(3):349-358.
[7] Yang HY,Wen YY,Chen CH,et al.14-3-3sigma posi
tively regulates p53and suppresses tumor growth[J].Mol Cell Biol,2003,23(20):7096-7107.
[8] Li Z,Liu JY,Zhang JT.14-3-3sigma,the double-edged sword of human cancers[J].Am J Transl Res,2009,1(4):326-340.
[9] Rajagopalan S,Sade RS,Townsley FM,et al.Mechanistic differences in the transcriptional activation of p53by 14-3-3isoforms[J].Nucleic Acids Res,2010,38(3):893-906.
[10]Muhlmann G,Ofner D,Zitt M,et al.14-3-3sigma and p53 expression in gastric cancer and its clinical applications[J].Dis Markers,2010,29(1):21-29.
[11]Auman HJ,Nottoli T,Lakiza O,et al.Transcription factor AP-2gamma is essential in the extra-embryonic lineages for early postimplantation development[J].Development,2002,129(11):2733-2747.
[12]Powe DG,Akhtar G,Habashy HO,et al.Investigating AP-2and YY1protein expression as a cause of high HER2gene transcription in breast cancers with discordant HER2gene amplification[J].Breast Cancer Res,2009,11(6):R90.
[13]Berlato C,Chan KV,Price AM,et al.Alternative TFAP2A isoforms have distinct activities in breast cancer[J].Breast Cancer Res,2011,13(2):R23.
[14]Odegaard E,Staff AC,Kaern J,et al.The AP-2gamma transcription factor is upregulated in advanced-stage ovarian carcinoma[J].Gynecol Oncol,2006,100(3):462-468.
[15]Khattar NH,Lele SM,Kaetzel CS:Down-regulation of the polymeric immunoglobulin receptor in non-small cell lung carcinoma:correlation with dysregulated expression of the transcription factors USF and AP2[J].J Biomed Sci,2005,12(1):65-77.
[16]Hoei-Hansen CE,Nielsen JE,Almstrup K,et al.Transcription factor AP-2gamma is a developmentally regulated marker of testicular carcinoma in situ and germ cell tumors[J].Clin Cancer Res,2004,10(24):8521-8530.
[17]Braeuer RR,Zigler M,Villares GJ,et al.Transcriptional control of melanoma metastasis:the importance of the tumor microenvironment[J].Semin Cancer Biol,2011,21(2):83-88.
[18]Gan L,Zhu DX,Yang LP,et al.Involvement of transcription factor activator protein-2alpha in doxazosin-induced HeLa cell apoptosis[J].Acta Pharmacol Sin,2008,29(4):465-472.



