肖顺琼
(重庆市永川区中医院 402160)
组织缺氧导致三磷酸腺苷转化为二磷酸腺苷和磷酸腺苷,最终使嘌呤中间体和嘌呤代谢的最终产物,尿酸(UA)的释放[1-2]。一些研究表明,缺氧状态下患有慢性阻塞性肺疾病(COPD)的患者血清UA水平增加[3-5]。血清UA已经被认为是氧化代谢受损和受损预后的预测指标,如充血性心脏心力衰竭[6],肺血栓栓塞症[7],原发性肺动脉高压[8],艾森曼格综合征[9],或急性心肌梗死相关的未来产生不利影响[10]。
ATP降解产物UA主要经肾排除,用尿酸/肌酐(UA/Cr)的比值可纠正血液UA水平,减少对肾排泄率的影响[11-14]。Mahler和Harver[15]认为,在COPD患者中UA/Cr比单独血液UA水平更能提供某些信息,因此本研究选择UA/Cr作为主要研究参数,UA/Cr与COPD患者方面的研究数据不多,本研究目的就是评估UA/Cr的比值变化与COPD患者肺功能之间的关系。
1 资料与方法
1.1 一般资料 收集2007年1月至2010年9月在本院住院的118例COPD患者,平均年龄(66±7)岁,其中男81例,女37例。纳入标准:诊断符合国际指南(FEV1/FVC<70%),血氧饱和度大于90%,临床症状稳定(病情不加重至少1个月),无以下并发症如肾功能衰竭(Cr>1.5 mg/d L)、充血性心脏衰竭、肝脏疾病、糖尿病或甲状腺功能减退等,未使用全身性类固醇、利尿剂和细胞毒性药物。
1.2 方法 对COPD患者进行FVC、FEV1、UA、UA/Cr的比值水平的测定并进行分析,入院后清晨抽静脉血,采用美国全自动生化仪速力法测定。其他参数还包括肺功能(国产,BLF28RSFJ1000)呼吸困难,呼吸困难采用m MRC评分,评分范围为0(无呼吸困难)至4分(轻度活动伴有呼吸困难)。COPD分为4类如下:轻度,FEV1≥参考价值的80%,中度,50%≤FEV1<参考价值的80%;严重,30%≤FEV1<参考价值的50%;危重,FEV1<参考价值的30%。
1.3 统计学处理 统计分析数据以±s(SD)或百分比时表示。正态分布变量的Kolmogorov测试评估。组间差异采用配对t检验,Mann-Whitney U检验,χ2检验。血清UA、UA/Cr与FVC及FEV1之间采用Spearman秩相关。以P<0.05为差异有统计学意义。
2 结 果
2.1 UA>390μmol/L与UA≤390μmol/L两组比较 两组间FVC差异有统计学意义(P<0.05);两组间FEV1差异无统计学意义(P>0.05)。两组m MRC评分间差异无统计学意义(P>0.05)。两组间Cr水平均值为分别为(0.95±0.14)mg/d L、(1.04±0.17)mg/d L(P=0.002),见表1。
表1 UA>390μmol/L与UA≤390μmol/L比较(±s)

表1 UA>390μmol/L与UA≤390μmol/L比较(±s)
组别(μmol/L)nFEV1(%) FVC(%) m MRC评分(分)UA≤390 68 50±16 71±16 1.1±1.0 UA>390 50 48±18 60±17 1.3±1.0
2.2 中位数值UA/Cr>6.7与UA/Cr≤6.7两组比较 两组间FVC差异有统计学意义(P<0.05);两组间FEV1差异有统计学意义(P<0.05)。血清UA/Cr>6.7组患者的m MRC评分较UA/Cr≤6.7组患者的m MRC评分显着增高(P=0.012),见表2。
表2 UA/CR>6.7与UA/Cr≤6.7比较(±s)

表2 UA/CR>6.7与UA/Cr≤6.7比较(±s)
组别(μmol/L)nFEV1(%) FVC(%) mMRC评分(n)UA/CR≤6.7 56 55±18 73±15 0.8±1.0 UA/CR>6.7 62 43±19 63±18 1.5±1.1
表3 不同COPD患者UA及UA/Cr值(±s)

表3 不同COPD患者UA及UA/Cr值(±s)
组别nUA(μmol/L) UA/Cr轻度8 414±66 7.0±1.0中度 48 360±90 6.0±1.3重度 36 396±96 6.8±2.0危重26 432±102 7.6±1.8
2.3 COPD分组比较 分级越高,FVC及FEV1值越低,UA/CR比值越高。UA/CR的比值与FVC、FEV1呈负相关,(FVC:r=-0.29,P=0.04;FEV1:r=-0.33,P=0.02),与呼吸困难的严重程度呈正相关(r=0.29,P=0.03),见表3、4。UA与FVC、FEV1及呼吸困难的严重性无明显相关性(P>0.05),见表5。
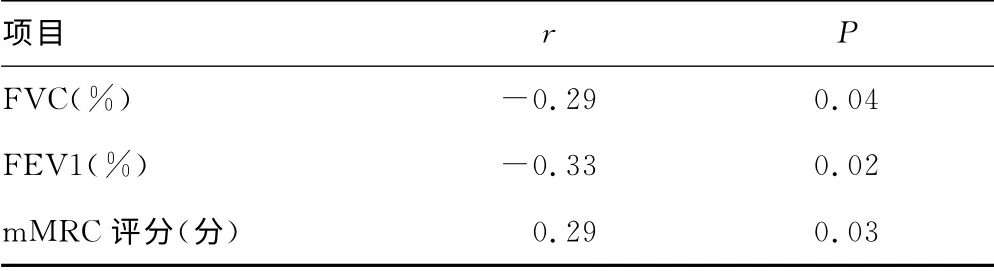
表4 UA/Cr与FVC及FEV1的相关性

表5 UA与FVC及FEV1的相关性
3 讨 论
首先,根据患者血清UA的中位数分组进行分析,两组患者间FEV1差异不明显,两组间FVC有明显差异。一般情况下,越严重的COPD患者的血清UA水平越高,但在本研究中未发现患者血清UA水平与FVC、FEV1、呼吸困难严重程度之间有显着相关性。然而,两组患者间的血清Cr水平存在明显差异,这可能是由于UA主要通过尿液排出的原因[17]。
接下来,笔者采用了血清UA/Cr这个参数进行研究,因为ATP降解产物UA主要经肾排除,用UA/Cr的比值可纠正血液UA水平,减少肾排泄率的影响[11-12]。本研究发现,与血清UA/Cr水平等于小于6.7的患者相比,血清UA/Cr水平在6.7(中位数值)以上的患者有较低的肺功能值和更严重的呼吸困难。
UA的增加是组织缺氧继发嘌呤分解代谢的结果。肺功能越差和呼吸功能越严重的COPD患者的缺氧和氧化代谢受损的风险更高,可惜的是在采用UA作为参数的研究中,缺乏活动时的通气受限和血氧饱和度下降方面的数据。
在缺氧状态条件下对血清UA水平的研究表明UA可以作为反映缺氧的一个指标。流行病学研究表明,UA是心血管疾病的危险因素,也是心脏衰竭损害预后的一个独立指标,是病死率增加的危险因素[6]。在肺血栓栓塞症患者,血清UA水平与栓塞的严重程度成正比。在肺动脉高压患者中,血清UA水平能独立反应与患者的长期死亡率。血清UA可增加成年艾森曼格综合征患者的血流动力学的严重程度,能独立反应患者死亡率。此外,血清UA水平是预测急性心肌梗死的指标之一。对COPD患者的血清UA水平的研究尚未明确,据了解,COPD患者的总抗氧化能力和UA水平显着高于健康人[18]。1项有110例COPD患者的研究显示低氧血症和UA水平(稳定和加剧的患者)之间有显着相关性,COPD的严重性和UA水平之间有显着相关性(在稳定的COPD患者)。在本研究中COPD患者的UA水平与FVC、FEV1、呼吸困难程度之间未发现显着相关性。
然而,一些研究者已经开始使用UA/Cr这一参数研究阻塞性睡眠呼吸暂停综合征和COPD。在日本接受家庭氧疗的COPD患者的研究中显示UA/Cr水平越高的患者,其死亡率也明显增高。其他的一些研究[5-8]未发现血清UA/Cr的比值和动脉血氧饱和度之间存在相关性,这是由于组织缺氧是由动脉血氧运输和组织对氧的需求之间的平衡决定的,氧的运输取决于由血红蛋白浓度、血红蛋白解离曲线、心输出量,组织血流量的分布,以及其他因素的影响。
血清UA水平和多种炎症标志物如C反应蛋白和白细胞介素6之间存在显着的相关性。最近的报道显示C反应蛋白与COPD预测指标动脉血氧分压和6 min步行距离之间存在独立相关性。鉴于这些研究结果UA/Cr值与FVC及FEV1成负相关与呼吸困难的严重程度呈正相关,笔者认为血清UA/Cr水平测定可作为COPD病情评估的指标之一。
[1]Elsayed NM,Nakashima JM,Poslethwait EM.Measurement of uric acid as a marker of oxygen tension in the lung[J].Arch Biochem Biophys,1993,302(1):228-232.
[2]Mateos Anton F,Garcia Puig J,Gomez Fernandez P,et al.Degradation of purine nucleotides in patients with chronic airflow obstruction[J].Med Clin(Barc),1989,92(9):328-330.
[3]Braghiroli A,Sacco C,Erbetta M,et al.Overnight urinary acid/creatinine ratio for detection of sleep hypoxemia:validation study in chronic obstructive pulmonary disease and obstructive sleep apnea before and after treatment with nasal continuous positive airway pressure[J].Am Rev Respir Dis,1993,148(1):173-178.
[4]Lewis JG,Gardner JE.The relation of serum uric acid to haemoglobin level in patients with cardiac and respiratory disease[J].Clin Pathol,1960,13:502-505.
[5]Saito H,Nishimura M,Shibuya E,et al.Tissue hypoxia in sleep apnea syndrome assessed by uric acid and adenosine[J].Chest,2002,122(5):1686-1694.
[6]Anker SD,Doehner W,Rauchhaus M,et al.Uric acid and survival in chronic heart failure:validation and application in metabolic,functional,and hemodynamic staging[J].Circulation,2003,107(15):1991-1997.
[7]Shimizu Y,Nagaya N,Satoh T,et al.Serum acid uric level increases in proportion to the severity of pulmonary thromboembolism[J].Circ J,2002,66(6):571-575.
[8]Nagaya N,Uematsu M,Satoh T,et al.Serum uric acid levels correlate with the severity and the mortality of primary pulmonary hypertension[J].Am J Respir Crit Care Med,1999,160(2):487-492.
[9]Oya H,Nagaya N,Satoh T,et al.Haemodynamic correlates and prognostic singificance of acid uric in adult patients with Eisenmeneger syndrome[J].Heart,2000,84(1):53-58.
[10]Kojima S,Sakamoto T,Ishihara M,et al.Prognostic usefulness of serum uric acid after acute myocardial infarction.The Japanese Acute Coronary Syndrome Study[J].Am J Cardiol,2005,96(4):489-495.
[11]蒋萍.COPD急发期患者血清UA水平的相关性研究[J].临床肺科杂志,2008,13(12):1565-1567.
[12]Garcia-Paehon E,Padilla-Navas I,Shum C.Serum Uric Acid toCreatinine Ratio in Patients with Chronie Ob-structive Pulmonary Disease[J].Lung,2007,185:21-24.
[13]Garcia Pachon E,Padilla-Navas I,Shum C.Uric Acid:lts relationship to creatinine levels and hyPoxia[J].Arch Broneoneumol,2007,43(9):523-525.
[14]Celli B,Mac Nee W.Standards for the diagnosis and treatment of patients with COPD:a summary of the ATS/ERS position paper[J].Eur Respir J,2004,23(6):932-946.
[15]Mahler DA,Harver A.A factor analysis of dyspnea ratings,respiratory muscle strength,and lung function patients with chronic obstructive pulmonary disease[J].Am Rev Respir Dis,1992,145(2Pt1):467-470.



