胡建刚,晏 怡,覃 川,李柏成,张 彪,张正保,杨秀江△
(1.重庆市大足区人民医院神经外科 402360;2.重庆医科大学附属第一医院神经外科 400016)
胶质瘤是最常见的颅内恶性肿瘤,目前临床诊断主要是依赖头颅CT或MRI,但即使是目前最先进的MRI检查,也不能完全确诊,尤其是那些影像学不典型的病例,所以,寻找血清标志物对胶质瘤的早期诊断具有重要意义。作者在前期工作中发现胶质瘤患者血清胰岛素样生长因子(insulin-like growth factor-1,IGF-1)水平在术前、术后有显着差异,本文则通过对颅内肿瘤和健康人群血清IGF-1进行定量检测,运用ROC曲线评价IGF-1在诊断胶质瘤中的应用价值。
1 资料与方法
1.1一般资料 选取2010年12月至2011年11月在本院接受手术治疗的脑胶质瘤患者40例;其中男21例,女19例,年龄31~68岁,平均(45.32±8.34)岁,术后经病理检查确诊均为脑胶质瘤患者。其中毛细胞星形细胞瘤3例,弥漫性星形细胞瘤5例,室管膜瘤2例,少枝胶质细胞瘤2例,混合型的少枝星形细胞瘤4例,中间变性星形细胞瘤8例,间变性少枝星形细胞瘤7例,胶质母细胞瘤6例,间变性室管膜瘤3例。随机抽取同期入院的40例颅内非胶质来源肿瘤患者作为非胶质来源肿瘤组;其中男23例,女17例,平均年龄(40.32±5.24)岁;其中垂体瘤13例,脑膜瘤11例,神经鞘瘤9例,中枢神经细胞瘤2例,胆脂瘤2例,海绵状血管瘤3例。抽取同期本院体检的40例健康人作为对照组,其中男21例,女19例,平均年龄(42.26±6.52)岁。各实验组与对照组间年龄、性别比较差异无统计学意义,具有可比性。
1.2方法 分别抽取脑胶质细胞瘤患者、颅内非胶质来源肿瘤患者、健康人空腹静脉血3 mL,静置2 h,2 000 r/min离心10 min分离血清,-20 ℃冰箱冷藏备检。用双抗体一步夹心法测定血清IGF-1含量,试剂盒购于帝肯(上海)贸易有限公司,操作严格按说明书进行。
1.3统计学处理 采用SAS9.1统计软件进行数据分析。所有的参数平均水平用中位±四分位间距(M±Q)来表示。各组血清浓度之间的比较采用Wilcoxon符号秩检验。以P<0.05为差异有统计学意义。确定ROC曲线下面积(AUC)、诊断临界值、诊断敏感度和诊断特异度。
2 结 果
2.13组人群血清IGF-1水平的比较 经Wilcoxon符号秩检验发现,非胶质来源肿瘤组(37.77±46.29)μg/L和健康对照组(26.98±27.63)μg/L之间差异无统计学意义(z=-1.62,P>0.05)(表1),胶质瘤组(643.13±792.19)μg/L显着高于非胶质来源肿瘤组与健康对照组(63.52±101.53)μg/L(z=7.61,P<0.01)(表2)。
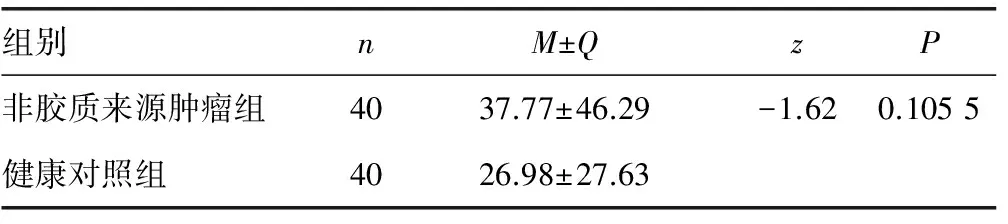
表1 非胶质来源肿瘤组与健康对照组的IGF-1血清浓度比较

表2 胶质瘤组与非胶质来源肿瘤组、健康组的IGF-1血清浓度比较
2.2IGF-1诊断胶质瘤的参数 ROC曲线下面积(AUC)=0.831(95%CI 0.745~0.917),通过ROC曲线确定的诊断临界值为110.425 μg/L,其诊断敏感度为90%,诊断特异度为92.3%,阳性预期值为87.5%,阴性预期值为92.3%,正确率为90.5%,Youden值为82.3%,见图1。
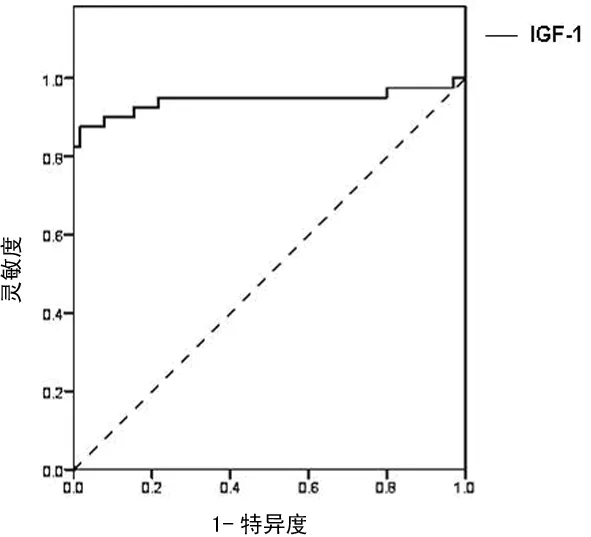
图1 IGF-1对胶质瘤的ROC曲线
3 讨 论
胶质瘤是起源于神经间胶质、室管膜、脉络丛上皮、神经元等,占颅内肿瘤40%左右,发病机制至今未明。胶质瘤具有发病率、复发率、死亡率高和治愈率低等特点。近年来,随着影像学诊断技术的进步和显微神经外科技术的发展,胶质瘤的诊断和治疗总体上有了进步。然而,胶质瘤病变早期表现常不典型,常常有一定的漏诊或误诊,而且即使发现胶质瘤,患者往往已处于晚期,因此,寻找胶质瘤标志物成为当前研究热点。IGF-1是有丝分裂原,有促进细胞增殖、分化的作用,是促进肿瘤生长的重要因子之一[1]。血清及组织中IGF-l过度表达时引起正常细胞活性改变,出现增殖失控、分化缺失及凋亡减少,导致恶性肿瘤的发生、发展[2]。多种类型的肿瘤如肺癌、乳腺癌、肝癌、大肠癌组织中均可异常表达IGF-1[3-5],Renehan等[6]认为IGF-1的表达水平因肿瘤类型及部位不同而不同,并可作为癌症风险及预后的评估指标。在神经系统方面,国外研究认为IGF-1在幼年时可促进人脑的正常发育,其基因的缺失或表达不足与大脑发育不全及智力障碍有关[7-9]。Godau等[10]研究认为血清IGF-1水平与神经退行性变密切相关,可作为帕金森氏病的诊断诊断指标之一。而目前关于脑胶质瘤与IGF-1的表达研究方面,国内外报道均较少。
Sandberg等[11]用免疫组化方法证实在10例胶质瘤中7例有IGF-1的表达,发现IGF-1的表达强度和胶质瘤的恶性程度呈正相关。Rohrmann等[12]用ELISA法检测了上百例颅内肿瘤患者的血清IGF-1水平,发现胶质瘤患者血清中IGF-1水平普遍较高,而在脑膜瘤患者血清中,其水平升高的现象并未发现。作者曾报道胶质瘤患者血清IGF-1从术前的高表达降为术后的低表达,差异具有显着性,监测IGF-1的表达水平可反映胶质瘤的病情变化和治疗反应,可用于预测肿瘤复发及预后评估的指标[13]。本文选取胶质瘤、非胶质来源肿瘤及健康对照组各40例。采用ELISA法对3组患者血清中的IGF-1进行了定量检测,结果表明胶质瘤患者血清IGF-1水平非常显着地高于非胶质来源肿瘤及健康对照组,非胶质来源肿瘤则与健康对照组无显着性差异。说明IGF-1的高表达与胶质瘤关系十分密切,可望成为胶质瘤的早期诊断标志物之一。
一般来说,AUC越大,诊断实验的鉴别能力越强,完全无价值的实验AUC为0.5,理想的诊断试验AUC为1,AUC在0.5~0.7时诊断价值较低,0.7~0.9时诊断价值中等,0.9以上表明诊断价值较高[14]。通过实验,本研究发现IGF-1在诊断胶质瘤中的AUC为0.831,表明IGF-1对于胶质瘤具有中等诊断价值。通过对胶质瘤组、非胶质来源肿瘤组和健康对照组人群血清IGF-1进行定量检测,发现胶质瘤组血清IGF-1水平明显高于其他两组,表明胶质瘤患者可以通过检测血清IGF-1指标来与非胶质来源肿瘤患者以及健康人群进行初步鉴别诊断。实验结果表明,当诊断临界值设为110.425 μg/L时,可以获得较高的诊断敏感度和诊断特异度,其Youden值也最大,同时也获得了较高的阴性预期值,但是其阳性预期值仅为87.5%,说明当以110.425 μg/L作为胶质瘤的诊断临界值时可能存在着较高的假阳性。
由于多种恶性肿瘤均可造成IGF-1不同程度升高,该指标敏感性高,特异性相对较低,对于早期诊断胶质瘤尚不能成为独立的金标准。故作者认为找出另一种或多种胶质瘤相关的血清标志物与IGF-1联合检测更具有意义。
[1]Khandwala HM,McCutcheon IE,Flyvbjerg A,et al.The effects of insulin-like growth factors on tumorigenesis and neoplastic growth[J].Endocr Rev,2000,21(3):215-244.
[2]Jo H,Jia Y,Subramanian KK,et al.Cancer cell-derived clusterin modulates the phosphatidy Iinoitol 3′-kinase-Akt pathway through attenuation of insulin-like growth factor 1 during serum deprivation[J].Mol Cell Biol,2008,28(13):4285-4299.
[3]Rinaldi S,Cleveland R,Norat T,et al.Serum levels of IGF-I,IGFBP-3 and colorectal cancer risk:results from the EPIC cohort,plusameta-analysis of prospective studies[J].Int J Cancer,2010,126(7):1702-1715.
[4]Roddam AW,Allen NE,Appleby P,et al.Insulin-like growth factors,their binding proteins,and prostate cancer risk:analysis of individual patient data from 12 prospective studies[J].Ann Intern Med,2008,149(7):461-471.
[5]GalanP,KeyTJ,ApplebyPN,etal.Insulin-likegrowthfactor-1(IGF-1),IGFbindingprotein3
(IGFBP3),and breast cancer risk:pooled individual data analysis of 17 prospective studies[J].Lancet Oncol,2010,11(6):530-542.
[6]Renehan AG,Zwahlen M,Minder C,et al.Insulin-like growth factor(IGF-1),IGF binding protein-3,and cancer risk:systematic review and meta-regression analysis[J].Lancet,2004,363(9418):1346-1353.
[7]Joseph D,Ercole A,Ye P.Expanding the mind:insulin-like growth factor 1 and brain development[J].Endocrinology,2008,149(12):5958-5962.
[8]Murialdo G,Barreca A,Nobili F,et al.Relationships between cortiso1,dehydroepiandrosterone sulphate and insulin-like growth factor-1 sysytem in dementia[J].J Endocrinol Invest,2001,24(3):139-146.
[9]Arai Y,Hirose N,Yamamura K,et al.Serum insulin-like growth factor l in centenarians:implications of IGF-1 as a rapid turnover protein[J].J Gerontol A Biol Sci Med Sci,2001,56(2):M79-82.
[10]Godau J,Knauel K,Weber K,et al.Serum insulinlike growth factor 1 as possible marker for risk and early diagnosis of Parkinson disease[J].Arch Neurol,2011,68(7):925-931.
[11]Sandberg NAC,von Hoist H,Holmin S,et al.Increase of insulin-like growth factor 1,IGF binding protein-2 and -4 mRNAs following cerebral contusion[J].Brain Res Mol Brain Res,1996,38(2):285-293.
[12]Rohrmann S,Linseisen J,Becker S,et al.Concentrations of IGF-1 and IGFBP-3 and brain tumor risk in the european prospective investigation into cancer and nutrition[J].Cancer Epidemiol Biomarkers Prev,2011,20(10):2174-2182.
[13]覃川,黎成禄,谢惠,等.胶质瘤患者血清IGF-1的表达及临床意义[J].重庆医学,2009,38(15):1941-1942.
[14]王敬瀚.ROC曲线在临床医学诊断实验中的应用[J].中华高血压杂志,2008,16(2):175-177.



