张战民,张晓华
(南昌大学第一附属医院肿瘤科,南昌 330006)
Wnt信号通路是一个复杂的蛋白质作用通路,其参与细胞的增殖、分化、代谢及凋亡,是细胞发育所必需的[1],调节着细胞行为及细胞的相互作用,因此,此通路不仅在胚胎发育调控中起至关重要的作用,而且与肿瘤的发生和发展密切相关[2]。研究表明,Wnt信号通路与多种肿瘤的的生长、复发和耐药有着密切的关系[3-4]。本研究通过沉默Wnt1基因的表达,观察乳腺癌细胞对多柔比星敏感性的变化,为寻找克服乳腺癌耐药性的新靶点提供依据,现将研究结果报道如下。
1 材料与方法
1.1材料 人乳腺癌MCF-7/ADR细胞株由中国医学科学院血液学研究所提供,此细胞株的原代培养细胞供体均一,取材部位及组织类型稳定,为已鉴定细胞;PRMI 1640培养基和胎牛血清购于美国Gibco公司,四甲基偶氮唑盐(MTT)、青霉素、链霉素、多柔比星为美国Sigma公司产品,总RNA提取试剂盒采用美国Promega公司产品,逆转录聚合酶链反应(RT-PCR)试剂盒为日本Takara公司生产,Lipofectamine 2000转染试剂盒购自美国Invitrogen公司,Wnt1 siRNA双链干扰序列由上海吉玛制药技术有限公司合成。
1.2方法
1.2.1MCF-7/ADR细胞在Wnt1基因沉默前后对多柔比星耐药性的比较
1.2.1.1MCF-7/ADR细胞的培养 采用含10%胎牛血清,100 U/mL青霉素,100 U/mL链霉素、RPMI 1640的完全培养基,在37 ℃、5%CO2的饱和湿度条件下培养,每2~3 d换液并传代1次,采用0.02%乙二胺四乙酸二钠(EDTA-Na2和0.25%胰蛋白酶的1∶1混合液进行消化,且使多柔比星梯度诱导浓度最终维持在1 μg/mL。
1.2.1.2细胞总RNA的提取及光密度值的测定 培养出的MCF-7/ADR细胞每(1~5)×106个细胞加1 mL TRIzol试剂,吸管吹吸数次,15~30 ℃孵育5 min后,加0.2 mL氯仿,摇匀15 s,15~30 ℃孵育2~3 min,4 ℃离心15 min(离心半径8 cm,12 000 r/min)。上清液移入另一EP管内,加入0.5 mL异丙醇,4 ℃离心10 min(离心半径8 cm,12 000 r/min),加75%乙醇1 mL,震荡混匀,4 ℃离心5 min(离心半径8 cm,7 500 r/min),吸去上清液,晾干5~10 min,加入焦碳酸二乙酯(DEPC)水溶解,55~60 ℃促溶10 min。采用紫外分光光度计测定细胞总RNA在260 nm和280 nm处的吸光度(A)值,计算RNA的含量和纯度。所有样品的A260/A280均介于1.9~2.1之间,并根据260 nm吸光度定量。
1.2.1.3RT-PCR的检测 取DEPC处理过的细胞溶液0.2 mL,加入下列反应组分:2.6 μg RNA、1 μL随机引物(50 ng/μL),1 μL三磷酸脱氧核糖核苷(dNTP)10 mmol,4 μL 5×RT缓冲液,1 μL高效率逆转录酶(日本ReverTra Ace公司),DEPC溶液补足至20 μL,室温放置10 min,37 ℃保温30 min,95 ℃ 5 min使酶失活,置于4 ℃ 1~5 min,完成cDNA的合成,所得cDNA产物于-20 ℃保存。于0.2 mL PCR反应管中加入下列反应组分:2 μL cDNA、2.25 μL 10×PCR缓冲液、0.5 μL dNTP(10 mmol)、25 pmol上游Wnt1引物、25 pmol下游Wnt1引物或0.5 μL甘油醛-3-磷酸脱氢酶(GAPDH)引物,0.5 μL TaqDNA聚合酶,灭菌水补足至25 μL。Wnt1及β-actin的引物序列(表1),扩增反应条件:94 ℃预变性2 min,94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸45 s,扩增30个循环;72 ℃延伸10 min,4 ℃终止反应,1.5%琼脂糖凝胶电泳45 min。
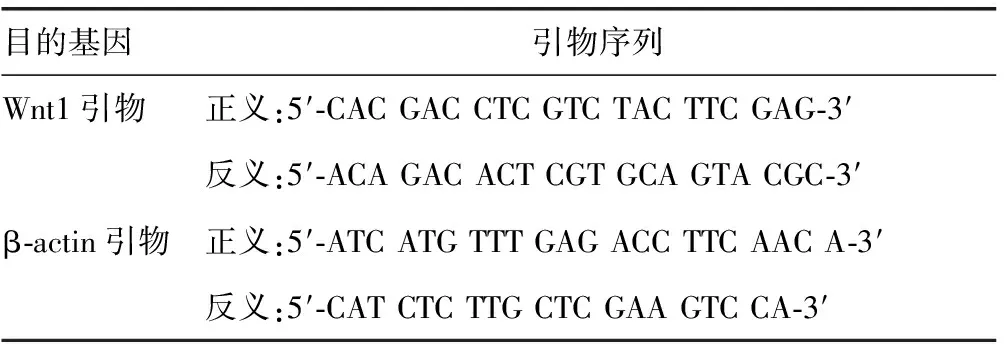
表1 引物序列
1.2.1.4RNA干扰实验 MCF-7/ADR细胞接种于6孔板,当细胞达到50%融合时,按照Lipofectamine 2000转染试剂盒说明书进行基因转染实验。化学合成的靶向Wnt1亚基的siRNA 双链干扰序列为:5′-CCU CGU CUA CUU CGA GAA ATT-3′(正义链),5′-UUU CUC GAA GUA GAC GAG GT-3′(反义链) 。
1.2.1.5MCF-7/ADR细胞的生长抑制实验 将MCF-7/ADR细胞分为4组,(1)对照组:细胞中只采用培养基进行培养;(2)Wnt1沉默组:MCF-7/ADR细胞加siRNA干扰处理;(3)多柔比星组:用多柔比星处理MCF-7/ADR细胞;(4)Wnt1沉默联合多柔比星组:Wnt1沉默MCF-7/ADR后用多柔比星处理 。将细胞制成单细胞悬液,以每孔2×105个细胞接种于96孔培养板中,各组分设3个复孔,在37 ℃、5% CO2的饱和湿度下培养24 h,细胞贴壁后加入终浓度为20 μg/mL的多柔比星,继续培养24 h,每孔加入0.5 mg/mL MTT反应4 h,弃去培养基,加入二甲基亚砜(DMSO)100 μL,震荡10 min,使结晶物充分溶解,实验重复3次。选择570 nm波长,在酶联免疫检测仪上测定各孔A值,计算细胞生长抑制率,比较Wnt1基因沉默前、后MCF-7/ADR细胞对多柔比星耐药性的变化。细胞抑制率=[1-实验组A值/对照组A值]×100%。
1.2.2免疫印迹法(Western blotting)检测蛋白的表达 将各组细胞重悬,分别收集1×106个细胞用磷酸盐缓冲液(PBS)洗涤1次,离心去除上清液,加入细胞裂解液,室温匀浆1 min,然后4 ℃离心15 min。取上清液作为样品。5%聚丙烯酰胺凝胶上电泳分离,离心10 min(离心半径8 cm,12 000 r/min),上清液即为细胞总蛋白。50 μg细胞总蛋白行十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE),80~120 V电泳2 h,80 V转印2 h;PBS洗膜10 min,加入包被液封闭过夜;再用PBS洗膜3次,加入 第一抗体(1∶400)和β-actin鼠抗人单克隆抗体(1∶400),室温孵育2 h;PBS洗膜2次,与第二抗体室温孵育2 h;PBS洗膜2次,加入显色液显色15 min,显色的硝酸纤维素膜经UPV扫描仪扫描成像。
2 结 果
2.1Wnt1基因沉默前后MCF-7/ADR细胞对多柔比星敏感性的变化 对照组、Wnt1沉默组、多柔比星组及Wnt1沉默联合多柔比星组的细胞存活率分别为(100.0±5.2)%、(84.3±4.1)%、(68.7±4.7)%和(42.3±3.5)%,其中,Wnt1沉默组、多柔比星组及Wnt1沉默联合多柔比星组细胞的存活率与对照组比较,差异有统计学意义(F=5.381,P<0.05),Wnt1沉默联合多柔比星组细胞的存活率最低。
2.2Wnt1基因沉默前后MCF-7/ADR细胞中Wnt1基因及蛋白质的表达 RT-PCR检测结果显示,空白对照组、脂质体对照组及阴性对照组MCF-7/ADR细胞中Wnt1 mRNA的扩增产物呈清晰条带;用化学合成的双链siRNA沉默Wnt1基因,转染48 h后收集细胞,MCF-7/ADR细胞中Wnt1 mRNA的表达明显下调(图1)。Western blotting检测上述4组Wnt1蛋白的表达情况,发现其与Wnt1基因mRNA表达的变化一致,说明siRNA转然后抑制了Wnt1基因的转录过程,同时也抑制了相应蛋白的翻译和表达,见图1。

1:空白对照组;2:脂质体对照组;3:阴性对照组;4:Wnt1 siRNA转染组。
3 讨 论
肿瘤多药耐药(MDR)是临床恶性肿瘤化疗的主要障碍,也是乳腺癌患者化疗失败、复发转移的主要原因[5]。MDR发生机制复杂,已有许多研究阐述了乳腺癌化疗耐药的机制,如P-糖蛋白(P-gp)[6]、多药耐药相关蛋白(MRP)[7]和乳腺癌耐药蛋白的过表达[8],导致肿瘤细胞内化疗药物的浓度降低以及谷肤甘肤S转移酶(GSTS)酶性解毒作用的增强等[9]。随着细胞技术的成熟,细胞信号通路与肿瘤多药耐药的关系已成为MDR机制和逆转治疗研究的新亮点。
近年来的研究表明,Wnt/β-catenin信号通路的激活,参与了肿瘤的发生及其侵袭转移的过程,而且还与肿瘤干细胞的关系密切,是调控肿瘤干细胞增殖与分化的一个重要信号通路[10-11]。Milovanovic等[12]在研究中用原位RNA杂交法检测了正常乳腺组织和恶性乳腺癌组织的Wnt配体Wnt1、Wnt2、Wnt4、Wnt5a、Wnt5b、Wnt6、Wnt7和Wnt10b的表达情况,发现Wnt1和Wnt6在正常和恶性组织中均强烈表达,Wnt7b在乳腺癌组织中下调。目前,认为,Wnt通路致癌的关键是β-catenin降解障碍致使胞浆内游离的β-catenin聚集并与Tcf/Lef结合进入细胞核,激活下游靶基因Cyclin D1、C-myc的转录,导致肿瘤的发生。Cyclin D1是调节细胞进入细胞周期中增生期的主要因子,已被证实为原癌基因,其过度表达和失调控均可导致细胞周期调控异常从而发生肿瘤[13-15]。鉴于Wnt1在小鼠乳腺癌中的作用和人类乳腺癌中的表达,本文检测了Wnt1基因的mRNA在乳腺癌多药耐药细胞株MCF-7细胞中的表达,经RT-PCR检测结果发现Wnt1在乳腺癌细胞呈高表达,使用化学合成的双链siRNA沉默Wnt1基因,可显着下调Wnt1 mRNA的表达,Wnt1蛋白的表达也明显减弱,说明siRNA转染后抑制了Wnt1基因的转录过程,同时也抑制了相应蛋白的翻译和表达。本研究通过MTT试验发现,沉默后的MCF-7/ADR细胞对多柔比星的敏感性明显增强,表明沉默Wnt1基因可以部分逆转MCF-7/ADR细胞对多柔比星的耐药性。
综上所述,Wnt1基因在乳腺癌细胞呈高表达,沉默Wnt1基因下调Wnt1基因的转录和翻译,能显着增强乳腺癌细胞对多柔比星的敏感性,部分逆转其对多柔比星的耐药性,说明Wnt/β-catenin信号通路可能在乳腺癌多药耐药中具有重要作用,为寻求克服MDR开辟了新的方向。
[1]Nusse R.Wnt signaling in disease and in development[J].Cell,2005,15(1):28-32.
[2]Santos A,Bakker AD,Zandieh-Doulabi B,et al.Pulsating fluid flow modulates gene expression of proteins involved in Wnt signaling pathways in osteocytes[J].J Orthop Res,2009,27(10):1280-1287.
[3]Fodde R,Brabletz T.Wnt/beta-catenin signaling in cancer stemness and malignant behavior[J].Curr Opin Cell Bio,2007,19(2):150-158.
[4]肖若芝,陈琰,王立琳,等.索拉非尼通过抑制WNT信号通路诱导白血病细胞株U937凋亡[J].中国实验血液学杂志,2011,19(2):353-357.
[5]Putzke AP,Rothman JH.Repression of Wnt signaling by a Fer-type nonreceptor tyrosine kinase[J].Proc Natl Acad Sci U S A,2010,107(37):16154-16159.
[6]Steele BM,Harper MT,Macaulay IC,et al.Canonical Wnt signaling negatively regulates platelet function[J].Proc Natl Acad Sci U S A,2009,106(47):19836-19841.
[7]Watanabe K,Dai X.Winning WNT:race to Wnt signaling inhibitor[J].Proc Natl Acad Sci U S A,2011,108(15):5929-5930.
[8]Cselenyi CS,Jernigan KK,Tahinci E,et al.LRP6 transduces a canonical Wnt signal independently of Axin degradation by inhibiting GSK3′s phosphorylation of beta-catenin[J].Proc Natl Acad Sci U S A,2008,105(23):8032-8037.
[9]Cadigan KM,Nusse R.Wnt signaling:a common theme in animal development[J].Genes Deve,1997,11(24):3286-3305.
[10]Woodward WA,Chen MS,Behbod F,et al.WNT/beta-catenin mediates radiation resistance of mouse mammary progenitor cells[J].Proc Natl Acad Sci U S A,2007,104(2):618-623.
[11]Wang YZ,Krivtsov AV,Sinha AU,et al.The Wnt/beta-catenin pathway is required for the development of leukemia stem cells in AML[J].Science,2010,327(5973):1650-1653.
[12]Milovanovic T,Planutis K,Nguyen A,et al.Expression of Wnt genes and frizzled 1 and 2 receptors in normal breast epithelium and infiltrating breast carcinoma[J].Int J Oncol,2004,25(5):1337-1342.
[13]Bala S,Peltomäki P.CYCLIN D1 as a genetic modifier in hereditary nonpolyposis colorectal cancer[J].Cancer Res,2001,61(16):6042-6045.
[14]柳华,彭芝兰.Wnt信号传导通路与妇科肿瘤[J].现代妇产科进展,2009,18(1):60-62.
[15]Reya T,Clevers H.Wnt signalling in stem cells and cancer[J].Nature,2005,434(7035):843-850.



