张云宁,石培民,谢 静
(扬州大学附属泰兴医院:1.检验科;2.血液科,江苏泰兴225400)
近年来新技术、新的抑癌药物不断涌现,但复发、难治性白血病的治疗,仍然是个难题。紫杉醇作为一种新一代植物碱类抗肿瘤药物,主要是通过作用于微管系统而抑制细胞分裂,被广泛用于卵巢癌、乳腺癌、黑素癌、肺癌的治疗。现将本研究通过体外观察紫杉醇对人急性单核细胞白血病细胞株SHI-1的增殖抑制、诱导凋亡及诱导分化的作用报道如下。
1 材料与方法
1.1 材料 SHI-1由苏州大学附属第一医院、江苏省血液研究所惠赠;紫杉醇为江苏扬子江药业集团产品;IMDM培养基为赛默飞世尔生物化学制品有限公司产品,胎牛血清为杭州四季青生物工程材料有限公司产品;DNA倍体分析试剂盒、异硫氰酸荧光黄(Annexin-V-FITC)、碘化丙啶(propidium iodide,PI)细胞 凋 亡 试 剂 盒、JC-1(5,5′,6,6′-tetrachloro-1,1′,3,3′-tetraethylbenzimidazolcarbocyanine iodide)细胞凋亡试剂盒购自南京凯基生物科技发展有限公司。
1.2 实验方法
1.2.1 细胞培养 将SHI-1细胞培养于含10%胎牛血清的IMDM培养液中,置37℃、饱和湿度、含5%CO2的恒温培养箱内培养。2~3d更换培养液1次或根据培养液的颜色进行更换。取对数生长期的细胞进行实验。
1.2.2 细胞活力和形态学观察 取对数生长期的细胞,以1×105/mL的细胞密度接种于24孔板中,每孔1mL,置37℃、5%CO2、饱和湿度的培养箱中培养。再分别加入不同浓度的紫杉醇,使紫杉醇的终浓度分别为5、0.5、0.05、0.005mg/L组,同时设不加药物的空白对照组。每组设3个复孔。继续培养12、24、36、48h。用磷酸盐缓冲液(phosphate buffer solution,PBS)洗涤2次后,用0.4%台盼蓝直接染色2~10min,在显微镜下计数活细胞数。每次计数3次,实验重复3次。细胞活率=[活细胞数/活细胞+死细胞数]×100%。取空白对照组和药物作用后的各组细胞先在倒置显微镜下观察,再将细胞悬液离心涂片,用瑞氏姬姆萨染色液染色,光学显微镜下观察细胞形态变化。
1.2.3 DNA倍体分析 取各组经过药物处理后的细胞悬液检测DNA倍体。加入20μL PI染液,避光孵育30min后,上流式细胞仪检测,分析后用Modfit软件进行DNA倍体分析,计算出各期细胞的百分比。每组实验重复3次。
1.2.4 Annexin V/PI标记染色测定凋亡细胞 取24孔板中的各组经过药物处理后的细胞悬液,采集1×106个细胞,用冷PBS液洗1遍后再0℃水浴,加入400μL结合缓冲液后,轻轻混匀细胞后加入5μL Annexin V-FITC和5μL PI液,避光孵育15min后,用流式细胞仪检测。每组实验重复3次,绘制时效曲线。
1.2.5 JC-1染色检测细胞线粒体跨膜电位(△Ψm) 将2×105/mL细胞悬液加入JC-1荧光染液5μL充分混匀,置37℃、5%CO2的培养箱中,避光孵育20min,离心去除上清液并用PBS液洗涤2次,流式细胞仪检测,以BD公司FACSDiva软件分析结果。
1.3 统计学处理 应用SPSS13.0统计软件进行分析处理,计量资料以±s表示。组间比较采用t检验,以P<0.05为差异有统计学意义。
2 结 果
2.1 显微镜下观察紫杉醇诱导SHI-1细胞凋亡 倒置相差显微镜下,空白对照组SHI-1细胞呈梭形,形态均一,可成簇生长。较低浓度的紫杉醇药物组可观察到SHI-1细胞皱缩变小、胞体变圆,出现细胞碎片,未见细胞成簇生长。经瑞氏姬姆萨染色油镜下观察,细胞形态出现核固缩、核边聚、核碎裂,胞膜出泡,并可见典型的凋亡小体等。
2.2 细胞活力测定 紫杉醇作用于SHI-1细胞后,随着作用剂量和时间的增加,细胞增殖率明显受到抑制,细胞活率也显着减少,呈现剂量和时间的量效关系(图1)。
2.3 紫杉醇对SHI-1细胞凋亡的影响和对SHI-1线粒体跨膜点位(△Ψm)的影响 见表1~2。紫杉醇对SHI-1细胞周期的影响见图2。
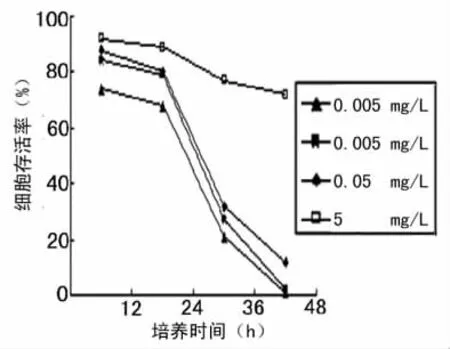
图1 不同浓度紫杉醇作用SHI-1细胞存活率
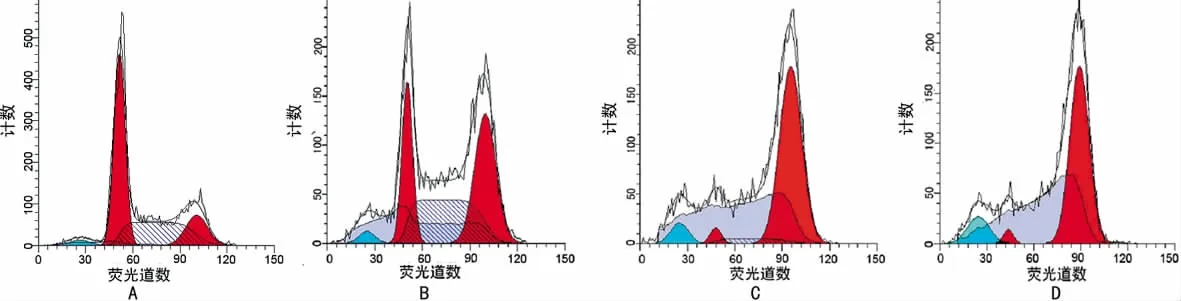
图2 0.05mg/L浓度的紫杉醇对SHI-1细胞周期的影响
表1 紫杉醇作用12、24、36、48h后SHI-1细胞的凋亡率比较(n=3,%,±s)
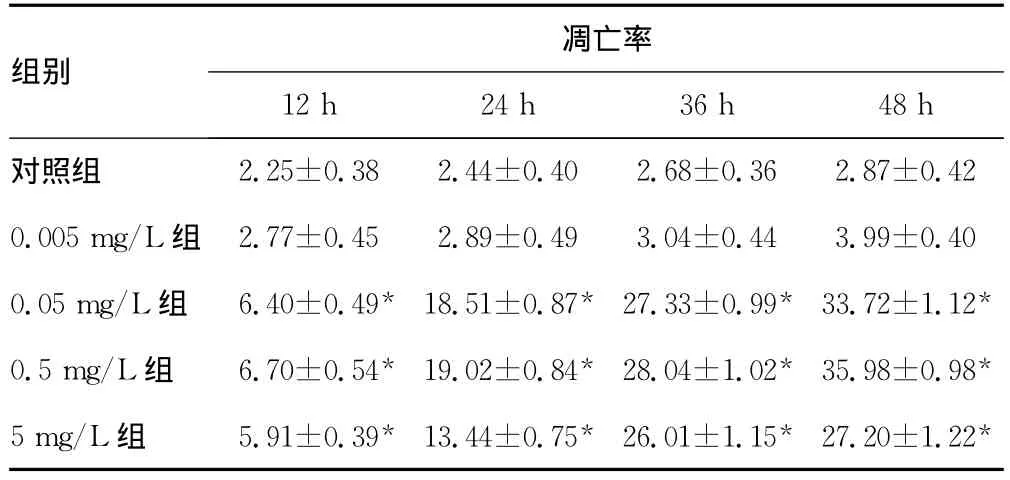
表1 紫杉醇作用12、24、36、48h后SHI-1细胞的凋亡率比较(n=3,%,±s)
*:P<0.05,与对照组和0.005mg/L组比较。
凋亡率组别2.25±0.38 2.44±0.40 2.68±0.36 2.87±0.42 0.005mg/L组 2.77±0.45 2.89±0.49 3.04±0.44 3.99±0.40 0.05mg/L组 6.40±0.49* 18.51±0.87* 27.33±0.99* 33.72±1.12*0.5mg/L组 6.70±0.54* 19.02±0.84* 28.04±1.02* 35.98±0.98*5mg/L组 5.91±0.39* 13.44±0.75* 26.01±1.15* 27.20±1.22 12h 24h 36h 48h对照组*
表2 紫杉醇作用SHI-1细胞ΔΨm的影响(±s)
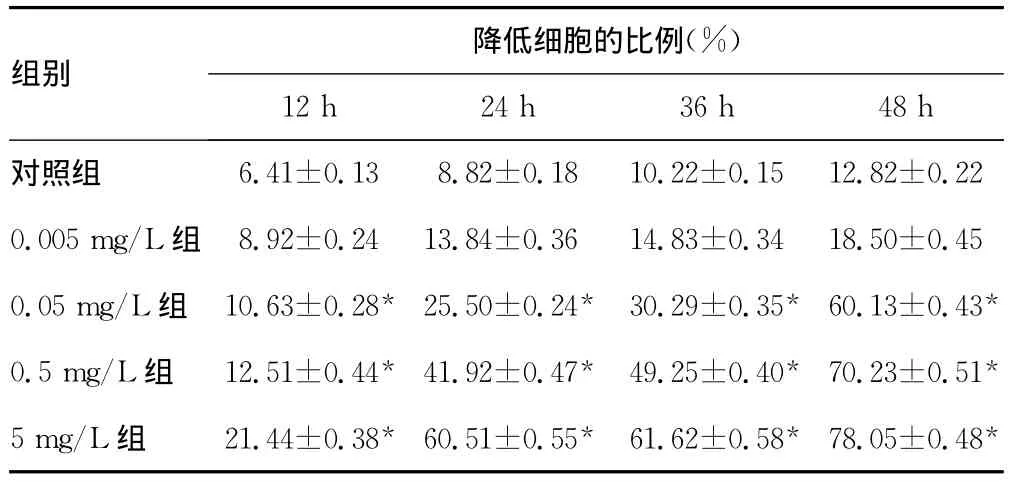
表2 紫杉醇作用SHI-1细胞ΔΨm的影响(±s)
*:P<0.05,与对照组和0.005mg/L组比较。
降低细胞的比例(%)组别6.41±0.13 8.82±0.18 10.22±0.15 12.82±0.22 0.005mg/L组 8.92±0.24 13.84±0.36 14.83±0.34 18.50±0.45 0.05mg/L组 10.63±0.28* 25.50±0.24* 30.29±0.35* 60.13±0.43*0.5mg/L组 12.51±0.44* 41.92±0.47* 49.25±0.40* 70.23±0.51*5mg/L组 21.44±0.38* 60.51±0.55* 61.62±0.58* 78.05±0.48 12h 24h 36h 48h对照组*
3 讨 论
紫杉醇是一种广谱抗癌药,对普通抗癌药物耐药的某些晚期肿瘤有良好的疗效,对多种临床恶性肿瘤疗效显着。近年来,随着细胞凋亡研究的深入,人们已经认识到抗肿瘤药主要是通过诱导肿瘤细胞凋亡发挥治疗作用,能否诱导凋亡以及凋亡的程度已成为评价抗肿瘤药物的重要指标[1]。白血病的诱导分化和凋亡疗法逐步成为白血病的两个新治疗策略[2]。有研究证实,紫杉醇抗肿瘤的机制之一是通过抑制细胞微管解聚,使细胞停滞在有丝分裂期,在G2/M期中发挥凋亡诱导作用[3]。此外,还具有提高宿主细胞免疫力和诱导肿瘤坏死的作用[4]。本研究中SHI-1细胞株是由苏州大学附属第一医院、江苏省血液研究所建立,建自一例临床表现呈高度耐药的急性单核细胞白血病患者,被证实对多种化疗药物耐药[5]。有研究表明,以P糖蛋白(P-gP)为代表的某些三磷酸腺苷结合蛋白超家族成员以及某些转运蛋白分子表达水平升高是很多化疗药物诱导肿瘤产生多药耐药的直接原因[6-7]。虽然已有体外实验表明紫杉醇对白血病细胞株有增殖抑制作用[8-9],但尚未有人研究其治疗难治性白血病的作用。
本研究结果表明,不同浓度的紫杉醇作用于SHI-1细胞株12、24、36、48h,细胞活力均有不同程度下降,以48h更为明显。紫杉醇对细胞的生长具有明显的抑制作用,其中,0.005 mg/L组对SHI-1细胞株增殖抑制作用较弱,随时间增加,其抑制率增大缓慢;0.05mg/L组对SHI-1细胞株增殖抑制及诱导凋亡作用最为显着。本研究观察到药物浓度加大后,坏死细胞逐渐增多。因此,本研究认为,从凋亡的角度看诱导SHI-1细胞凋亡应选择适合的药物浓度和作用时间,这样可使正常细胞避免药物过大剂量和超长的作用时间带来的损害,任意提高药物浓度和延长作用时间对诱导细胞凋亡是无益的[10]。
根据紫杉醇临床常规用药的剂量范围为135~175 mg/m2,按文献[11]推荐的公式计算,其在体内血浆中的浓度为89~116μg/mL,而本实验所采用的紫杉醇浓度远远低于该水平。本研究发现低浓度紫杉醇较高浓度更易诱导细胞凋亡,对紫杉醇临床治疗剂量的制定具有一定的参考价值。若在临床中使用紫杉醇治疗难治性白血病,可从小剂量开始,其临床疗效及不良反应有待进一步研究。
[1]Indran IR,Tufo G,Pervaiz S,et al.Recent advances inapoptosis,mitochondria and drug resistance in cancer cells[J].Biochim Biophys Acta,2011,1807(6):735-745.
[2] Lengfelder E,Saussele S,Weisser A,et al.Treatmemt concepts of acute promyelocytic leukemia[J].Crit Rev 0ncol Hematol,2005,56(2):261-274.
[3] El-Kareh AW,Labes RE,Secomb TW.Cell cycle checkpoint models for cellular pharmacology of paclitaxel and platinum drugs[J].AAPS J,2008,10(1):15-34.
[4] 王海燕,李运曼,刘国卿.紫杉醇抗癌机制研究进展[J].药学进展,1999,23(4):209-214.
[5] 陈苏宁,薛永权,张学光,等.一株伴有t(6;11)(q27;q23)和P53基因异常的人单核细胞白血病细胞系SHI-1的建立及鉴定[J].中华血液学杂志,2005,26(2):94-99.
[6] Larsen AK,Escargueil AE,Skladanowski A.Resistance mechanisms associated with altered intracellular distribution of anticancer agents[J].Pharmacol Ther,2000,85(3):217-229.
[7] Parekh HK,Deng HB,Choudhary K,et al.Overexpression of sorcin:a calcium-binding protein,induces a low level of paditaxel resistance in human ovarian and breast cancer cells[J].Biochem Pharmacol,2002,63(6):1149-1158.
[8] 尤学芬,陆德炎,姚登福,等.紫杉醇诱导HL-60细胞凋亡的研究[J].南通医学院学报,2001,21(4):351-352.
[9] 赵小英,徐磊,张晓红,等.紫杉醇对K562细胞增殖抑制及诱导凋亡的作用[J].实用肿瘤杂志,2002,17(6):376-378.
[10]郭春龙,朱晓敏,曲世静,等.紫杉醇诱导人膀胱癌EJ细胞凋亡及与Bcl-2基因表达的关系[J].实用癌症杂志,2011,26(2):124-127.
[11]达万明,陆道培,魏爱群,等.体外快速测定急性白血病细胞药物敏感性的初步报告[J].中华内科杂志,1982,21(2):109-112.



