庄立峰,林春榕,潘 云,鲁智英,周 雨,黄 勇,姚 瑶,吴学东
(大理学院:1.附属医院暨临床医学研究中心;2.基础医学院生物化学与分子生物学教研室,云南 大理 671000)
肠缺血-再灌注(Ischemia-reperfusion,I/R)及其所导致的肠管损伤是常见的临床问题,由于通常情况下难以获得人体肠组织标本进行研究,仅偶见人肠组织学研究报道,所以,动物实验的研究报道较多[1]。肠I/R 也是小儿常见的问题[2-3],也不乏因肠坏死需行肠切除者,将不同程度地影响小儿病情的康复和生长发育。然而,在现有动物实验替代研究中,对幼仔肠I/R所致肠管损伤的研究报道较少,因而对小儿肠I/R损伤的认识有待深入研究。本研究利用幼鼠造成肠I/R损伤模型并动态观察肠管的I/R损伤及利多卡因对肠管再灌注损伤的影响,现报道如下。
1 材料与方法
1.1 材料 选择4周龄SPF级的健康SD幼鼠48只,雌雄不限。
1.2 仪器与试剂 10%水合氯醛溶液5mL(大理学院附属医院制剂室配制);盐酸利多卡因注射液(上海朝晖药业有限公司);0.9%生理盐水,常用消毒剂,小手术器械及手术用品,BM-Ⅷ生物组织包埋及冷冻机(孝感市宏业医用仪器有限公司),PHY-Ⅲ病理组织漂烘仪(常州市中威电子仪器有限公司),莱卡石蜡切片机(LEICARM 2025型),OLYMPUS BX-41型多功能生物显微镜(日本奥林巴斯光学有限公司)和HMIAS-2000型高清晰医学彩色图像分析仪(武汉千屏影像公司)等。
1.3 方法 动物编号:许可证SCXK(渝)2007-017,体质量(100±15)g。手术室温度25~27℃,相对湿度50%~65%。用10%水合氯醛溶液腹腔内注射(3mL/kg)麻醉后仰卧位固定,腹部去毛,消毒后取上腹正中纵向切口,依次切开入腹,寻找并游离肠系膜上动脉(superior mesenteric artery,SMA)根部,用橡皮条阻断肠系膜上动脉血流1h,松开橡皮条,恢复肠系膜血流,造成小肠I/R模型。
随机分为假手术组、I/R组和利多卡因干预组,每组16只。假手术组仅暴露腹腔脏器,不作任何干预;I/R组于再灌注前经股静脉注射生理盐水0.5mL,而利多卡因干预组经相同途径注射利多卡因2mg/kg(稀释在0.5mL的生理盐水中);于再灌注后30、60、90、120min 4个时间点每组各处死动物4只,取距回盲瓣5cm处近端2cm长的小肠作为标本,备做组织学研究。
1.4 组织学观察 将所取小肠组织制成6~8μm厚度的切片后进行HE染色,光学显微镜下观察肠黏膜的形态学变化,每张切片随机选择镜下10个视野(×100),肠黏膜损伤程度按Chiu氏6级评分法[4-5]进行组织病理评分。
1.5 统计学处理 应用SPSS11.0软件进行统计学数据处理,计量资料以表示,组间比较采用单因素方差分析和配对t检验,以P<0.05为差异有统计学意义。
2 结 果
2.1 组织学观察 假手术组小肠组织形态正常,无水肿及出血(图1A);缺血1h时肠壁和绒毛结构完整,但肠壁炎症细胞浸润明显,可见点状出血和绒毛倒伏,黏膜面无明显渗出(图1B)。
I/R组和利多卡因干预组在再灌注各时间点肠组织病理变化明显,主要表现为小肠绒毛脱落和缺损、点状出血和溃疡形成、黏膜不同程度的绒毛排列紊乱和组织内炎症细胞浸润(图2A),直到再灌注120min时肠组织形态无明显改善,但坏死和出血情况也无明显加重(图2B)。在4个时间点中,病理改变以90min时最为明显,而相比之下,各时间点的病理改变程度利多卡因干预组较I/R组稍轻(图2C~D)。
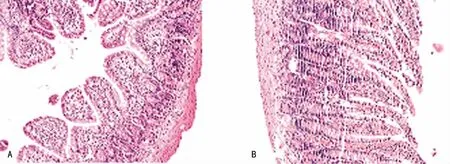
图1 正常肠组织和假手术组缺血1h肠组织(HE,×100)
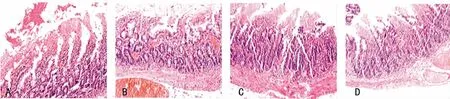
图2 I/R组和利多卡因干预组I/R后肠组织(光学显微镜,×100)
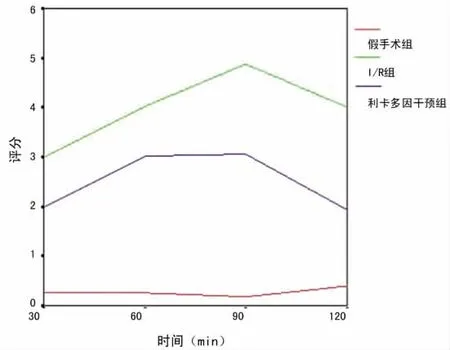
图3 3组幼鼠再灌注30、60、90、120min肠黏膜病理Chiu氏评分趋势图
2.2 肠黏膜损伤程度的Chiu氏6级评分 通过对小肠组织进行病理损伤的Chiu氏6级评分法评估,记录获得各组各时间点的平均分值如表1,3组各时间点Chiu氏评分以I/R组得分最高。各组各时间点的Chiu氏评分变化趋势见图3。I/R组和利多卡因干预组均从30min开始呈现评分逐渐增高的趋势,到90min达到峰值,在120min时呈现降低趋势,而此时利多卡因干预组的评分与再灌注30min时的差异无统计学意义(P>0.05)。
表1 3组各时间点小肠黏膜损伤病理Chiu氏评分比较

表1 3组各时间点小肠黏膜损伤病理Chiu氏评分比较
组别 n 16 0.26±0.40 0.25±0.47 0.17±0.55 0.39±0.50 I/R组 16 3.00±0.89 4.02±0.69 4.87±0.73 4.01±0.64利多卡因干预组30min 60min 90min 120min假手术组16 2.00±0.78 3.01±0.49 3.06±0.53 1.94±0.43
3 讨 论
肠I/R在小儿腹部外科是一常见情况,除由于肠坏死作肠切除外,不论先天还是后天获得性原因导致各种类型绞窄性肠梗阻如肠套叠、肠扭转、肠管绞窄性疝等的松解或整复术后、各种原因导致低血容量休克扩容后、小肠移植术后等都发生了肠I/R,血流再灌注后,被灌注组织原有的病理损伤将进一步加重,从而形成肠I/R损伤。临床实践中,在各种类型绞窄性肠梗阻整复后,通常以普鲁卡因进行肠系膜封闭结合肠管的湿热敷以促进肠系膜和肠管的血流恢复,然而对由于再灌注引起的肠组织变化认识并不多,本研究通过手术先阻断后恢复幼鼠肠系膜上动脉血供,成功获得幼鼠小肠I/R模型[6],在此基础上,通过利多卡因干预动态观察其对肠管再灌注损伤的影响。
由于肠道特殊的解剖部位和生理特点,肠黏膜对缺血、缺氧十分敏感,也是再灌注损伤时最易受累的器官之一。通过对再灌注后不同时间点小肠组织的观察,肠组织的病理变化在观察时间内主要突出了绒毛的改变,出现了绒毛排列紊乱和局部脱落、黏膜点状出血和溃疡形成及组织内有程度不等的炎症细胞浸润等,而肠壁黏膜下层、肌层和浆膜层仍保持完好,未发生肠壁局灶坏死穿孔,肠组织的这些病理改变呈现随再灌注时间延长而逐渐加重的趋势,但以再灌注90min时的变化最为明显,120min时略有减轻。通过肠组织病理损伤的Chiu氏6级评分获得了同样的结果,这是否提示在无任何干预的情况下肠I/R损伤将在再灌注后短时间内即逐渐修复,尚难以得出结论。
发生I/R后,除了肠道本身发生以炎症反应为主的再灌注损伤,更为重要的是,由于肠道黏膜屏障功能破坏,导致肠道内细菌移位和内毒素释放入血,促发多种细胞因子和组织因子的释放,加重局部的损伤甚至导致远膈器官的损害,从而可能导致严重后果[7-10]。然而,临床研究结果表明,尽管肠I/R在小儿是常见的,但并非都将发生严重情况,绝大多数患儿在去除导致肠缺血的原因后虽有短暂的程度不等的内毒素血症期,但均能顺利恢复,这可能提示,在缺血的肠管恢复血流灌注后发生的再灌注损伤将随着时间的推移或在相应治疗药物的干预下逐渐得到修复,而本研究幼鼠肠组织病理损伤在120min观察期内出现了从加重到减轻的转变,也从动物实验角度验证了小儿肠道I/R损伤的临床过程。
有研究认为,利多卡因除了作为经典的局部麻醉药和抗心律失常药外,还是一种非特异性的膜稳定剂。同时,利多卡因还能通过抑制中性粒细胞游走、超氧阴离子和炎症介质的释放及黏附分子的表达等而发挥抗炎作用[11-12]。根据利多卡因的这一作用机制,利用利多卡因对小肠I/R幼鼠进行干预,尽管肠管也发生了I/R损伤,而且发生变化的趋势也与非干预组的变化基本一致,但不论肠组织形态还是再灌注所致病理损伤的Chiu氏6级评分都显示了肠管在再灌注后各时间点的病理改变均较非干预组对应时间点相对减轻,表明利多卡因能在一定程度上减轻肠管的再灌注损伤。可能的机制是,利多卡因通过增强细胞膜的稳定性而发挥对肠组织再灌注损伤的保护作用,并通过抑制中性粒细胞的功能而减轻组织的炎症反应,从而使在再灌注后的各时间点肠组织的病理损伤程度比非利多卡因干预组相对较轻。
本研究结果表明,不论是I/R组还是利多卡因干预组,观察期内肠组织病理损伤程度均发生了从加重到减轻的转折性变化。这一方面可能说明观察的时间尚不够长,所得数据仅能反映观察期内某个时间点的病理改变,但有研究对成年鼠I/R损伤的实验观察8~24h,各种处理因素获得的病理评分并无较大的波动[13-14];另一方面,本研究观察的结果可能与幼鼠鼠龄小和处理因素有关,幼年动物(包括人)由于组织中水的含量大于成年动物,同时机体的防御机制发育并不完善,因而一旦有损伤因素存在,组织将发生快速而明显的反应,也由于幼年动物的修复能力较强,一旦损伤因素去除,修复也比较快。也有研究表明,幼年动物的病理改变较成年动物的改变轻[13],但也有动物实验证实,利多卡因具有保护缺血-再灌注肠道平滑肌的作用[15],这些研究的结果在一定程度上支持了本研究幼鼠肠组织的病理改变。
因此,本研究表明,小肠I/R幼鼠肠组织发生了明显的炎症反应,小肠绒毛发生了明显的病理改变,而通过利多卡因干预,在一定程度上减轻了肠I/R所致的肠组织病理损伤。
[1] Grootjans J,Lenaerts K,Derikx JPM,et al.Human intestinal ischemia-reperfusion-induced inflammation characterized:experiences from a new translational model[J].Am J Pathol,2010,176(5):2283-2291.
[2] 王素宁.小儿肠梗阻时肠缺血的外科分析[J].临床小儿外科杂志,2003,2(2):141-142.
[3] 沈淳,郑珊.小肠缺血再灌注损伤在肠套叠患儿的临床观察[J].中华小儿外科杂志,2005,26(10):540-543.
[4] Chiu CJ,McArdle AH,Brown R,et al.Intestinal mucosal lesion in low-flow states[J].Arch Surg,1970,101(4):478-483.
[5] Gavrinaia G,Oliveira-Filhoa RM,Trezena AG,et al.Lung microvascular permeability and neutrophil recruitment are differently regulated by nitic oxide in a rat model of intestinal ischemia-reperfusion[J].Eur J Pharm,2004,494(3):241-249.
[6] 林春榕,潘云,吴学东,等.幼鼠小肠缺血-再灌注肠组织的形态学观察[J].大理学院学报,2012,11(3):24-27.
[7] Qin X,Sheth SU,Sharpe SM,et al.The mucus layer is critical in protecting against ischemia-reperfusion-mediated gut injury and in the restitution of gut barrier function[J].Shock,2011,35(3):275-281.
[8] Varga J,Tóth S,Staško P,et al.Intestinal ischemia-reperfusion injury-the histopathological status of remote vital organs in acute and subacute phases[J].Ann Transplant,2012,17(1):11-20.
[9] Pierro A,Eaton S.Intestinal ischemia reperfusion injury and multisystem organ failure[J].Semi Pediatr Surg,2004,13(1):11-17.
[10]Sözen S,Topuz O,Uzun AS,et al.Prevention of bacterial translocation using glutamine and melatonin in small bowel ischemia and reperfusion in rats[J].Ann Ital Chir,2012,83(2):143-148.
[11]De Pietro MR,Eichacker PQ.Lidocaine for acute lung injury:questions still to answer[J].Crit Care Med,2000,28(2):589-591.
[12]朱文彪.利多卡因对急性肺损伤的作用[J].国外医学麻醉学与复苏分册,2001,22(3):155-157.
[13]Park Y,Hirose R,Coatney JL,et al.Ischemia-reperfusion injury is more severe in older versus young rat livers[J].J Surg Res,2007,137(1):96-102.
[14]Xiao XM,Liu DH,Zheng S,et al.Protective effect of estrogen on intestinal ischemia-reperfusion injury in pubertal rats[J].J Pediatr Surg,2004,39(12):1828-1831.
[15]Guschlbauer M,Feige K,Geburek F,et al.Effects of in vivo lidocaine administration at the time of ischemia and reperfusion on in vitro contractility of equine jejunal smooth muscle[J].Am J Vet Res,2011,72(11):1449-1455.



