王健琳,刘 颖
(大连医科大学附属第二医院:1.超声科;2.体检中心 116027)
超声引导下射频消融术(radiofrequency ablation,RFA)以其安全、有效、微创等优点,在原发及继发性肝癌的根治或者姑息性治疗上已经得到了广泛应用[1]。作为局部热疗的一种手段,RFA在治疗肿瘤的同时对患者机体免疫功能的影响已经成为国内外的研究热点。近年来有学者研究发现[2-5],RFA等热凝治疗除杀死肿瘤细胞、损毁肿瘤组织外,还能改善患者机体的免疫功能。本实验检测93例肝癌患者RFA治疗前后T细胞亚群、自然杀伤细胞(NK)细胞等的变化情况,并对病灶进行超声观察,通过比较RFA术前、术后2周、术后1个月外周血T细胞亚群及NK细胞数量的变化以及影像学改变,探讨RFA对机体免疫功能的影响。
1 资料与方法
1.1 一般资料 选择2007年2月至2012年11月大连医科大学附属第二医院收治的93例肝癌患者,其中原发性肝癌患者32例,继发性肝癌患者为已切除原发肿瘤且无肝外转移的肝内病灶61例(其中消化道恶性肿瘤转移40例,肺癌转移21例)。93例肝癌患者中男58例,女35例,平均(58.7±13.7)岁,肿瘤最大直径1.8~5.0cm,平均(3.4±1.7)cm,共121个病灶。患者入选条件:未经治疗的肝内初发原发肿瘤及手术根治原发肿瘤后的肝内转移灶,直径小于或等于5cm,肝内病灶数小于或等于3个,肝门静脉及下腔静脉无癌栓,无肝外转移灶,肝功能Child分级为A级或B级,血小板计数大于50×109/L,凝血酶原时间小于18s,术后1个月内未行其他治疗。
1.2 仪器与试剂 超声仪为HITACHI EUB7500型彩色多普勒诊断仪,探头频率3.5~4.0MHz。射频仪为美国达隆RF-2000射频治疗仪,功率100W、发射频率500kHz;采用电脑同时监控能量输出、组织阻抗、电极温度;电极为可伸缩鞘针,展开呈伞状,可根据病灶大小调整。试剂为碧迪医疗器械(上海)有限公司Intra Sure试剂盒。
表1 RFA治疗前后T细胞亚群及NK细胞水平的变化(±s,n=93)

表1 RFA治疗前后T细胞亚群及NK细胞水平的变化(±s,n=93)
*:P<0.05,与RFA术前比较;#:P <0.05,与RFA术后第2周比较。
时间 CD3+ CD4+ CD8+ CD4+/CD8+NK术前 57.99±8.26 32.51±5.5 36.01±5.07 0.94±1.35 11.84±4.67术后2周 58.91±9.01 32.87±9.64* 30.21±5.70* 1.34±0.87* 12.01±3.81术后1月 59.13±9.52 47.65±12.8* 29.16±2.53* 1.53±0.46* 17.39±3.88*#
1.3 消融步骤 根据肿瘤部位患者取适当体位,在超声探头监护下观察病灶位置,选取合适位置,确定穿刺点。常规消毒铺巾,1%~2%利多卡因局部麻醉,超声引导下将电极针刺入预定位置后进行消融。
1.4 方法 93例原发性和继发性肝癌患者分别于治疗前1 d、治疗后2周、1个月抽取外周静脉血2mL,抗凝后采用流式细胞法检测CD3+、CD4+、CD8+、NK细胞水平变化。并在治疗前1d、治疗后2周、1个月对所有患者行超声检查观察病灶大小、回声特征、血流情况等。
1.5 超声评价RFA疗效标准 与RFA术前比较:(1)单个肿瘤大小及多个肿瘤最大径之和的变化;(2)肿瘤内部血流信号变化;(3)肿瘤内部回声改变。并根据肝癌彩色血流特征,将肿瘤血供分为4级[6],(1)0级:瘤周及瘤内未见血流;(2)1级:少量血流信号;瘤周/瘤内可见1~2个点状或短棒状血流信号;(3)2级:中量血流,瘤周有3~4个短棒状血流或瘤内有1条较长的血管;(4)3级:瘤体血供丰富,4个以上点状血流或2条以上的血管。术后1个月行增强CT/MRI检查,与术前对比评价RFA的影像学疗效,动脉期内无造影剂充填视为肿瘤消融完全。
1.6 统计学处理 采用SPSS18.0进行数据分析,计量资料以±s表示,数据比较采用t检验,以P<0.05为差异有统计学意义。
2 结 果
2.1 RFA治疗前后外周血T淋巴细胞亚群变化 结果见表1,与术前1d相比,93例原发性和继发性肝癌患者经RFA手术治疗后,术后第2周、术后1个月的CD4+、CD4+/CD8+、NK细胞等水平均明显升高[(47.65±12.8)vs.(32.51±5.5)、(1.53±0.46)vs.(0.94±1.35)、(17.39±3.88)vs.(11.84±4.67),P <0.05];与术前1d相比,所有患者术后2周、术后1个月时的CD8+水平显着降低[(29.16±2.53)vs.(36.01±5.07),P <0.05],但93例肝癌患者术后2周、术后1个月的CD3+细胞水平与术前相比无明显变化[(59.13±9.52)vs.(57.99±8.26),P >0.05]。
2.2 患者治疗前后组织和血流超声图像特征 结果见表2、图1、图2。93例原发性和继发性肝癌患者术前病灶边界清晰、立体感明显(图2A),经超声引导射频消融术治疗后,患者病灶大小均较术前缩小,并且术后病灶边界模糊、立体感消失,部分呈片状低回声样(图1B,1C);同时,病灶内回声术后大部分增高,内部回声不均匀,可见弧形或伞状高回声带(图1B,1C)。此外,93例肝癌患者术前病灶血流分级多为2~3级(图2A);经超声引导射频消融术治疗后,患者病灶血流信号为0~1级(图2B,2C),与术前相比,患者术后第2周、第4周的病灶平均大小明显缩小[(2.6±1.9)vs.(3.4±1.7)、(2.1±1.1)vs.(2.6±1.9),P <0.05]。
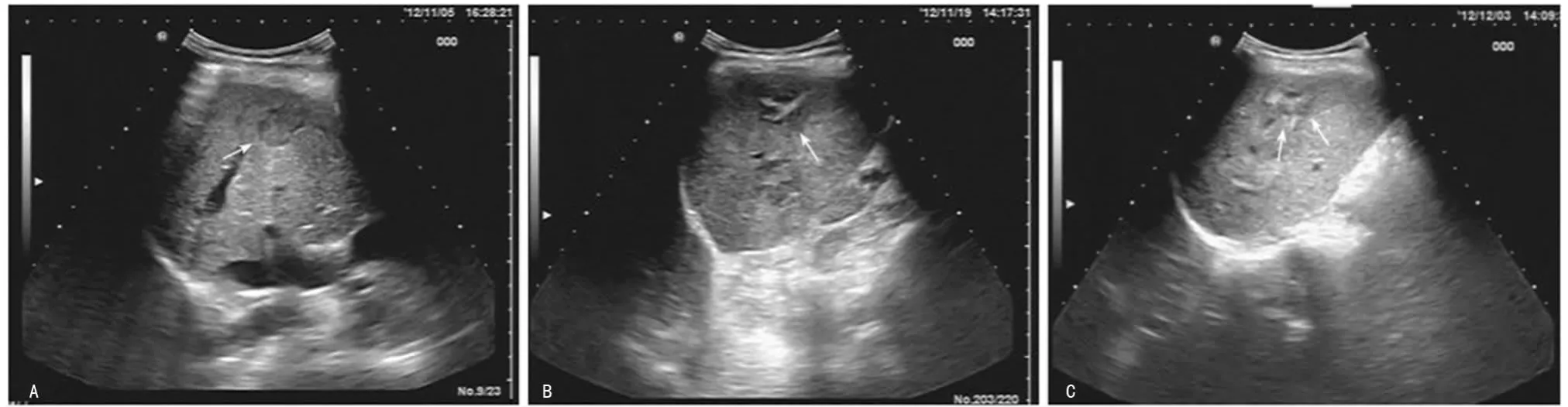
图1 治疗前后组织影像学特征

图2 治疗前后血液影像学特征
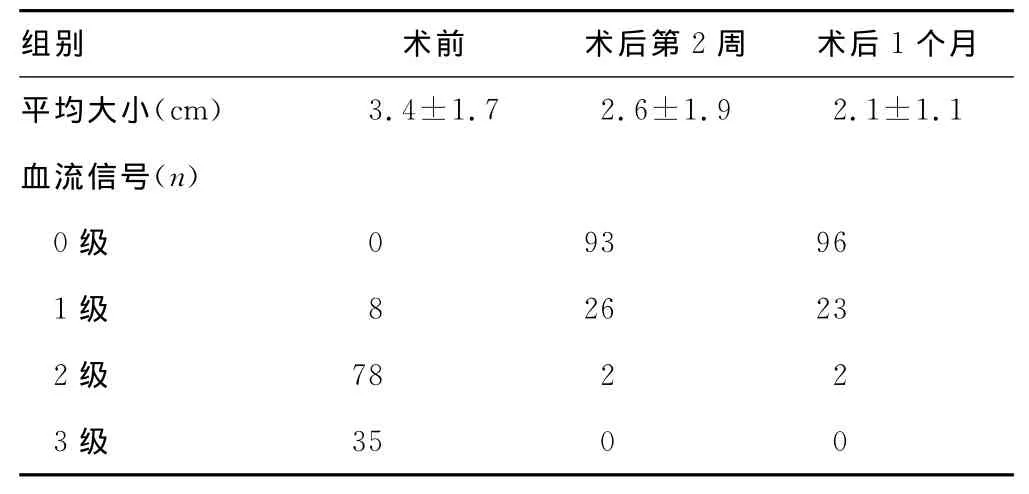
表2 RFA术前、术后病灶超声图像特点
2.3 RFA术后疗效 本组93例患者121个病灶全部完全消融,分别消融1~3次,术后1个月增强CT/MRI扫描病灶内无动脉期造影增强。
3 讨 论
肝癌是我国最常见的恶性肿瘤之一。原发性肝癌起病隐匿,多数患者确诊时已经失去手术机会;继发性肝癌多因原发灶恶性程度高,且患者体质虚弱不能耐受手术,也多采用微创姑息治疗。近年来,超声引导下射频治疗已经成为肝癌微创治疗的主要方法之一。
众所周知,肿瘤细胞分泌的细胞因子可导致肿瘤宿主的免疫抑制,而目前肿瘤的治疗手段如手术、化疗(包括动脉插管化疗)、放疗等在消除患者肿瘤的同时,对其自身的免疫系统也造成重大打击,使肿瘤患者免疫功能下降,促进了肿瘤的复发和转移。因此,患者术后免疫功能状态直接关系到肿瘤的复发和患者的预后。近年来有学者研究显示,RFA不但可以杀灭中路细胞、损毁肿瘤组织,还可以增加宿主的免疫功能[7-8]。
机体抗肿瘤免疫以细胞免疫为主。CD4+细胞是免疫应答的主要反应细胞,通过分泌细胞因子来调节抗肿瘤免疫。CD8+细胞主要分泌抑制性细胞因子发挥特异性免疫抑制作用。CD4+/CD8+细胞比值是机体维持免疫平衡的关键环节[9]。当CD4+细胞下降,CD4+/CD8+细胞比值下降或CD8+细上升时,机体处于免疫功能低下状态[10];待机体免疫抑制状态解除后,CD4+细胞数量增多,CD8+细胞数量下降,CD4+/CD8+细胞比值回升。NK细胞能够直接杀伤肿瘤细胞,同时还对侵犯血管导致转移的肿瘤细胞产生强大的杀伤作用,从而阻止肿瘤扩散。本研究通过选择2007年2月至2012年11月本院收治的93例原发性和继发性肝癌患者,检测RFA治疗前后T细胞亚群、NK细胞等的变化情况,并对病灶进行超声观察,通过比较RFA术前、术后2周、术后1个月外周血T细胞亚群及NK细胞数量的变化以及影像学改变,探讨RFA除局部热疗治疗肿瘤外对机体免疫功能的影响。
结果显示,93例原发性和继发性肝癌患者经RFA手术治疗后,与术前1d相比,术后第2周、术后1个月的CD4+、CD4+/CD8+、NK细胞等水平明显升高(P <0.05);同时,所有患者术后2周、术后1个月时的CD8+水平显着降低(P<0.05),但CD3+细胞水平与术前相比无明显变化(P >0.05);而通过超声观察发现,经超声引导射频消融术治疗后,患者病灶大小均较术前缩小,并且术后病灶边界模糊、立体感消失,部分呈片状低回声样;与术前相比,患者术后第2周、第4周的病灶平均大小明显缩小(P<0.05),几乎所有患者病灶血流信号等级都降为0~1级;93例患者121个病灶全部完全消融。这些结果都表明,RFA可以明显缩小原发性和继发性肝癌患者的病灶,并且对患者的免疫系统功能有显着增强的效果。分析原因,可能是由于RFA作为热疗的一种,一方面可以使肿瘤细胞发生凝固性坏死,肿瘤细胞负荷减少,免疫抑制因子的产生也相应减少,有利于机体免疫功能的恢复,并且RFA治疗时肿瘤组织局部温度明显升高,刺激机体产生热休克蛋白(HSP),其中HSP70参与肿瘤抗原呈递给T细胞,诱导有效的抗肿瘤免疫效应[11];此外,RFA作为一种热疗,可导致肿瘤细胞表面抗原决定簇暴露或肿瘤抗原改变,而增强肿瘤的抗原性[12],RFA对肿瘤的局部刺激还可导致局部产生炎症反应,从而使细胞介导的免疫功能增强。
综上所述,超声引导下RFA治疗原发性和继发性肝癌的效果明确、显着,并且对机体免疫功能有明显改善作用。
[1]陈敏山.肝癌射频消融的现状与展望[J].中华普通外科杂志,2011,26(6):453-456.
[2]Garcea G,Lloyd TD,Aylott C,et al.The emergent role of focal liver ablation techniques in the treatment of primary and secondary liver tumors[J].Eur J Cancer,2003,39(15):2150-2164.
[3]辛红,董宝炜.超声引导下微波凝固治疗肝癌前后患者免疫指标的动态变化[J].肿瘤防治研究,2000,27(4):275-277.
[4]罗葆明,王军华,潘景升,等.射频消融治疗肝癌对免疫功能的影响[J].中国临床医学影像杂志,2002,13(6):411-413.
[5]王艳滨,陈敏华,严昆,等.原发性肝癌射频治疗后局部免疫功能的变化及其临床意义[J].中国微创外科杂志,2006,6(10):803-806.
[6]Goldberg SN,Gazelle GS,Dawson SL,et al.Tissue ablation with radiofrequency using multiprobe arrays[J].Acad Radiol,1995,2(4):670-674.
[7]扈彩霞,郑加生,钱志玲,等.原发性肝癌患者射频消融前后外周血T淋巴细胞绝对值变化的临床意义[J].北京医学,2011,33(6):451-453.
[8]赵齐羽,蒋天安,敖建阳.超声引导射频消融对肝癌患者免疫功能影响的初步研究[J].实用肿瘤杂志,2007,22(4):356-358.
[9]Khazaie K,von Boehmer H.The impact of CD4+,CD25+Treg on tumor specific CD8+T cell cytotoxicity and cancer[J].Semin Cancer Biol,2006,16(2):124-126.
[10]Nakamura H,Kawasaki N,Hagivara M,et al.Cellular immunologic parameters related to age,gender,and stage in lung cancer patients[J].Lung Cancer,2000,28(2):139-145.
[11]王文见,王智彪,罗亿治.超声治疗肿瘤与免疫[J].国外医学肿瘤学分册,1998,25(6):347-349.
[12]董宝玮,温朝阳,梁萍,等.微波消融与手术切除治疗原发性小肝癌对癌细胞播散入血的影响[J].中华肿瘤防治杂志,2006,13(9):703-706.



