王 欣,刘 林,陈建斌,王建渝,肖 青
(重庆医科大学附属第一医院血液科 400016)
急性早幼粒细胞白血病(acute promyelocytic leukemia,APL)是急性髓系白血病的一个特殊亚型,其发病的分子基础是因特异性染色体t(15;17)易位形成的PML-RARa融合基因。因15号染色体上PML基因的断裂点不同,从而产生3种PML-RARa融合基因异构体,据此分为3个亚型,分别是BCR1型,BCR3型及BCR2型[1]。初诊APL的一线治疗方案主要是以全反式维甲酸(all-trans-retinoic acid,ATRA)联合蒽环类抗生素为主,并取得了不错的疗效[2],但BCR3型的患者往往复发率更高、生存期更短[3]。而本研究近年来在一线方案加入亚砷酸(ATO)治疗初诊APL患者,取得较前更好疗效,特别是在BCR3型患者,现报道如下。
1 资料及方法
1.1 一般资料 2009年1月至2012年6月于本院收治的42例初发PML-RARa融合基因阳性的APL患者,其中,男23例,女19例;年龄13~66岁,中位年龄38岁。诊断标准参照《血液学诊断及疗效标准》[4],所有患者均根据临床表现、骨髓细胞形态学检查、流式细胞学检查、染色体核型分析及PMLRARa融合基因检测(MICM)明确诊断。按初诊时患者外周血白细胞计数分为两组:WBC≥10.0×109/L的患者为高危组(10例),WBC<10.0×109/L的为中低危组(32例)。按不同PML-RARα融合基因亚型分为3组:BCR1型,BCR2型,BCR3型。
1.2 方法
1.2.1 治疗方法
1.2.1.1 诱导治疗ATRA联合ATO,ATRA:25 mg·m-2·d-1,28~40d;ATO:10mg/d,28~35d。可根据治疗过程中白细胞数量变化适量加用柔红霉素(DNR)、羟基脲等细胞毒药物。
1.2.1.2 缓解后巩固治疗 序贯行3疗程化疗,分别为DA,MA,TA方案:(1)DA方案:DNR 40~45mg·m-2·d-1,1~3d,阿糖胞苷(Ara-C)100~200mg·m-2·d-1,1~7d;(2)MA方案:米托蒽醌(MTZ)6~10mg·m-2·d-1,1~3d,Ara-C 100~200mg·m-2·d-1,1~7d;(3)TA方案:吡柔比星(THP)10~15mg·m-2,1~3d,Ara-C 100~200mg·m-2·d-1,1~7d。如为高危患者,可将DA或 MA方案中的Ara-C换为2g·m-2·d-1,1~3d。
1.2.1.3 中枢神经白血病(CNSL)的防治 腰穿及鞘内注射至少4次。鞘注方案如下:甲氨喋呤(MTX)10mg,Ara-C 50 mg,地塞米松(DXM)5mg。
1.2.1.4 缓解后维持治疗 序贯应用ATO、ATRA、6-巯基嘌呤(6-MP)+甲氨喋呤(MTX)3种方案,每方案1个月,3个月为1周期,共5周期。(1)ATO 10mg·d-1,21~28d。(2)ATRA 25~45mg·m-2·d-1,1~28d。(3)6-MP+MTX:6-MP 100mg,1~7d,15~21d;MTX 20mg,d9、12、23、26。
1.2.2 PML-RARα融合基因的检测 治疗前送骨髓检查PML-RARα融合基因并确定亚型,缓解后巩固、维持治疗及结束治疗后随访期间每3个月做一次融合基因亚型的定量检测。完全缓解期间PML-RARα融合基因由阴性转为阳性时,考虑为分子学复发。PML-RARα融合基因(BCR1、BCR2、BCR3)的检测方法采用欧洲抗癌协会推荐的实时荧光定量PCR技术(RQ-PCR)[5]。
1.2.3 疗效评判及随访 早期死亡定义为诱导缓解治疗中未达到缓解(CR)前死亡的患者。血液学完全缓解(HCR),分子学完全缓解(MCR)参照IWG标准[6]。生存时间(OS)定义为从疾病确诊到患者死亡的时间,无病生存时间(DFS)定义为从患者达到血液学CR至第一次复发的时间。随访终点时间为2012年12月31日。
1.3 统计学处理 应用SPSS13.0软件进行数据分析。计量资料用表示,组间比较采用t检验;计数资料采用率表示,组间采用χ2检验;采用Kaplan-Meier生存分析,统计移植后患者3年总OS率及3年无病DFS率,组间比较应用Log-rank检验。检验水准α=0.05,P<0.05为差异有统计学意义。
2 结 果
2.1 患者缓解情况 共4例患者死于诱导缓解期,早期病死率为9.5%。3例死于颅内出血(均为高危组,BCR3型),1例死于败血症合并感染性休克(中低危组,BCR1型)。其余38例完成诱导缓解治疗的患者全部达到HCR,获得CR所需时间为25~52d,CR率为90.5%。其中高危组及中低危组的CR率分别为70.0%vs.96.9%,两组间比较差异有统计学意义(P=0.04),见表1。BCR1型及BCR3型CR率分别为95.6%vs.78.6%(因BCR2型例数太少,未纳入统计分析),两组间比较差异无统计学意义(P=0.14),见表2。在巩固治疗期间,1例(中低危组,BCR1型)达CR后出院拒绝继续治疗,1例(中低危组,BCR2型)在巩固化疗期间,于粒细胞缺乏期并发肺部真菌感染放弃治疗自动出院,完成巩固治疗的36例患者复查PML-RARα融合基因均为阴性,全部达到MCR。

表1 初诊高白细胞与近期预后的关系[n(%)]
2.2 不同危险组及PML-RARα融合基因亚型与中远期预后关系 完成巩固治疗的36例患者中位随访时间为28个月(7~48个月),仅有3例患者复发(3/36,8%)。不同危险组的复发率、3年OS率及DFS率见表3;不同PML-RARα融合基因亚型组的复发率、3年OS率及DFS率见表4,两组间各指标比较差异均无统计学意义。不同危险组及PML-RARα融合基因亚型组的OS曲线和DFS曲线见图1~4。复发的3例患者再次按原方案诱导治疗,均再次达到CR,至随访结束仍保持CR2。CR1持续时间为15~20个月。
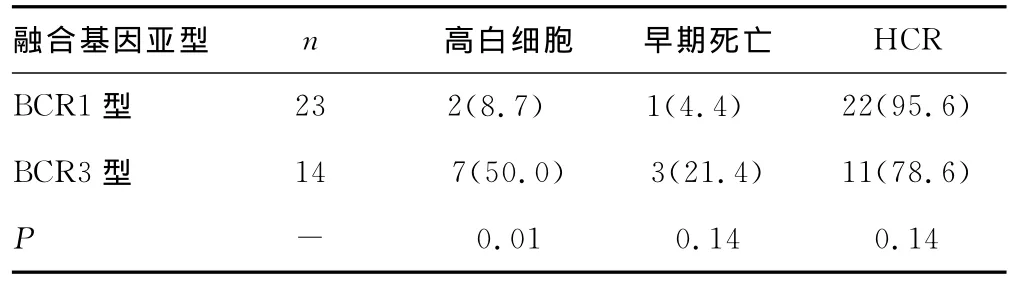
表2 PML-RARα融合基因亚型与近期预后的关系[n(%)]

表3 初诊高白细胞与中远期预后的关系

图1 不同危险组的OS曲线
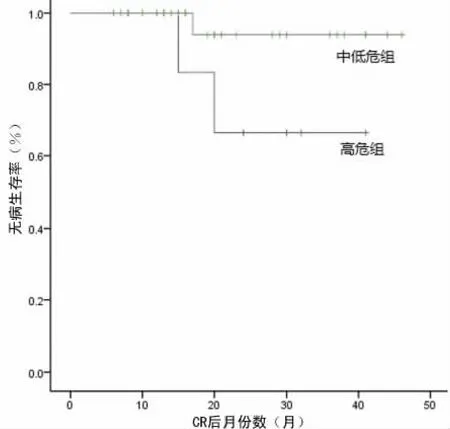
图2 不同危险组的DFS曲线

表4 PML-RARα融合基因亚型与中远期预后的关系

图3 不同PML-RARα融合基因亚型组的OS曲线

图4 不同PML-RARα融合基因亚型组的DFS曲线
3 讨 论
本研究总的CR率为90.5%,与国内外报道相近。中低危组CR率显着高于高危组(96.9%vs.70.0%,P=0.04);BCR1型CR率也高于BCR3型(95.6%vs.78.6%,P=0.14),但差异无统计学意义。分析原因发现全部42例患者除早期死亡的4例,其余38例全部达到CR,故CR率的差异主要归因于早期病死率的差异。且完成巩固治疗的36例患者到随访结束时均还存活,说明APL患者主要风险还是在达到CR前的诱导CR治疗阶段。
中低危组的复发率、3年OS率及DFS率均明显优于高危组;而PML-RARa融合基因不同亚型组间上述各项指标差异无统计学意义。既往以ATRA联合常规化疗为主要治疗方案的国内外研究显示BCR3型患者的疗效往往不如BCR1型[3],分析原因可能是BCR3亚型与FLT3突变存在高度关联性,而FLT3突变往往与初诊高白细胞状态并存,是APL重要的不良预后标志之一[7-8]。另有研究显示在白血病细胞的体外实验中,在缺乏GM-CSF的环境中,BCR3型细胞有抗凋亡特性,而BCR1型可促进细胞死亡;并且ATRA的抑制细胞生长作用对BCR1型细胞比BCR3型更强[9],故提示BCR3型APL患者对ATRA具有更强的耐药性。既往ATO一般作为二线用药用于复发、难治的APL患者,近来越来越多的单位把ATO加入到一线治疗用药中[10-12],本研究收集病例均为初诊患者,在诱导缓解治疗及后期序贯维持治疗中均采用了ATRA联合ATO的方案,所得结果显示BCR3型患者的OS率及DFS率明显优于既往不含ATO的研究[3],另有国内单位也取得了与本研究相似的疗效[13]。故可得出结论ATRA联合ATO作为一线用药治疗初诊APL取得了非常好的疗效,并且对于BCR3亚型患者的中长期疗效优于既往一线用药不含ATO的研究。BCR3型OS率低于DFS率,原因为OS率计算包括早期死亡例数,而DFS率计算是从达到CR的例数开始。BCR3型患者早期病死率较高(21.4%),而达CR后本研究中复发率仅为9.1%,在今后的工作中还要寻找更好的方法防止该类患者的早期死亡,如积极防治弥散性血管内凝血,减少颅内出血的发生率,从而进一步提高BCR3型患者的总生存率。
[1]Chen SJ,Chen Z,Chen A,et al.Occurrence of distinct PML-RAR-alpha fusion gene isoforms in patients with acute promyelocytic leukemia detected by reverse transcriptase/polymerase chain reaction[J].Oncogene,1992,7(6):1223-1232.
[2]Wang ZY,Chen Z.Acute promyelocytic leukemia:from highly fatal to highly curable[J].Blood,2008,111(5):2505-2515.
[3]Jurcic JG,Nimer SD,Scheinberg DA,et al.Prognostic significance of minimal residual disease detection and PML/RAR-alpha isoform type:long-term follow-up in acute promyelocytic leukemia [J].Blood,2001,98(9):2651-2656.
[4]张之南,沈悌.血液病诊断及疗效标准[M].3版.北京:科学出版社,2007:106-113.
[5]Beillard E,Pallisgaard N,van der Velden VH,et al.Evaluation of candidate control genes for diagnosis and residual disease detection in leukemic patients using′real-time′quantitative reverse-transcriptase polymerase chain reaction(RQ-PCR)-a Europe against Cancer program[J].Leukemia,2003,17(12):2474-2486.
[6]Cheson BD,Bennett JM,Kopecky KJ,et al.Revised recommendations of the International Working Group for Diagnosis,Standardization of Response Criteria,Treatment Outcomes,and Reporting Standards for Therapeutic Trials in Acute Myeloid Leukemia[J].J Clin Oncol,2003,21(24):4642-4649.
[7]Barragán E,Montesinos P,Camos M,et al.Prognostic value of FLT3mutations in patients with acute promyelocytic leukemia treated with all-trans retinoic acid and anthracycline monochemotherapy[J].Haematologica,2011,96(10):1470-1477.
[8]Mathews V,Thomas M,Srivastava VM,et al.Impact of FLT3mutations and secondary cytogenetic changes on the outcome of patients with newly diagnosed acute promyelocytic leukemia treated with a single agent arsenic trioxide regimen [J].Haematologica,2007,92(7):994-995.
[9]Slack JL,Yu M.Constitutive expression of the promyelocytic leukemia-associated oncogene PML-RARalpha in TF1cells:isoform-specific and retinoic acid-dependent effects on growth,bcl-2expression,and apoptosis [J].Blood,1998,91(9):3347-3356.
[10]吕在明,张曦,陈幸华,等.亚砷酸治疗急性早幼粒细胞白血病的临床观察[J].重庆医学,2004,33(9):1399-1400.
[11]Hu J.Arsenic in the treatment of newly diagnosed acute promyelocytic leukemia:current status and future research direction[J].Front Med,2011,5(1):45-52.
[12]Lengfelder E,Hofmann WK,Nowak D.Impact of Arsenic trioxide in the treatment of acute promyelocytic leukemia[J].Leukemia,2012,26(3):433-442.
[13]Lou Y,Qian W,Meng H,et al.High efficacy of Arsenic trioxide plus all-trans retinoic acid based induction and maintenance therapy in newly diagnosed acute promyelocytic leukemia[J].Leuk Res,2013,37(1):37-42.



