王洪波,张梦亮,张芸辉,杨 艳,张宝昌△
(1.长春工业大学化学与生命科学学院,长春130012;2.吉林大学生命科学学院,长春130012)
异丙肌苷原为一抗病毒药,对人体疱疹、流感及鼻病毒感染均有疗效,用于单纯疱疹病毒感染的患者疗效显着。现发现异丙肌苷具有增强机体免疫功能的作用,主要是增强细胞免疫功能,作为一新的免疫调节剂,在国外临床上广泛应用[1-9]。异丙肌苷由肌苷与二甲胺基异丙醇-对乙酰胺基苯甲酸盐(1∶3)3部分组成,易水解成为肌苷、二甲胺基异丙醇、对乙酰胺基苯甲酸,以往有关异丙肌苷的体内药代动力学报道甚少。本试验建立了快速、灵敏的测定血浆中肌苷浓度的液相色谱-串联质谱(LC-MS/MS)分析方法,并对4名健康受试者口服1g异丙肌苷后肌苷的体内药代动力学过程进行了初步的研究。
1 材料与方法
1.1 仪器和药品 三重四极杆串联质谱仪,型号 API 4000,配有电喷雾离子源(加拿大Applied Biosystem公司);Agilent 1100高效液相色谱系统(美国Agilent公司);TGL-16G-A高速台式冷冻离心机(上海安亭科学仪器厂)。
肌苷对照品(浓度为99.8%,上海微蒙生物科技有限公司提供,批号:140669-200702);内标阿德福韦对照品(浓度99.0%,葛兰素史克苏州制药公司提供,批号:9002);色谱纯级别甲醇由Sigma-Aldrich有限公司提供,其他试剂为分析纯级别;人血浆由吉林大学附属第一医院提供。
1.2 实验方法
1.2.1 色谱/质谱条件 色谱条件 Agilent SB-C18色谱柱,5 μm粒径,150.0mm×4.6mm I.D.,美国 Agilent公司;流动相:甲醇∶10mmol/L 乙酸铵-水溶液(15∶85,v/v);流速:1mL/min;柱温:40℃;进样量:5μL。质谱条件 离子源:ESI离子源;喷射电压:-4 000V;温度:500℃;源内气体(N2)GS1、GS2和气帘气体压力分别为:40psi、40psi和15psi;正离子方式检测;扫描方式为多重反应监测(multiple reaction monitoring,MRM);肌苷的解簇电压(DP)、碰撞能量(CE)分别为-78V和-30eV;内标阿德福韦的DP和CE分别为-75 V和-50eV;用于定量分析的离子对分别为m/z母离子为267.3,子离子为135.0(肌苷)和 m/z母离子为272.0,子离子为134.1(内标阿德福韦)。
1.2.2 样品采集和处理 全血取出后置肝素化试管中,立即4℃离心(15 000r/min×5min),取出血浆置另一试管(每毫升血浆加100μL 30%高氯酸溶液),充分振荡混匀,低温离心(15 000r/min×5min),取上清液,于80℃冷冻待测。室温溶解,取100μL上清液,立即加入内标溶液100μL,充分振摇混匀后,取上清液5μL进行LC-MS/MS分析。
1.2.3 溶液的配制 称取25.0mg肌苷(分子式:C10H12N4O5)对照品,置于25mL容量瓶中,加甲醇-水定容至刻度,配制成1mg/mL的肌苷母液。
标准系列溶液的配制:取肌苷储备液适量,分别用室温放置超过3d后的空白血浆稀释至10、30、100、300、1 000、3 000 ng/mL。内标的配制:称取25.0mg阿德福韦,置于25mL容量瓶中,加甲醇-水定容至刻度,配制成1mg/mL的母液,取适量用甲醇水(1∶1,v/v)稀释至浓度为1μg/mL,即为内标溶液。
2 结 果
本试验参照相关指导原则进行了方法学确证[10]。
2.1 方法的专属性 分别取6名健康受试者的空白血浆(室温放置超过3d后的空白血浆)1 000μL,按血浆样品处理方法操作,得到空白样品色谱图(图1A);将含有10ng/mL肌苷的血浆样品加入内标阿德福韦后,依同法操作,得到定量下限样品的色谱图(图1B);取受试者给药后收集的血浆样品,依同法操作,得色谱图1C。结果表明:室温放置超过3d后的空白血浆内源性物质不干扰肌苷和阿德福韦的测定。
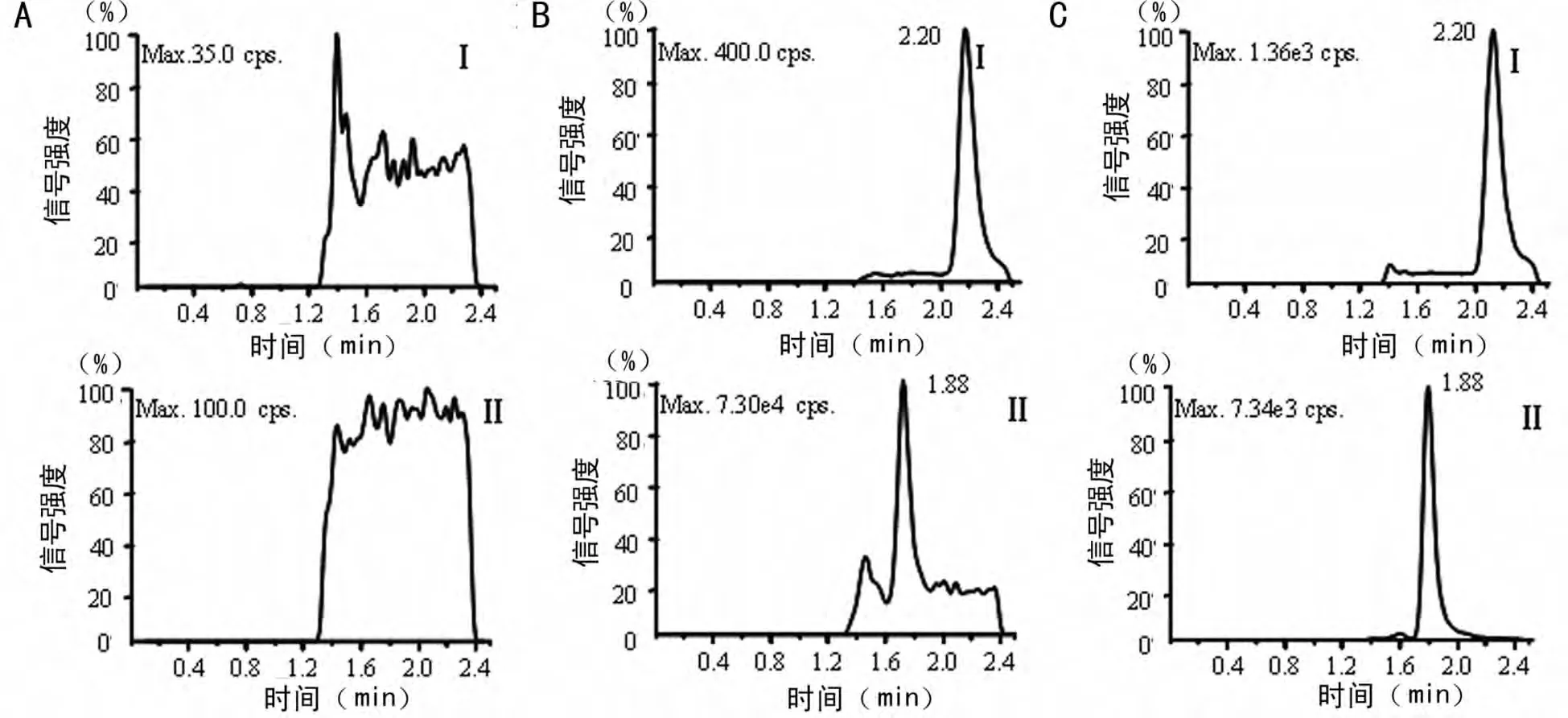
图1 测定人血浆中肌苷和内标阿德福韦的典型MRM色谱图
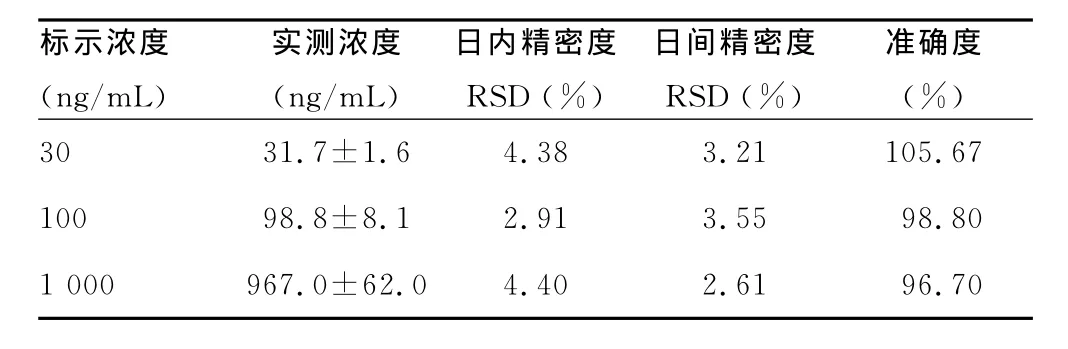
表1 血浆中肌苷LC-MS/MS测定方法的准确度与精密度(3个分析批,每分析批n=6)
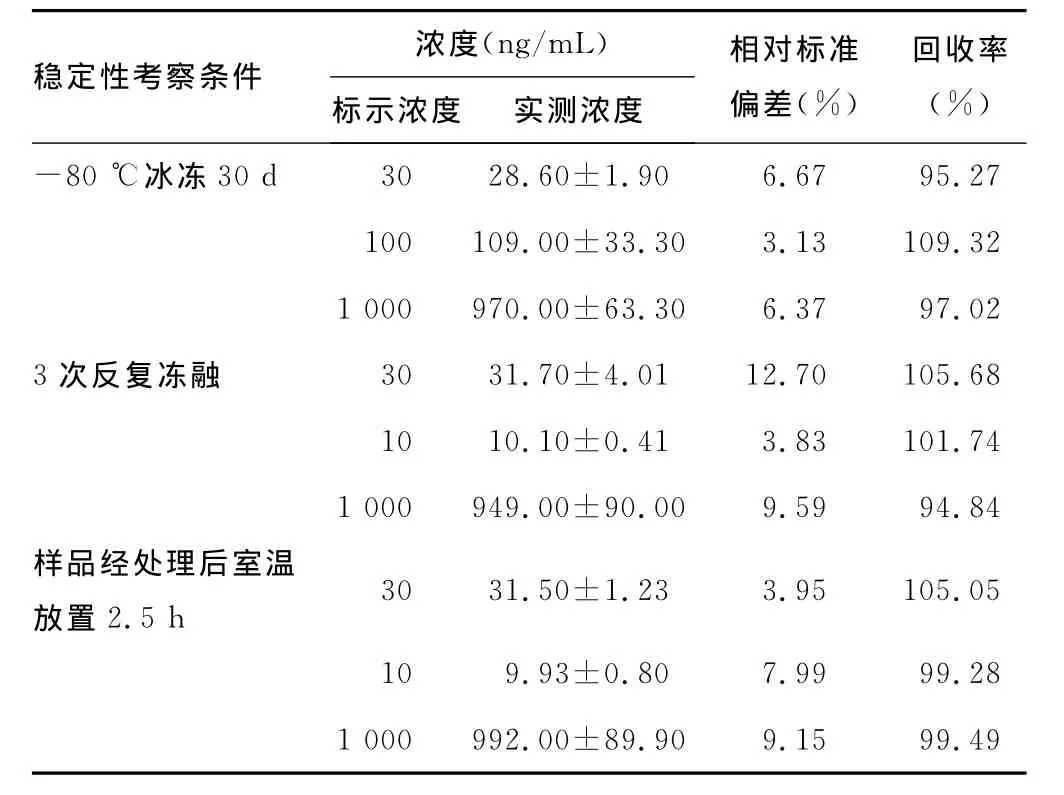
表2 血浆中肌苷的稳定性(n=3)
2.2 标准曲线制备和定量下限 取用空白血浆(室温放置超过3d后的空白血浆)配制的标准系列溶液(10、30、100、300、1 000、3 000ng/mL)1000μL,按血浆样品处理方法操作,取5 μL进行LC-MS/MS分析;以肌苷标示浓度为横坐标,肌苷与内标物阿德福韦的色谱峰面积比值为纵坐标,以加权系数W=1/χ2进行线性回归[11],得到标准曲线的回归方程。典型的回归方程曲线为Y=0.001 9 X-0.006 89(r=0.995 4),其中Y为待测物与内标的峰面积比,X为标准系列溶液浓度。根据标准曲线,血浆中肌苷的线性范围为10~3 000ng/mL,定量下限(9.8±0.4)ng/mL(n=6)。
2.3 精密度、准确度 取空白血浆(室温放置超过3d的空白血浆)配制的低、中、高3个浓度(30、300、2 400ng/mL)的质量控制(QC)样品,按血浆样品处理方法操作,每浓度6样本,连续测定3d。根据当日的工作曲线,计算QC样品测得浓度,根据QC样品结果计算本法的准确度与精密度,测定血浆中肌苷的准确度与精密度。见表1。
2.4 提取回收率和基质效应 取一定量空白血浆(室温放置超过3d的空白血浆),按血浆样品处理方法(不加入内标)操作,获得的空白血浆上清液,用此上清液配制低、中、高3个浓度的QC样品和内标,每浓度4个样本。将该样本进行LCMS/MS分析,获得相应峰面积,两种处理方法得到的峰面积比值(百分比)即为提取回收率。血浆样品中肌苷低、中、高3个浓度回收率分别为(96.7±3.45)%、(93.7±2.60)%、(93.2±2.58)%。用水配制的低、中、高3个浓度(30、300、2 400ng/mL)的质量控制(QC)样品,按照标准曲线制备方法操作,每浓度4个样本;同时取一定量空白血浆(室温放置超过3 d的空白血浆),按血浆样品处理方法(不加入内标)操作,获得的空白血浆上清液,用此上清液配制低、中、高3个浓度的QC样品和内标,每浓度四样本,进样分析,获得相应峰面积,以每一浓度两种处理方法的峰面积比值计算提取基质效应,分别为(98.9±9.09)%、(104.8±3.87)%、(102.5±6.20)%。
2.5 稳定性考察 依据“2.3”项下方法制备稳定性QC样品,每浓度3个样本,不经提取,经-80℃放置30d后,测定样品浓度;或经反复3次-20℃冰冻-溶解循环,测定样品浓度。结果(表2)表明:所有冻融试验测定值与添加值的相对偏差(R.E.%)均小于15%。即血浆样品可以进行反复冻融或在-80℃放置30d,不会影响测试结果的准确度。
试验中对处理后的QC样品(每浓度3个样本)进行了2.5 h室温放置稳定性考察,结果显示所有样品的试验测定值与添加值R.E.%均小于15%,说明分析测试过程中的样品较为稳定。
2.6 分析方法在药动学研究中的应用 4例健康受试者,男女各半。试验方案经吉林大学第一医院医学伦理委员会审核批准。向受试者解释知情同意,并签署受试者知情同意书进入该试验。受试者于服药前1d入住I期病房,并于第2天8:00口服1g异丙肌苷片(北京赛而生物药业有限公司生产,批号:20081215),温开水200mL送服。临床医生及研究者随时观察不良事件并对受试者进行监护。给药前、给肌苷药后10、20、30、45min,1.00、1.25、1.50、2.00、2.50、3.00、4.00、6.00h于上肢肘窝静脉取血5mL,按“1.2.2”操作,以当日标准曲线计算各时间点的血药浓度,测得的药时曲线见图2。由图2可见,给药前,健康受试者血浆基础肌苷在20~60ng/mL。
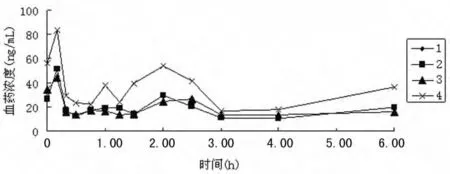
图2 4名健康受试者口服1g异丙肌苷后肌苷血药浓度-时间曲线
3 讨 论
3.1 肌苷作为一种内源性核苷类物质,对其定量分析报道不多。Jeng等[12]用LC-MS/MS同时定量分析了肝癌患者和健康人尿中7种核苷;David等[13]利用微渗析技术用 HPLCDAD检测了犬心肌缺血模型细胞间隙中5种核苷浓度;文献[14-15]报道用HPLC-DAD或HPLC-UV测定人血浆中内源性肌苷浓度。本实验建立了人血浆肌苷LC-MS/MS分析方法,该方法灵敏度高(定量下限10ng/mL),分析时间短,处理方法简单(一步沉淀蛋白),试用于高通量的药代动力学研究或临床样本检测。该方法已应用于健康受试者口服异丙肌苷后的体内药代动力学研究。
3.2 肌苷在全血和血浆中均不稳定。在全血中,嘌呤核苷磷酸化酶(PNP)快速代谢肌苷成为次黄嘌呤(t1/2<5min);在血浆中,PNP的活力相对较低[14]。因此,为保证样品在处理过程中的稳定性,尽快按照“1.2.2”处理,置-80℃冰箱保存。高氯酸可以破坏酶的活性,所以高氯酸处理过的样品相对稳定。实验证明含肌苷的新鲜大鼠血浆处理后上清-80℃下至少稳定30d。同时未处理的含肌苷的新鲜血浆室温放置一段时间(3d)后肌苷完全降解,可以用来作为空白血浆配制标准曲线,不干扰肌苷和内标阿德福韦的定量分析。
3.3 4例受试者的血药浓度-时间曲线见图2。由图可见,4名受试者的药-时曲线均呈现不规律的多峰现象,推测其原因可能是多方面的。肌苷为机体内源性物质,内源性肌苷的干扰无法避免;在人体内,肌苷的变化途径复杂,作为嘌呤代谢过程中一个中间代谢产物,可以由腺苷、次黄嘌呤核苷酸和次黄嘌呤生成肌苷,同时肌苷也能通过不同途径代谢成次黄嘌呤或次黄嘌呤核苷酸,十几种酶参与其中,如肌苷酶、核苷磷酸化酶等。很多情况下,机体会针对某种内源性物质的增多或减少发生代偿反应,肌苷在人体内是否存在这种代偿性的保护机制目前尚不明确;另外,有些内源性物质受饮食、昼夜节律或生理周期影响明显,肌苷是否受饮食、昼夜节律或生理周期的影响还需进一步考察。
本研究建立LC-MS/MS测定人血浆中肌苷浓度的方法并进行了方法确证。该方法专属性强,样品处理方便,灵敏度高,适用于肌苷临床药动学研究。
[1]Ghram A,Reddy PG,Blecha F,et al.Effects of bovine respiratory disease viruses and isoprinosine on bovine leukocyte function in vitro[J].Vet Microbiol,1989,20(4):307-314.
[2]Pedersen BK,Tvede N,Diamant M,et al.Effects of isoprinosine treatment of HIV-positive patients on blood mononuclear cell subsets,NK-and T-cell function,tumour necrosis factor,and interleukins 1,2,and 6[J].Scand J Immunol,1990,32(6):641-649.
[3]Singh H,Herndon DN.Effect of isoprinosine on lymphocyte proliferation and natural killer cell activity following thermal injury[J].Immunopharmacol Immunotoxicol,1989,11(4):631-644.
[4]inosiplex GC,intraventricular interferon-alpha in subacute sclerosing panencephalitis(SSPE):international multicenter study[J].J Child Neurol,2003,18(12):819-827.
[5]Tay SK.Efficacy of inosine pranobex oral therapy in subclinical human papillomavirus infection of the vulva:a randomized double-blinded placebo controlled study[J].Int J STD AIDS,1996,7(4):276-280.
[6]Georgala S,Katoulis AC,Befon A,et al.Oral inosiplex in the treatment of cervical condylomata acuminata:a randomised placebo-controlled trial[J].BJOG,2006,113(9):1088-1091.
[7]De Simone C,Famularo G,Tzantzoglou S,et al.Inosine pranobex in the treatment of HIV infection:a review[J].Int J Immunopharmacol,1991,13Suppl 1:19-27.
[8]Brzeski M,Madhok R,Hunter JA,et al.Randomised,double blind,placebo controlled trial of inosine pranobex in rheumatoid arthritis[J].Ann Rheum Dis,1990,49(5):293-295.
[9]Georgala S,Katoulis AC,Befon A,et al.Inosiplex for treatment of alopecia areata:a randomized placebo-controlled study[J].Acta Derm Venereol,2006,86(5):422-424.
[10]US Food and Drug Administration.Guidance for Industry:Bioanalytical Method Validation[S/OL].http://www.fda.gov/downloads/Drugs/GuidanceCompilance-RegulatoryInformation/Guidances/ucm070107.pdf.
[11]钟大放.以加权最小二乘法建立生物分析标准曲线的若干问题[J].药物分析杂志,1996,16(5):343-346.
[12]Jeng LB,Lo WY,Hsu WY,et al.Analysis of urinary nucleosides as helper tumor markers in hepatocellular carcinoma diagnosis[J].Rapid Commun Mass Spectrom,2009,23(11):1543-1549.
[13]Mei DA,Gross GJ,Nithipatikom K.Simultaneous determination of adenosine,inosine,hypoxanthine,xanthine,and uric acid in microdialysis samples using microbore column high-performance liquid chromatography with a diode array detector[J].Anal Biochem,1996,238(1):34-39.
[14]Farthing D,Sica D,Gehr T,et al.An HPLC method for determination of inosine and hypoxanthine in human plasma from healthy volunteers and patients presenting with potential acute cardiac ischemia[J].J Chromatogr B Analyt Technol Biomed Life Sci,2007,854(1/2):158-164.
[15]Farthing D,Xi L,Gehr L,et al.High-performance liquid chromatography(HPLC)determination of inosine,apotential biomarker for initial cardiac ischaemia,using isolated mouse hearts[J].Biomarkers,2006,11(5):449-459.



