范 静,姜 宏,王雪梅,宋小敏,张莹莹
(安徽医科大学解放军临床学院生殖中心,合肥230031)
获取足够数量高质量的卵母细胞和胚胎是改善体外受精-胚胎移植(in vitro fertilization-embryo transfer,IVF-ET)妊娠结局的关键因素。通过促性腺激素释放激素激动剂(gonadotropin releasing hormone agonist,GnRH-a)对垂体降调节后给予重组人促卵泡激素(r-FSH)进行超促排卵的标准长方案为多数生殖中心所采用,并取得了较好的临床效果。但在临床实践中发现,垂体降调节后部分患者卵泡中期血清黄体生成素(luteinzing hormone,LH)水平较低[1],而两细胞两种促性腺激素理论认为,卵泡发育的中晚期需要血清LH的协同作用,低水平的血清LH是否影响卵泡发育以及IVF-ET结局尚存在争议。本文回顾性分析406例IVF-ET患者临床资料,探讨在控制性促排卵(controlled ovarian stimulation,COS)过程中卵泡中晚期添加外源性人绝经期促性腺激素(HMG)与IVF-ET结局的关系,以期改善促排卵方案,提高临床妊娠率。
1 资料与方法
1.1 一般资料 回顾性分析2009年1月至2012年7月在解放军105医院生殖中心接受IVF-ET治疗的406例不育患者的临床资料。纳入标准:年龄小于或等于38岁,采用黄体期长方案进行垂体降调节,月经周期规律;不孕原因主要为输卵管因素、轻度子宫内膜异位症、男性因素、不明原因不孕等。排除多囊卵巢综合征,卵巢低反应(获卵数小于或等于4个,基础r-FSH≥10U/L),高泌乳素血症等内分泌疾病,反复种植失败(3次胚胎移植未孕)、未予处理的输卵管积液、子宫腺肌症及重度子宫内膜异位症患者。根据COS过程中是否添加HMG分为:A组(r-FSH+HMG促超排),共257个周期;B组(单用r-FSH促超排),共149个周期,两组间患者年龄、不孕年限、达菲林用量、垂体降调时间、体质量指数(BMI)及受精方式差异均无统计学意义(P>0.05)。根据添加HMG当日LH水平将A组再分为:A1组,LH<1U/L,99个周期;A2组,1U/L≤LH≤2U/L,96个周期;A3组,LH>2U/L,62个周期,3组间患者年龄、不孕年限、达菲林用量、垂体降调时间、BMI及受精方式差异均无统计学意义(P>0.05)。
表1 卵泡中晚期添加HMG对IVF-ET临床结局的影响s)

表1 卵泡中晚期添加HMG对IVF-ET临床结局的影响s)
*:P<0.05,与B组比较;-:表示此项无数据。
Gn用量(支))]A组 257 11.33±1.81* 27.34±7.25* 4.63±3.68 1.53±0.79 1.81±1.20 12.63±5.00 2 315(74.75)* 2 174(93.91) 126(23.25)118(45.91)* 19(16.10)组别周期数(n)Gn时间(d)r-FSH HMG添加HMG日LH(U/L)HCG日LH(U/L)获卵数(n)受精率[n(%)]卵裂率[n(%)]种植率[n(%)]妊娠率[n(%)]流产率[n(%*B组 149 10.05±1.32 22.70±5.47 - 1.63±0.38 1.83±1.39 13.21±5.58 1 492(63.35) 1 412(94.64) 60(18.07) 55(36.91) 16(29.09)
表2 卵泡中晚期不同LH水平添加HMG对IVF-ET临床结局的影响±s)
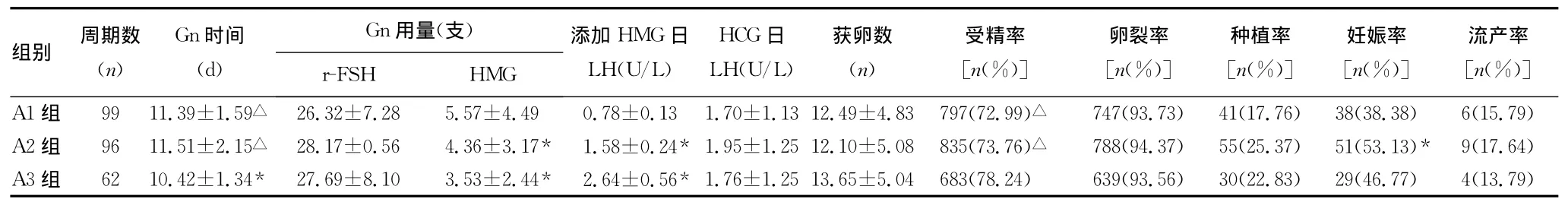
表2 卵泡中晚期不同LH水平添加HMG对IVF-ET临床结局的影响±s)
*:P<0.05,与 A1组比较;△:P<0.05,与A3组比较。
Gn用量(支))]A1组 99 11.39±1.59△ 26.32±7.28 5.57±4.49 0.78±0.13 1.70±1.13 12.49±4.83 797(72.99)△ 747(93.73) 41(17.76) 38(38.38) 6(15.79)组别 周期数(n)Gn时间(d)r-FSH HMG添加HMG日LH(U/L)HCG日LH(U/L)获卵数(n)受精率[n(%)]卵裂率[n(%)]种植率[n(%)]妊娠率[n(%)]流产率[n(%A2组 96 11.51±2.15△ 28.17±0.56 4.36±3.17* 1.58±0.24* 1.95±1.25 12.10±5.08 835(73.76)△ 788(94.37) 55(25.37) 51(53.13)* 9(17.64)A3组 62 10.42±1.34* 27.69±8.10 3.53±2.44* 2.64±0.56* 1.76±1.25 13.65±5.04 683(78.24) 639(93.56) 30(22.83) 29(46.77) 4(13.79)
1.2 方法
1.2.1 IVF-ET过程 所有患者均于前一月经周期黄体中期注射长效达菲林(法国IPSEN公司)进行垂体降调节,月经周期第3~5天使用r-FSH (Gonal-F,瑞士)进行超促排卵,阴道B超及生殖激素监测卵泡发育情况,当卵泡最大直径达14 mm,A组添加 HMG 75~150U,B组继续独用r-FSH。当B超显示3个以上卵泡直径大于或等于18mm,当晚经皮下注射重组人绒毛膜促性腺激素(HCG,德国 Merck公司)250μg,34 h后B超引导下经阴道取卵术。常规体外受精或卵胞浆内单精子显微注射(ICSI),观察并记录卵子受精和胚胎发育情况,取卵后第3天选择2~3枚行胚胎移植,常规黄体支持。4周后B超下见孕囊及原始心管搏动诊断为临床妊娠,继续予黄体支持。
1.2.2 血清生殖激素水平测定 当卵泡最大直径达14mm时取静脉血3mL,分离血清,采用化学发光法(北京倍爱康公司,BHP9507)测定血清LH和雌二醇(E2)水平。
1.3 统计学处理 采用SPSS17.0统计软件进行分析,计量资料以s表示,采用t检验和方差分析,计数资料采用χ2检验,以P<0.05为差异有统计学意义。
2 结 果
2.1 卵泡中晚期添加HMG对IVF-ET的临床结局的影响A组促性腺激素(Gn)时间、Gn用量、受精率及临床妊娠率显着高于B组,但流产率显着低于B组,差异有统计学意义(P<0.05);两组间添加HMG日LH、HCG日LH水平、获卵数、卵裂率及胚胎种植率差异均无统计学意义(P>0.05),见表1。
2.2 卵泡中晚期不同LH水平添加HMG对IVF-ET结局的影响 从A1到A3组,HMG日添加LH水平逐渐递增,A2和A3显着高于A1组,而添加HMG的量逐渐减少,差异有统计学意义(P<0.05);A3组的Gn时间显着低于A1和A2组,受精率则显着高于A1和A2组,差异有统计学意义(P<0.05);A2和A3组的妊娠率均高于A1组,其中A2与A1组间差异有统计学意义(P<0.05);3组间r-FSH用量、HCG日LH水平、卵裂率、胚胎种植率及流产率差异均无统计学意义(P>0.05),见表2。
3 讨 论
两细胞两促性腺激素学说认为,血清LH水平对卵泡的正常发育、成熟和黄体期功能至关重要。过高或过低的LH水平均不利于卵泡生长,并可影响卵子受精能力、胚胎的质量和着床能力[2-3]。在COS中使用GnRH-a降调节,常出现患者体内LH水平过低,单纯用r-FSH促排卵,可出现卵泡发育迟缓,卵子质量差,受精率和种植率下降,临床妊娠率降低及流产率升高,有研究发现,添加LH有助于改善卵子和胚胎质量[4-5]。目前,临床上在COS过程中多数采用HMG或r-FSH进行外源性LH补充。有国外学者证实,添加HMG较单纯采用r-FSH促排卵患者,染色体正常的胚胎数显着增加,且与r-FSH比较,应用 HMG促排卵,活产率可提高4%[6-7]。王松等[8]通过对281例在添加HMG或r-hLH患者的临床资料进行回顾性分析,发现添加HMG或r-hLH患者均获得较高的优胚率及临床妊娠率。本研究中,添加HMG虽较单纯使用r-FSH Gn时间和用量增加,但受精率及临床妊娠率显着升高,流产率降低(P<0.05)。添加HMG日及HCG日LH水平均无显着性差异,提示添加HMG并不会明显升高体内LH水平,对卵母细胞质量产生负面影响。由于1支HMG中含有r-FSH和LH各75U,在卵泡中晚期加入适量HMG可协同r-FSH共同促进卵泡的发育、成熟,因此,对于采用标准长方案治疗的患者,卵泡中晚期添加适量HMG有助于改善妊娠结局。
关于添加HMG日血清LH水平与妊娠结局的关系,目前国内外尚无统一标准。国内有学者认为,Gn第6天血清LH<1.2U/L,添加 HMG可获得较好的临床结局[9],也有学者认为长方案卵巢刺激启动日血LH<1U/L患者早期添加LH对IVF-ET、卵泡浆内单精子显微注射技术结局更有利;而启动日血LH≥1U/L患者,仅在伴有r-FSH慢反应时可以从LH添加中获益[10]。国外一些学者们也存在不同的观点,Kolibianakis等[11]认为在卵巢刺激第8天LH<0.5U/L持续妊娠率最高,而Revelli等[12]对530例卵巢低反应患者的LH添加时机进行了研究,认为在Gn刺激的第7天补充LH,且r-FSH/LH的比例为2∶1(300U∶150U)时促排效果最佳。本研究结果显示,卵泡中晚期随体内LH水平升高,受精率明显提高,这表明一定水平的LH对中晚期卵泡的生长发育至关重要,补充适量LH可以改善卵母细胞的质量,提高受精率。1 U/L≤LH≤2U/L患者获较高的妊娠率,与LH<1.0U/L和LH>2U/L患者差异有统计学意义(P<0.05),获卵率、卵裂率、种植率及妊娠率差异无统计学意义(P>0.05)。在LH<1.0U/L组,由于垂体降调后垂体受到过度抑制,Gn用量和天数增加,但受精率和妊娠率较低,可能与体内LH水平太低,需要更大剂量的LH才能够维持卵泡的正常发育,而HMG的添加剂量不足有关,但过大剂量的HMG可能会导致卵母细胞非整倍体率增加,引起胚胎染色体的异常,增加流产风险[13]。因此,对该类患者增加外源性HMG的剂量能否改善妊娠结局有待进一步研究证实。对于内源性LH水平较高的患者,Humaidan等[14]认为,补充LH并不能改善妊娠率,尤其LH>1.99U/L时无需补充外源性LH。王伟周等[15]也认为血清LH水平控制在2~4U/L即可提高新鲜周期临床妊娠率,本研究中LH>2U/L组患者较其他两组,所需Gn的时间短,需补充的HMG剂量小,但临床妊娠率未明显改善,与上述两者观点一致。
综上所述,在采用GnRH-a降调节方案促超排卵过程中,应在卵泡发育中晚期及时添加HMG,可提高妊娠率,降低流产率,尤其是LH在1~2U/L时添加HMG可在一定程度上改善IVF-ET的临床结局。
[1]黄静,姜宏,张文香,等.促性腺激素释放激素激动剂降调节后血清黄体生成素水平对体外受精-胚胎移植结局的影响[J].生殖医学杂志,2011,20(5):356-359.
[2]Kovacs P,Kovats T,Kaali SG.Results with early follicular phase recombinant luteinizing hormone supplementation during stimulation for in vitro fertilization[J].Fertil Steril,2010,93(2):475-479.
[3]王莹,皮洁.HCG注射日血清LH与IVF-ET妊娠率相关性的临床研究[J].中国优生与遗传杂志,2013,21(6):115,142.
[4]Hill MJ,Levy G,Levens ED.Does exogenous LH in ovarian stimulation improve assisted reproduction success?An appraisal of the literature[J].Reprod Biomed Online,2012,24(3):261-271.
[5]Matorras R,Prieto B,Exposito A,et al.Mid-follicular LH supplementation in women aged 35-39years undergoing ICSI cycles:a randomized controlled study[J].Reprod Biomed Online,2011,22Suppl 1:S43-S51.
[6]Weghofer A,Munne S,Brannath W,et al.The impact of LH-containing gonadotropins on diploidy rates in preimplantation embryos:long protocol stimulation[J].Hum Reprod,2008,23(3):499-503.
[7]Coomarasamy A,Afnan M,Cheema D,et al.Urinary hMG versus recombinant FSH for controlled ovarian hyperstimulation following an agonist long down-regulation protocol in IVF or ICSI treatment:a systematic review and meta-analysis[J].Hum Reprod,2008,23(2):310-315.
[8]王松,陈雷宁,全松.重组人黄体生成激素与人绝经期促性腺激素对IVF-ET结局影响的对比研究[J].国际生殖健康/计划生育杂志,2013,32(1):5-8.
[9]师娟子,田莉,孟彬,等.控制性超促排卵过程中血清LH低于正常时添加rL或HMG的效果比较[J].生殖与避孕,2012,32(9):589-592.
[10]骆丽华,刘雨生,季静娟,等.长方案卵巢刺激启动日血黄体生成激素水平作为黄体生成激素添加指标的价值[J].中国实用妇科与产科杂志,2012,28(8):619-623.
[11]Kolibianakis EM,Zikopoulos K,Schiettecatte J,et al.Profound LH suppression after GnRH antagonist administration is associated with a significantly higher ongoing pregnancy rate in IVF[J].Hum Reprod,2004,19(11):2490-2496.
[12]Revelli A,Chiado′A,Guidetti D,et al.Outcome of in vitro fertilization in patients with proven poor ovarian responsiveness after early vs.mid-follicular LH exposure:a prospective,randomized,controlled study[J].J Assist Reprod Genet,2012,29(9):869-875.
[13]Zhivkova RS,Delimitreva SM,Toncheva DI,et al.Analysis of human unfertilized oocytes and pronuclear zygotes--correlation between chromosome/chromatin status and patient-related factors[J].Eur J Obstet Gynecol Reprod Biol,2007,130(1):73-83.
[14]Humaidan P,Bungum L,Bungum M,et al.Ovarian response and pregnancy outcome related to mid-follicular LH levels in women undergoing assisted reproduction with GnRH agonist down-regulation and recombinant FSH stimulation[J].Hum Reprod,2002,17(8):2016-2021.
[15]王伟周,商微,李敏,等.促性腺激素释放激素激动剂降调节后月经第3天血清黄体生成素值对体外受精-胚胎移植的影响[J].中华临床医师杂志:电子版,2011,5(10):2835-2838.



