王文轩,何卫阳,苟 欣
(重庆医科大学附属第一医院泌尿外科,重庆 400016)
我国的前列腺癌的发病率在逐年升高,多数病例发现时已处于晚期,失去手术时机[1-2]。去势与抗雄激素治疗虽然效果较好,但一般在18~24个月后转化为激素非依赖性前列腺癌,此时,治疗非常棘手。化疗作为一项重要手段,在激素非依赖性前列腺癌中的治疗地位越来越受到重视。但原发性或获得性药物抵抗明显降低了化疗药物的效果。研究表明肿瘤坏死因子相关凋亡诱导配体(tumor necrosis factor-related apoptosis-inducing ligand,TRAIL)可以有效的诱导肿瘤细胞凋亡,且不良反应很小,是一个极具前景的肿瘤治疗药物[3-4]。然而,TRAIL耐药却限制了它的治疗效果,而且其机制仍不明确。TRAIL与它的功能受体DR4及DR5结合后通过外源性凋亡通路促进肿瘤细胞凋亡,TRAIL与受体结合后促进死亡复合体的形成,死亡复合体包括Fas相关死亡域蛋白(FADD)、凋亡蛋白酶8(Caspase8)以及c-FLIP。Caspase8通过自我活化,促进死亡受体下游效应蛋白Caspase7和Caspase3的激活,从而诱导凋亡。
自噬(autophagy)是细胞进化的保守信号通路,通过降解长命蛋白及受损细胞器实现能量的再循环利用,维持细胞的能量平衡。自噬对于维持细胞在缺乏营养状态下的生存以及清除细胞受损的细胞器和多余的蛋白至关重要[5-6]。
目前文献报道,放、化疗可以诱导自噬,但放、化疗诱导的自噬在不同的制剂以及不同的细胞系其作用可能不同,或起促生存或起促死亡作用[7]。虽然有文献报道TRAIL处理结肠癌可以诱导细胞发生自噬,而且抑制自噬可以增强肿瘤细胞TRAIL的敏感性[8];但TRAIL对于前列腺癌细胞是否可以诱导自噬以及自噬的作用如何,还尚不清楚。本文拟研究TRAIL对前列腺癌细胞自噬水平的影响,以及自噬在其中的作用。
1 材料与方法
1.1 试剂 改良型RPMI1640培养液购自Hyclone公司,0.25%胰蛋白酶加乙二胺四乙酸(EDTA)购自Gibco公司,DMSO 购自吉诺生物医药技术有限公司,Anti LC-3B购自Sigma公司;An-ti P62、Caspase8、PARP购自B&D公司。LDH试剂盒购自Promega公司。TRAIL由本实验室提取制备。
1.2 实验方法
1.2.1 细胞株及培养条件 雄激素非依赖性人前列腺癌细胞株PC-3购自ATCC,培养在 RPMI 1640 加上10% 胎牛血清、2 mmol/L谷氨酰胺、100 U/mL青霉素和100 μg/mL链霉素培养基中。
1.2.2 细胞毒性测定 在96孔板内测定应用乳酸脱氢酶释放试验(LDH)进行前列腺癌细胞细胞毒性测定。细胞种植在48孔板内过夜,细胞生长到70%~80%时按图1中标注处理36 h后进行LDH检测。
1.2.3 免疫印迹检测 细胞蛋白质免疫印迹(Western blotting)检测各种细胞用M2 提取总蛋白,取同等量蛋白上样以5%的浓缩胶、12%的分离胶进行SDS-PAGE电泳,电转蛋白至PVDF膜,5% BSA 37 ℃封闭1 h,与一抗4℃孵育过夜,PBS洗膜3次后与辣根过氧化物酶标记的1∶2 000二抗室温孵育1 h。PBS冲洗3次,每次约5 min,然后加显色剂,暗室曝光并洗片。
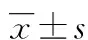
2 结 果
2.1 TRAIL可以诱导自噬 PC-3经TRAIL处理后可以明显增加LC-3BⅠ向LC-3BⅡ的转化;同时可以明显增加P62的降解;这两个蛋白的变化是自噬的主要标志;另外,为了进一步证明这些蛋白的变化是自噬活性增强诱导的,用“自噬潮”实验检测,即是应用抑制自噬体和溶酶体的融合的氯喹(chloroquine,CQ)及TRAIL分别处理PC-3,以及联合二者处理PC-3,结果示:CQ和TRAIL可以适当增加LC-3BⅡ的表达,而二者联合可进一步增加LC-3BⅡ的表达。这些结果可以肯定TRAIL可以诱导自噬。见图1。
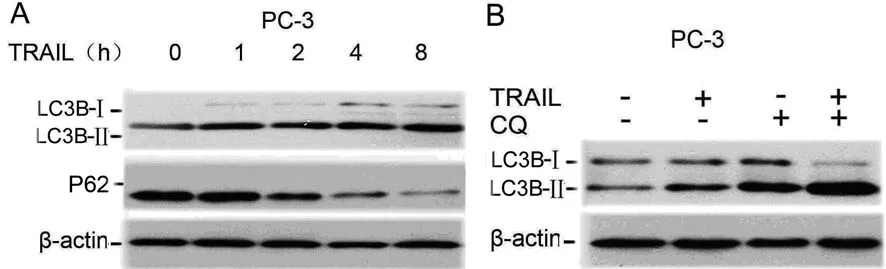
A:TRAIL(150 ng/mL)在不同时间点处理PC-3,然后应用Western blotting检测LC-3B及p62的表达;B:TRAIL(150 ng/mL)和CQ(20 μM)分别或联合处理PC-3 2 h,然后应用Western blotting检测LC-3B的表达。
图1 PC-3细胞LC-3B及p62表达检测
2.2 TRAIL诱导的自噬对前列腺癌细胞起保护作用 PC-3经TRAIL单独处理或TRAIL加不同类型的自噬抑制剂,LDH检测发现,应用不同类型的抑制剂可以明显增加TRAIL的细胞毒性。应用Western blotting检测发现,抑制自噬可以明显增加TRAIL诱导的凋亡蛋白Caspase 8 的活化和PARP的裂解(图2)。
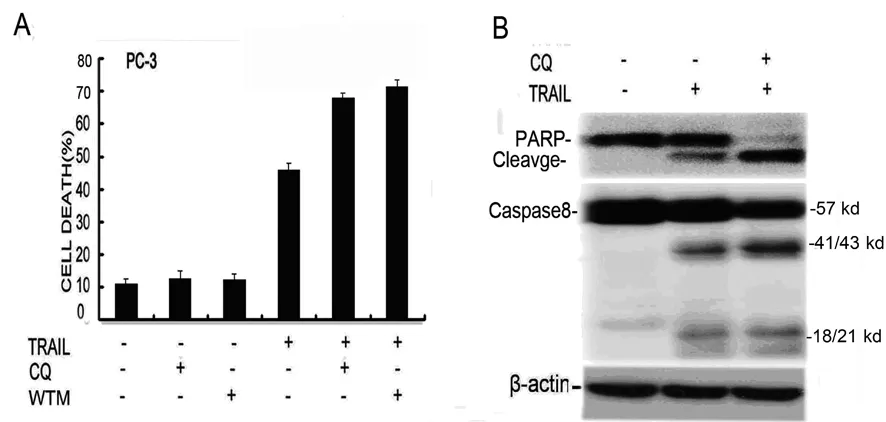
A:PC-3细胞种植于48孔板培养24 h,然后提前半小时加入自噬抑制剂Wortmannin (WMT,1 μM)、CQ(20 μM),再分别加入TRAIL(150 ng/mL)36 h,应用LDH检测细胞的死亡率;B:TRAIL(150 ng/mL)单独和TRAIL(150 ng/mL) 联合CQ(20 μM)处理PC-3 4 h,然后应用Western blotting检测Caspase 8及PARP的表达。
图2 自噬对PC-3细胞活性影响及Caspase 8和PARP的表达检测
3 讨 论
自噬是一种普遍存在的真核细胞特有的生命现象,在维持细胞自我稳态、促进细胞生存方面起重要作用。研究证明:自噬与衰老、神经疾病、肿瘤等密切相关。目前自噬已成为肿瘤领域的研究热点。研究自噬发生的方法较多,但LC-3Bc表达的增强及P62蛋白的降解目前仍是自噬的主要标志物[9]。如图1A所示,TRAIL可以明显增加LC-3BⅡ表达及P62的降解。然而,LC-3BⅡ表达的增强不能完全除外自噬后期的抑制所致,所以“自噬潮”可以进一步确定TRAIL是否可以诱导自噬。如图1 B所示,溶酶体抑制剂氯喹和TRAIL单独可以增加LC-3BⅡ的表达,当联合应用CQ以及TRAIL后则进一步增加LC-3BⅡ的表达。本研究结果表明,TRAIL可以显着诱导前列腺癌细胞的自噬。
研究表明,自噬主要是促生存作用,但在一定条件下,可以促进细胞死亡,所以自噬的作用具有细胞特异性、刺激因子特异性以及环境特异性等特点。故自噬在不同刺激下,在不同的细胞系可能会起不同的作用。自噬在肿瘤的发生、发展甚至转移等方面都具有重要作用,调控自噬目前成为肿瘤治疗的重要手段[10]。虽然文献报道,TRAIL可以诱导敲除Bax的结肠癌细胞Hct116产生自噬,并且抑制自噬可以增加结肠癌细胞的凋亡,然而TRAIL对于前列腺癌PC-3细胞的作用以及可能产生的自噬作用目前仍不清楚。本研究显示,TRAIL可以诱导前列腺癌PC-3细胞产生自噬,而且自噬起保护肿瘤细胞作用,Wortmannin及氯喹抑制自噬均可以显着增加PC-3细胞的死亡率(P<0.05)、凋亡蛋白Caspase8的活化以及PARP的裂解。这与多数恶性肿瘤的研究结果相符。
本研究的结果表明TRAIL可以诱导前列腺癌细胞产生保护性自噬,而抑制自噬可以显着增强TRAIL诱导的前列腺癌细胞凋亡,这对于逆转耐药前列腺癌细胞尤为重要。然而TRAIL诱导自噬的机制目前仍不明确,究竟是通过JNK激活Bcl-xl磷酸化,Beclin复合物解体Beclin1释放通路还是其他信号通路[11-12],还需要后续的进一步研究。
[1]Gu FL,Xia TL,Kong XD.Preliminary study of the frequency of benign prostatic hyperplasia and prostate cancer in China[J].Urology,1994,44(5):688-691.
[2]鲍镇美.前列腺癌的预防及诊断治疗[J].中华泌尿外科杂志,2004,25(12):797-799.
[3]Abdulghani J,El-Deiry WS.TRAIL receptor signaling and therapeutics[J].Expert Opin Ther Targets,2010,14(10):1091-1108.
[4]Hellwig CT,Rehm M.TRAIL signaling and synergy mechanisms used in TRAIL-based combination therapies[J].Mol Cancer Ther,2012,11(1):3-13.
[5]Todde V,Veenhuis M,van der Klei IJ.Autophagy:principles and significance in health and disease[J].Biochim Biophys Acta,2009,1792(1):3-13.
[6]Mizushima N,Komatsu M.Autophagy:renovation of cells and tissues[J].Cell,2011,147(4):728-741.
[7]Wu W,Coffelt S,Cho C,et al.The autophagic paradox in cancer therapy[J].Oncogene,2012,31(8):939-953.
[8]Han J,Hou W,Goldstein LA,et al.Involvement of protective autophagy in TRAIL resistance of apoptosis-defective tumor cells[J].J Biol Chem,2008,283(28):19665-19677.
[9]Klionsky DJ,Abeliovich H,Agostinis P,et al.Guidelines for the use and interpretation of assays for monitoring autophagy in higher eukaryotes[J].Autophagy,2008,4(2):151-175.
[10]Dalby KN,Tekedereli I,Lopez-Berestein G,et al.Targeting the prodeath and prosurvival functions of autophagy as novel therapeutic strategies in cancer[J].Autophagy,2010,6(3):322-329.
[11]Wei Y,Pattingre S,Sinha S,et al.JNK1-mediated phosphorylation of Bcl-2 regulates starvation-induced autophagy[J].Mol Cell,2008,30(6):678-688.
[12]He W,Wang Q,Xu J,et al.Attenuation of TNFSF10/TRAIL-induced apoptosis by an autophagic survival pathway involving TRAF2 and RIPK1/RIP1-mediated MAPK8/JNK activation[J].Autophagy,2012,8(12):1811-1821.



