阿卜力克木·奥布力,程 磊,黄凤玲,闫 冬,迪丽阿热姆·尼加提,帕尔哈提·克热木,魏媛媛
(新疆医科大学:1.药理学教研室;2.临床专业2009级本科生;3.生理学教研室,乌鲁木齐830011)
非酒精性脂肪性肝病(nonalcoholic fatty liver disease,NAFLD)的发病率逐年增加,在较短的时间内可发展为不可逆的肝损害,例如:肝纤维化可达25%,肝硬化可达1.5%~8.0%,现已成为影响健康的重大隐患[1]。目前研究NAFLD的体外细胞模型主要采用油酸(oleic acid,OA)诱导肝细胞造成脂肪沉积,多选用肝癌细胞HepG2作为建模对象,因其具有肿瘤学特性,易于培养、传代及反复冻存[2-5]。采用人正常细胞建立脂肪变性模型的较少,利用Changliver肝细胞建模尚未见报道。由于NAFLD的肝细胞脂肪变性通常发生在正常细胞而非肿瘤细胞上,因此探索正常肝细胞株的建模方法更具有实用性。本研究选择Changliver张氏肝细胞株,利用OA诱导,明确其建模所需的具体浓度,作用时间等实验条件。为研究NAFLD提供一条新途径。
1 材料与方法
1.1 仪器与试剂 Changliver张氏肝细胞株购自中国科学院上海细胞所,胎牛血清(FBS)购自杭州四季青公司、DMEM细胞培养基购自美国Gibco公司、三酰甘油(TG)测定试剂盒购自英科新创生物工程公司,胰酶、油酸、噻唑蓝(MTT)粉、蛋白定量试剂盒、油红O均购自美国Sigma公司。全自动酶联免疫检测仪购自美国Bio-Rad公司,倒置相差免疫荧光显微镜购自日本Olympus公司。
1.2 方法
1.2.1 细胞培养 Changliver张氏肝细胞株置于10%FBS,DMEM完全培养基4mL,5%CO2孵箱中培养。当细胞达80%~90%密度时传代,24~48h传1次,按细胞的多少约1∶2或1∶3传代于新的细胞培养瓶内。细胞生长稳定良好即可使用。将Changliver细胞以104个/孔接种于96孔培养板中,每孔内加入含细胞培养基200μL,在37℃,5%CO2孵箱孵育24h。
1.2.2 OA 造模浓度的确立 分别用 DMSO 和0.2、0.4、0.6、0.8、1.0、2.0、3.0、4.0mmol/L不同浓度 OA 干预后(每组样本数为6),予油红O染色,分别于24、48h和72h3个时间点进行镜下观察,依据MTT结果,脂变率及镜下细胞脂变程度确定OA作用的最佳浓度和作用时间并作为模型组的OA浓度。
1.2.3 细胞形态学观察 每日用倒置显微镜观察培养细胞的生长状况及形态变化。组织学中当肝细胞内脂滴形成超过5%可定义为脂肪肝[6]。
1.2.4 四甲基偶氮唑盐比色(MTT)法检测细胞活力 将Changliver细胞接种于96孔培养板,置于10%FBS RPMI-1640完全培养基5mL。当细胞达80%~90%密度时传代,24~48h传1次,按细胞的多少约1∶2或1∶3传代于新的细胞培养瓶内。细胞进入指数生长期后将Changliver细胞以104个/孔接种于96孔培养板中,每孔内加入含细胞培养基200 μL,在37℃,5%CO2孵箱孵育24h。观察细胞贴壁情况。分别设对照组和各浓度 OA组(0.2、0.4、0.6、0.8、1.0、2.0、3.0、4.0mmol/L),每组设6个复孔。各组细胞分别于作用24、48、72h时,于每孔加入20μL MTT溶液,继续孵育4h后终止培养。吸去孔内培养液。每孔加入二甲亚砜(DMSO)溶液100 μL,置于微板振荡器震荡10min,以使结晶物充分溶解。全自动酶标仪490nm处测量各孔的吸光度值(A值)。记录结果,并以时间为横坐标,A值为纵坐标绘制细胞生长曲线。
1.2.5 细胞各时间点脂变率的计算 光镜下观察油红O染色的细胞片,并对脂肪变性细胞计数。结果判定标准:发生脂肪变性的细胞胞质内出现橘红色脂滴;记录标准:随机选取6个高倍视野,每个视野计数100个细胞,计算其平均脂变率。
1.2.6 细胞内TG的检测 将Changliver细胞接种于6孔板,按上述分组予以处理,24h后收集细胞,磷酸盐缓冲液(PBS)清洗2次,加入RIPA细胞裂解液震荡,冰上放置30 min,待细胞充分裂解,4℃,14 000r/min离心10min并取上清液。采用BCA法检测蛋白含量。以氧化酶法检测TG的含量,于波长500~550nm处,空白孔调零,测A值,绘制标准曲线并计算TG浓度。计算结果表示为每克细胞总蛋白中所含的TG量。
1.3 统计学处理 采用SPSS13.0统计软件进行分析,计量资料以±s表示,多个样本均数的比较采用单因素方差分析,以P<0.05为差异有统计学意义。
2 结 果
2.1 细胞形态学观察 倒置显微镜观察可见对照组细胞排列紧密,边缘清晰。经OA诱导后,Changliver细胞明显生长旺盛,边缘尚清晰。且较多细胞变圆、核大,部分细胞核被挤到一侧,类似印戒样改变。
2.2 MTT法检测细胞活力OA浓度0.2mmol/L 时,Changliver细胞的增殖几乎不受抑制,细胞增殖程度跟空白组接近,随着OA浓度的升高和时间的增长,其细胞增殖受到不同程度的抑制,见表1、图1。
表1 不同浓度OA在不同时间点对Changliver细胞活力的影响 (A值,±s)
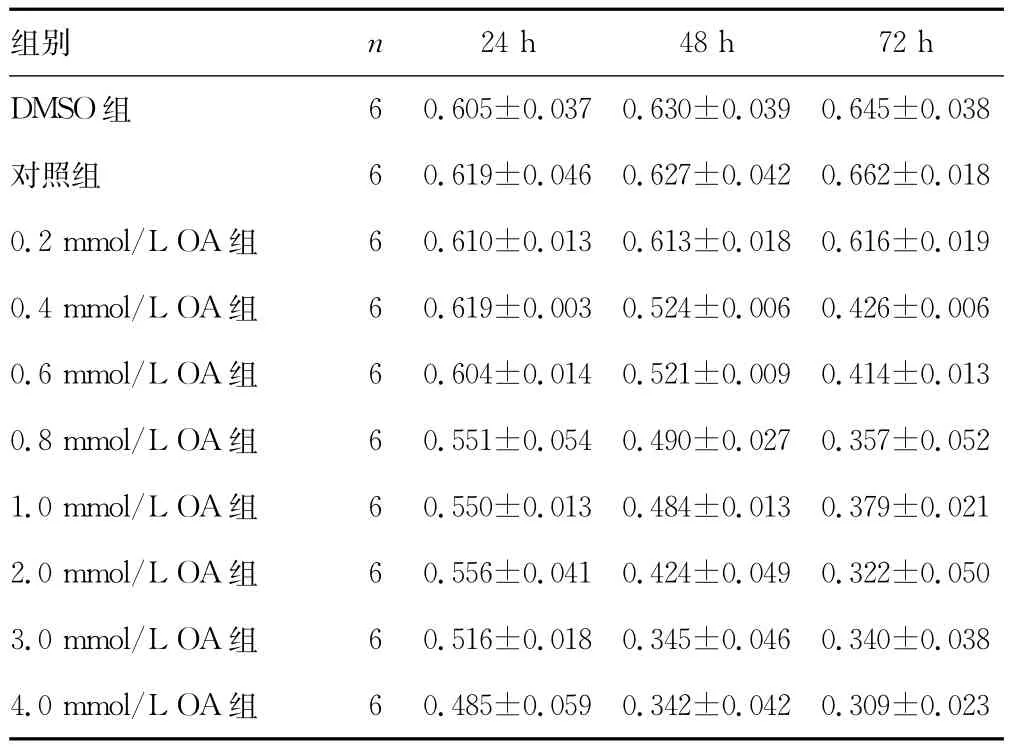
表1 不同浓度OA在不同时间点对Changliver细胞活力的影响 (A值,±s)
6 0.605±0.037 0.630±0.039 0.645±0.038对照组 6 0.619±0.046 0.627±0.042 0.662±0.018 0.2mmol/L OA组 6 0.610±0.013 0.613±0.018 0.616±0.019 0.4mmol/L OA组 6 0.619±0.003 0.524±0.006 0.426±0.006 0.6mmol/L OA组 6 0.604±0.014 0.521±0.009 0.414±0.013 0.8mmol/L OA组 6 0.551±0.054 0.490±0.027 0.357±0.052 1.0mmol/L OA组 6 0.550±0.013 0.484±0.013 0.379±0.021 2.0mmol/L OA组 6 0.556±0.041 0.424±0.049 0.322±0.050 3.0mmol/L OA组 6 0.516±0.018 0.345±0.046 0.340±0.038 4.0mmol/L OA组24h 48h 72h DMSO组组别 n 6 0.485±0.059 0.342±0.042 0.309±0.023
2.3 油红O染色观察结果 油红O染色结果显示,对照组细胞核呈紫蓝色,边缘清晰,细胞内未见明显橘红色脂滴(图2),OA浓度为0.2mmol/L和0.4mmol/L时,油红 O染色见细胞内充满大小不等的橘红色脂滴,有些甚至融合(图3、4)。OA浓度0.6、0.8、1.0、2.0mmol/L时,随着浓度的升高,细胞内脂滴增多,同时OA对细胞的毒性也增加,细胞边缘不清晰,形状不规则,数量减少(图9、10)。Changliver细胞各浓度和时间点脂变率的比较,见表2。根据结果确定Changliver细胞建立脂肪变性条件为0.2mmol/L OA培养细胞24h。
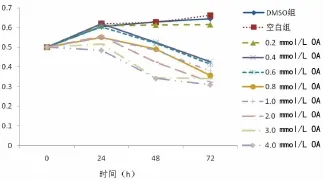
图1 不同OA浓度下Changliver细胞生长曲线
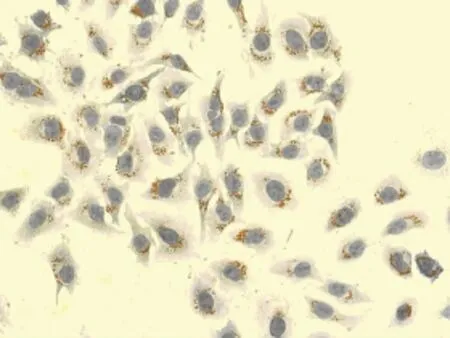
图2 对照组油红O染色(×200)
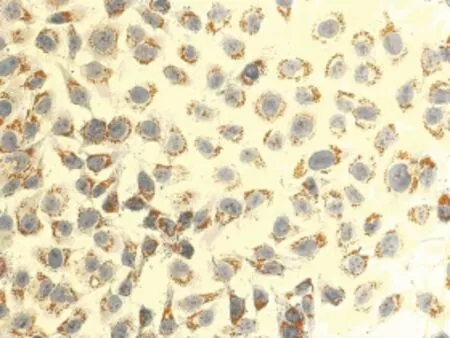
图3 0.2mmol/L OA组油红 O染色(×200)
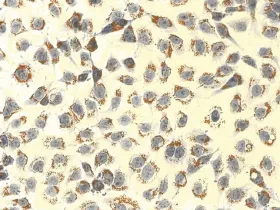
图4 0.4mmol/L OA组油红 O染色(×200)
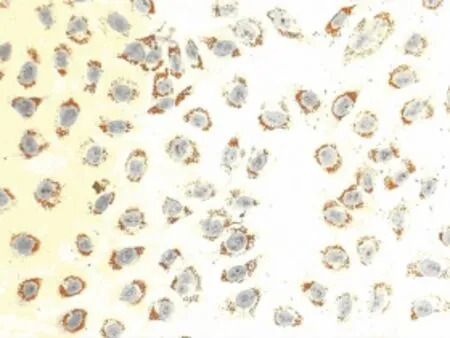
图5 0.6mmol/L OA组油红 O染色(×200)
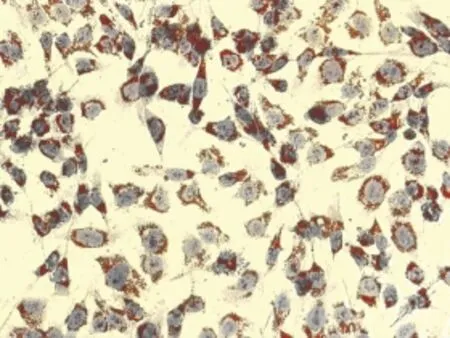
图6 0.8mmol/L OA组油红 O染色(×200)

图7 1.0mmol/L OA组油红 O染色(×200)

图8 2.0mmol/L OA组油红 O染色(×200)
表2 各浓度OA作用下Changliver细胞不同时间点的脂变率(±s,%)
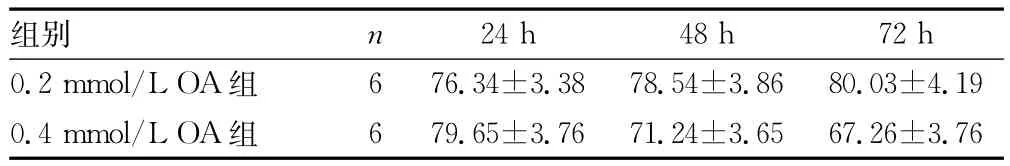
表2 各浓度OA作用下Changliver细胞不同时间点的脂变率(±s,%)
24h 48h 72h 0.2mmol/L OA组组别 n 6 76.34±3.38 78.54±3.86 80.03±4.19 0.4mmol/L OA组6 79.65±3.76 71.24±3.65 67.26±3.76
续表2 各浓度OA作用下Changliver细胞不同时间点的脂变率(±s,%)
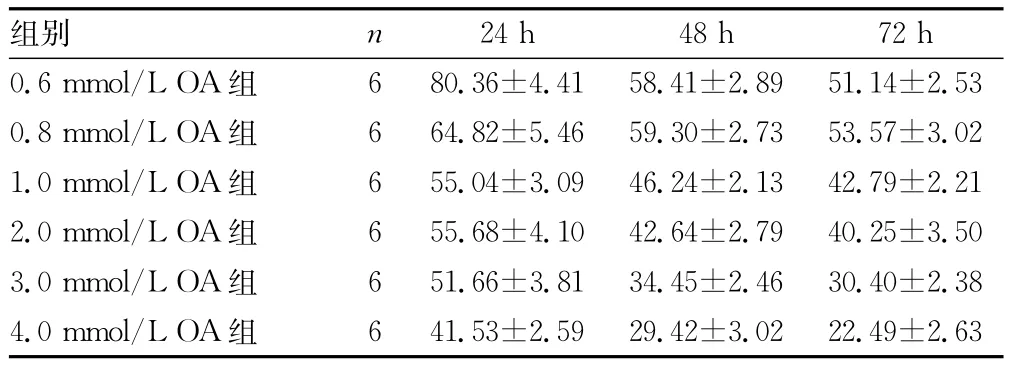
续表2 各浓度OA作用下Changliver细胞不同时间点的脂变率(±s,%)
24h 48h 72h 0.6mmol/L OA组组别 n 6 80.36±4.41 58.41±2.89 51.14±2.53 0.8mmol/L OA组 6 64.82±5.46 59.30±2.73 53.57±3.02 1.0mmol/L OA组 6 55.04±3.09 46.24±2.13 42.79±2.21 2.0mmol/L OA组 6 55.68±4.10 42.64±2.79 40.25±3.50 3.0mmol/L OA组 6 51.66±3.81 34.45±2.46 30.40±2.38 4.0mmol/L OA组6 41.53±2.59 29.42±3.02 22.49±2.63
2.4 Changliver细胞内TG含量的变化 Changliver细胞模型组与对照组比较,TG含量显着增高(P<0.01);符合NAFLD的细胞模型要求。
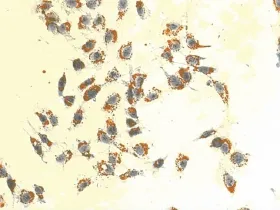
图9 3.0mmol/L OA组油红 O染色(×200)
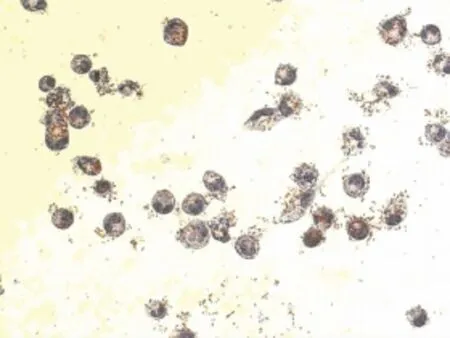
图10 4.0mmol/L OA组油红O染色(×200)
表3 石榴花多酚对OA诱导脂肪变形细胞内TG的影响(±s)
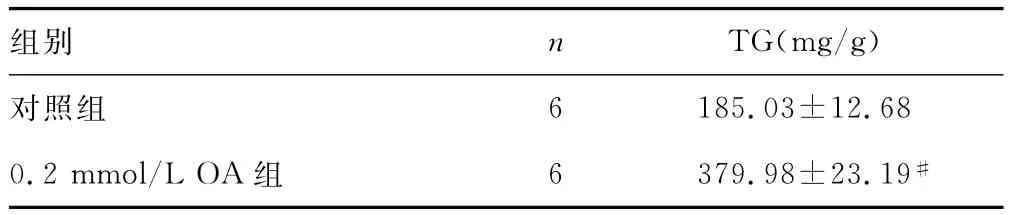
表3 石榴花多酚对OA诱导脂肪变形细胞内TG的影响(±s)
#:P<0.01,与对照组比较。
组别 n TG(mg/g)6 185.03±12.68 0.2mmol/L OA 组 6 379.98±23.19对照组#
3 讨 论
目前,制备肝细胞脂肪变模型的常用细胞是肝癌细胞HepG2和正常肝细胞L02。本研究选用人正常肝细胞株Changliver细胞进行脂肪肝模型的制备,因其分化特性与正常肝细胞相似,具有L02细胞所没有的无限传代的特点,且培养方法与原代细胞相比相对简单,但不属于肿瘤细胞。因此,实验结果更接近于由正常肝细胞发展而来的非酒精性脂肪肝在体模型的特点,是体外研究NAFLD较为理想的细胞模型。但目前尚无关于Changliver细胞脂肪变建模的报道。
OA是一种单不饱和脂肪酸,主要存在于植物油中,又被称作十八(碳)烯酸。研究表明,肝细胞可摄取在链长为C12~C18的长链脂肪酸,将其酯化成中性脂滴后,储存于肝细胞内。依据此原理Yasuyuki等[7]首次应用OA诱导HepG2细胞24 h后,成功造成人源性肝细胞株的脂肪变性模型。杨林辉等[8]应用低浓度OA诱导L02细胞72h,建立肝细胞脂肪变性模型。
本实验选用不同浓度OA诱导Changliver细胞,在不同的时间点通过MTT检测和油红O染色明确建模所需的最佳诱导浓度和时间,依据MTT检测、油红O染色和TG检测验证,0.2mmol/L浓度OA作用细胞24h,细胞脂变明显。随着诱导时间的延长,超过48h后,脂滴不再增加反而减少。当OA≥0.2mmol/L时,脂变虽然有所增加,但细胞受损程度也逐渐增加,与杨林辉等[8]在制备HepG2脂肪肝细胞造模中的现象相似。提示OA对细胞有一定的毒性,有研究认为当肝细胞内不饱和脂肪酸蓄积,可通过细胞色素P4502E1酶途径引起脂质过氧化,进一步促进细胞凋亡从而产生细胞毒性[9]。Cui等[10]发现经OA诱导后的肝细胞中超氧化物酶-1(SOD-1)含量明显减少,这种自由基清除酶可以在脂质过氧化过程中保护细胞膜免受自由基的攻击。因此OA的细胞毒性与脂质过氧化及细胞的抗氧化能力降低有关。
综上所述,本实验造模方法所需时间较短,且细胞来源方便,性质稳定,是一种研究NAFLD的理想方法。
[1] Kobashi-margain RA,Gutierrez-grobe Y,Ponciano-rodriguez G,et al.Prevalence of type 2diabetes mellitus and chronic liver disease a retrospective study of the association of two increasingly common diseases in Mexico[J].Ann Hepatol,2010,9(3):282-288.
[2] Feldstein AE,Werneburg NW.Free fatty acids promote hepatic lipotoxicity by stimulating TNF alpha expression via alysosomal pathway [J].Hepatology,2004,40(1):185-194.
[3] 吕业春,刘翼翔,吴薇,等.蓝莓多酚对油酸诱导HepG2细胞脂肪累积的干预作用[J].食品科学,2011,32(17):308-312.
[4] Day CP,James OF.Steatohepatitis:atale of two"hits"[J].Gastroenterology,1998,114(4):842-845.
[5] Gómez-Lechón MJ,Donato MT,Martínez-Romero A,et al.A human hepatocellular in vitro model to investigate steatosis[J].Chem Biol Interact,2007,165:106-116.
[6] Kleiner DE,Brunt EM,Van Natta M,et al.Nonalcoholic steatoheptitis clinical research network.Design and validation of a histological scoring system for nonalcoholic fatty liver disease[J].Hepatology,2005,41(6):1313-1321.
[7] Okamoto Y,Tanaka S,Haga Y.Enhanced GLUT2gene expression in all oleic acid-induced in vitro fatty liver model[J].Hepatol Res,2002,23(2):138-144.
[8] 杨林辉,陈东风.油酸诱导培养肝细胞脂肪变性模型的建立[J].重庆医学,2007,36(8):698-700.
[9] Sung M,Kim I,Park M,et al.Differential effects of dietary fatty acids on the regulation of CYP2E1and protein kinase C in human hepatoma HepG2cells[J].J Med Food,2004,7(2):197-203.
[10] Cui W,Chen SL,Hu KQ.Quantification and mechanisms of oleic acid-induced steatosis in HepG2cells[J].Am J Transl Res,2010,2(1):95-104.



