阳 琰,高 琳△,邓华聪,晏永慧,李显文,王小英,廖 鑫,张 晗,陈其荣,王 茜
(1.遵义医学院附属医院内分泌科563003;2.重庆医科大学附属第一医院400016)
高三酰甘油(hypertriglyceridemia,HTG)血症在胰岛素抵抗(insulin resistance,IR)相关性疾病如肥胖、2 型糖尿病(T2DM)、冠心病等的发展中起重要作用[1]。HTG血症与T 2DM发病率增多有关。HTG 血症是T2DM发生的独立危险因素,以HTG为标志的脂代谢异常常伴IR,其可能发生在糖代谢紊乱之前[2]。因此,HTG血症的危害已经引起内分泌学者的高度重视。灯盏花素(breviscapine)是从菊科短亭飞蓬属植物中提取出来的黄酮类有效成分,是灯盏乙素和少量甲素的混合物,其中灯盏乙素含量占95%以上,灯盏花素药理活性广泛,具有抗血小板、抗血栓等作用,被广泛应用于临床治疗,并具有降低TG的作用[3],但其具体作用机制不清楚。目前发现TG与肝脏过氧化物酶体增殖物激活受体-α(peroxisome proliferator-activated receptor-alpha,PPAR-α)、载脂蛋白A5(apolipoprotein A5,apo A5)基因表达密切相关[4],但灯盏花素降低TG是否也与PPAR-α、apo A5 基因表达有关,目前国内外未见相关研究报道。因此,本研究拟通过观察灯盏花素在不同时间点对HepG2 肝细胞内PPAR-α、apo A5 表达及三酰甘油含量的影响,旨在初步探讨灯盏花素降低三酰甘油的可能机制,为进一步探索灯盏花素调节TG 代谢的具体机制奠定一定的基础。
1 材料与方法
1.1 主要试剂HepG2 细胞购于协和医院细胞库。灯盏花素注射液购于昆明龙津药业股份有限公司。DMEM购于Gibco-BRL 公司,胎牛血清购于杭州四季青公司。实时荧光定量PCR试剂 盒 购 于Takara公 司。apoA5抗 体(ab36974)购 于Santa Cruz 公司。二抗和细胞蛋白抽提试剂盒均购于宝生物公司。三酰甘油测定试剂盒购于北化康泰临床试剂公司。
1.2 细胞培养与分组Hep G2 细胞被培养于含10%胎牛血清的DMEM培养基中,置于37 ℃、5%CO2培养箱中培养,0.25%胰酶进行消化,每2~3 天更换1 次培养基并进行传代。HepG2 肝细胞接种于6 孔板中,12h 后长至融合度为80%左右,更换为无血清的DMEM培养基,在浓度依赖实验的基础上,选取100 mmol/L 灯盏花素进行时间依赖实验。加入100 mmol/L 灯盏花素,不同干预时间点(0、6、12、24、36、48 h),分别定义为:(1)0 h 组(空白对照);(2)6h 组;(3)12h 组;(4)24 h 组;(5)36h 组;(6)48h 组;每组取3 个复孔,所测结果取3 孔平均值。
1.3 测定各组细胞apo A5 基因及TG含量PPAR-α引物正义:5′-ACT TAT CCT GTG GTC CCC GG-3′;反义:5′-CCG ACA GAA AGG CAC TTG-3′;apo A5引 物 正 义:5′-ACG CAC GCA TCC AGC AGA-3′;反 义:5′-TGA AAG ATT CGG AAA C-3′;GAPDH引物正义:5′-TAG TTG CGT TAC ACC CTT TCT-3′;反义:5′-TGC TGT CAC CTT CAC CG-3′。提取细胞总RNA,以总RNA 1.5μg 为逆转录反应模板,进行逆转录总的反应体积是20μL。反应体系总体积为25 μL,sterile water 16.3μL,10 ×Taq buffer 2.5μL,引物1(10 μM)0.75μL,引物2(10μM)0.75μL,MgCl2(25 m M)1.5 μL,4d NTP(2.5 m M)2μL,cDNA 1μL,Taq酶5 U (0.2 μL)。条件:94℃5 min,94℃30 s,退火温度30 s,72℃延长20 s,循环34 次,72 ℃延长10 min。按照TG试剂盒说明书进行操作(酶法测定)。
1.4 测定各组细胞apo A5 蛋白表达 收集经上述处理后的细胞,用BCA法定量测定各组细胞apo A5 蛋白表达水平。取30μL 蛋白质加样,经12%PAGE电泳后转移到PVDF 膜上,取apo A5一抗的稀释度为1∶2000,二抗的稀释度为1∶1000,碱性磷酸酶法显色,曝光。
1.5 统计学处理 应用SPSS16.0统计软件包进行统计分析,计量资料采用±s表示,正态分布资料应用随机区组设计资料的方差分析及其两两比较,分析各组细胞内apo A5 基因、蛋白表达及TG含量的差异。P<0.05 为差异有统计学意义。
2 结 果
在0~24 h之 内,HepG2肝 细 胞 内PPAR-α、apoA5基 因及蛋白表达水平随着灯盏花素作用时间增加而增加,当达到36 h 后HepG2 肝细胞内PPAR-α、apoA5 基因及蛋白表达水平开始下降,48 h下降最明显,但均高于空白对照组(P<0.05);而肝细胞内三酰甘油含量在0~24 h 之内随着灯盏花素作用时间增加反而降低,至24 h时降到最低(P<0.05),36 h 后又开始升高,48 h升高最明显,但均低于空白对照组(P<0.05),见表1、2,图1、2。

图1 灯盏花素在不同时间点对Hep G2 肝细胞PPAR-α蛋白表达的影响
表1 灯盏花素在不同时间点对HepG2肝细胞PPAR-α、apo A5 mRNA表达及TG的影响(±s)

表1 灯盏花素在不同时间点对HepG2肝细胞PPAR-α、apo A5 mRNA表达及TG的影响(±s)
时间(h) PPAR-α apoA5 TG(mg/g)0(空白对照)0.823±0.1130.0027±0.00031228.8±144.261.323±0.153*# 0.0051±0.0008*# 849.3±104.4*#123.132±0.421*# 0.0069±0.0011*# 628.2±85.1*#
续表1 灯盏花素在不同时间点对Hep G2肝细胞PPAR-α、apo A5 m RNA表 达 及TG的 影 响(±s)

续表1 灯盏花素在不同时间点对Hep G2肝细胞PPAR-α、apo A5 m RNA表 达 及TG的 影 响(±s)
时间(h) PPAR-α apoA5 TG(mg/g)244.357±0.075*# 0.0121±0.0018*# 422.2±67.2*#361.631±0.023*# 0.0059±0.0010*# 712.3±77.4*#481.172±0.014*# 0.0042±0.0006*# 952.3±94.1*#
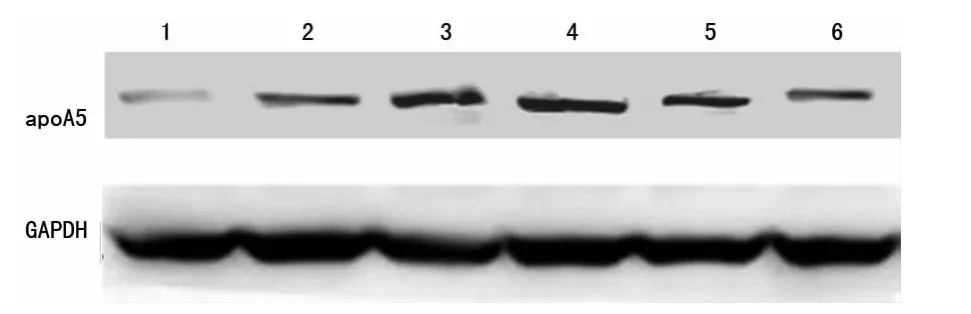
图2 灯盏花素在不同时间点对Hep G2 肝细胞apo A5 蛋白表达的影响
3 讨 论
2011年欧洲心脏病学会(ESC)和欧洲动脉粥样硬化学会(EAS)联合发布的血脂异常管理指南明确指出,TG在脂毒性危害中占据非常重要的地位。肝脏是三酰甘油代谢的重要器官,高三酰甘油血症是糖尿病发生、发展的重要病理生理基础和特征[5]。肝脏中有许多调控三酰甘油代谢的基因表达,其中apo A5 基 因 与TG、IR、代 谢 综 合 征 密 切 相 关[6-7],因 此,从apo A5 基因出发进行研究,可能对于阐明T2DM、HTG血症的发生、发展有非常重要的意义。
在临床治疗中,多数糖尿病患者均具有高TG血症,在进行降糖治疗过程中,应积极考虑降脂治疗,但传统降脂药物可能驱使血脂更集中于肝脏进行代谢,反而促使脂质贮积并损害肝功能[8],尤其对于糖尿病合并脂肪肝的患者极为不利。近年研究表明灯盏花素的药理作用非常广泛,被广泛应用于临床治疗,其疗效肯定,除扩张微血管、降低血液黏稠度、改善微循环外,还具有降低血脂,尤其是TG,并对糖尿病性肝脏损害有一定的治疗和保护作用[9],但其具体作用机制仍不清楚。因此,本研究通过观察灯盏花素在不同时间点对人HepG2细胞内TG含量的影响,旨在初步探讨灯盏花素降低肝脏内TG的机制,可能为防治糖尿病性脂肪肝提供一点新的思路和靶点。
本研究结果发现,在0~24 h 随着灯盏花素作用时间的增加,Hep G2 肝细胞内PPAR-α、apoA5 基因、蛋白表达水平也随之增加,当达到36 h 后又开始下降,48h 下降最明显,但均高于空白对照组(P<0.05);而肝细胞内TG含量在0~24 h 随着灯盏花素作用时间增加而降低,至24 h 时TG含量降到最低(P<0.05),36 h 后又开始上升,48h 升高最明显,但均低于空白对照组(P<0.05)。由此可推测,灯盏花素能降低肝脏TG含量,并具有时间依赖性,其机制可能是通过增加PPAR-α的表达,进而增加apo A5 表达从而使TG含量降低,但其具体机制有待进一步研究探索。
[1] Hirabara SM,Curi R,Maechler P,et al.Saturated fatty acid in-duced insulin resistance is associated with mitochondrial dysfunction in skeletal muscle cells[J].J Cell Physiol,2010,222(1):187-194.
[2] Sanyal D,Ghosh S,Mukherjee P,et al.Dyslipidemia,metabolic syndrome,and liver enzymes in impaired glucose tolerance and new onset untreated,type 2 diabetes Indian subjects[J].Indian J Endocrinol Metab,2012,16(2):434-435.
[3] Xu XX,Zhang W,Zhang P,et al.Superior renoprotective effects of the combination of breviscapine with enalapril and its mechanism in diabetic rats[J].Phytomedicine,2013,20(1):820-827.
[4] Ramakrishnan L,Sachdev HS,Sharma M,et al.Relationship of APOA5,PPAR-γand HL gene variants with serial changes in childhood body mass index and coronary artery disease risk factors in young adulthood[J].Lipids Health Dise,2011(10):68.
[5] Feher M,Greener M,Munro N.Persistent hypertriglyceridemia in statin-treated patients with type 2 diabetes mel-litus[J].Diabetes Metab Syndr Obes,2013(6):11-15.
[6] Chien KL,Hsu HC,Chen YC,et al.Association between sequence variant of c.553 G>T in the apolipoprotein A5 gene and metabolic syndrome,insulin resistance,and carotid atherosclerosis[J].Transl Res,2009,154(3):133-141.
[7] Gonzales JC,Gordts PL,Foley EM,et al.Apolipoproteins E and AV mediate lipoprotein clearance by hepatic proteoglycans[J].J Clin Invest,2013,123(6):2742-2751.
[8] Busaranogla M ,Acbay O,Sonsuz A.A controlled trial of gemfibrozil in the treatment of patients with nonalcoholic steatohepatitis[J].J Hepatol,1999,31(2):384.
[9] Wang M,Xie C,Cai RL,et al.Studies on antioxidant activities of breviscapine in the cell-free system[J].Am J Chin Med,2008,36(6):1199-1207.



