蔡 佳,章述军,秦 波
(重庆医科大学附属第一医院感染科 400016)
药物性肝内胆汁淤积是临床最常见胆汁淤积的原因之一。Cajal间质细胞 (interstitial cells of Cajal,ICC)是胃肠道的起搏细胞,它产生和传导慢波引起平滑肌自发节律性收缩,在调节胃肠道蠕动方面起着重要作用[1]。同时大量研究证实ICC也存在于胃肠道以外的器官如胆道系统中[2]。大黄素(emodin)是中药大黄的主要有效成分,具有多种药理作用。有实验表明大黄素具有保肝、降黄疸作用[3],同时大黄素也能显着增加结肠ICC的数量从而发挥其调节肠道蠕动和导泻的作用。已有研究证实:胆囊存在Cajal样细胞,它在调节胆道运动方面具有重要的作用。胆道系统中ICC是否也能调节胆道的蠕动,在胆汁淤积中起重要作用,目前尚不清楚。近来研究表明ICC能特异性表达c-kit受体,并且c-kit信号途径对于ICC的发生、发育具有重要作用,持续的c-kit信号刺激ICC形成和维持所必须的条件,c-kit敲除可导致ICC缺失,c-kit阳性是ICC的主要鉴定标准之一。本研究试图通过胆汁淤积模型及大黄素干预模型中胆管内c-kit阳性ICC数量变化及其对肝功能生化指标的影响,探求大黄素对肝内胆汁淤积的治疗作用与胆管ICC数量的关系。
1 材料与方法
1.1 实验动物 选用雄性SD大鼠,体质量200g,共15只,采用简单随机法均分为3组,即对照组、药物性肝内胆汁淤积模型组(模型组)及大黄素干预组(大黄素组)。
1.2 模型建立及标本采集
1.2.1 药物性肝内胆汁淤积模型及大黄素干预模型建立 参照蒋峻华等[4]的方法建立模型组,将异硫氰酸萘酯(α-naphthyl isothiocyanate,ANIT)用橄榄油配制成20g/L,大黄素用5g/L羧甲基纤维素钠配制成4g/L的混悬液备用。将4%ANIT,予大鼠灌胃,首剂为15mg/100g,24h后再予5mg/100g。48h后,SD大鼠肝内胆汁淤积型肝炎的模型建成,在病理学上与临床上的药物诱导的肝内胆汁淤积型肝炎相似。对照组则予等容量的生理盐水灌胃。造模4~6h后大黄素组按20mg·kg-1·d-1剂量给予大黄素灌胃,均为1次/天,连续治疗7d,第7天给药后4h,分离血清并留取肝脏标本[5]。对照组则仍给予等体积等渗盐水灌胃。对照组、模型组及大黄素组均在7d后取标本。造模结束后光镜下观察可见:肝细胞内见胆色素沉积,毛细胆管内胆汁淤积,汇管区较多炎性细胞浸润。肝功能生化指标可见:血清丙氨酸基转移酶(alanine transaminase,ALT)、碱性磷酸酶 (alkaline phosphatase,ALP)、总胆红素(direct bilirubin,TBIL)、γ-谷 氨 酰 转 肽 酶 (γ-glutamyl transpeptidaser,γ-GT)显着高于对照组,证明肝内胆汁淤积型模型造模成功。
1.2.2 标本采集 实验结束后,用水合氯醛(250mg/kg)腹腔麻醉后开腹,然后抽取心脏血及摘眼球取血,留取相应肝组织块,分别以10%福尔马林及2%戊二醛液浸泡固定,血标本抗凝、离心后取上清液保存。肝组织固定,石蜡包埋,常规苏木精-伊红(HE)染色,光学显微镜下观察病理变化。
1.2.3 生化指标检测 用日立7600生化自动检测仪检测,移液器将0.5mL血清移入加样管中,系统自动取样分析,获取血清标本检测 ALT、ALP、D-Bil、γ-GT水平。
1.3 胆管ICC免疫组织化学及反转录PCR(reverse transcription-polymerase chain reaction,RT-PCR)法
1.3.1 免疫组织化学鉴定胆道ICC分布 动物禁食6h后,颈椎脱臼处死。剖腹立即取胆总管及部分肝内胆管,PBS(pH=7.4)冲净肠内容物,行冰冻切片,厚7μm。切片用丙酮(4℃)固定10min,PBS洗5min×3次。免疫组织化学步骤参照SABC免疫组织化学试剂盒说明书进行。其中ACK2抗体(5mg/L)于4℃孵育过夜,免疫反应产物显示为棕黄色。免疫组织化学结果判定:c-kit阳性染色为棕黄色,定位于肌层,表现为以胞体为中心的向相反方向延伸的2个或2个以上长突起,常常与邻近的ICC突起相互连接构成网络[6]。采用MetaMorph/DP10/BX41显微图像分析系统分析结果,以积分光密度(integral optical density,IOD)代表蛋白颗粒密度。
1.3.2 胆管总mRNA提取及RT-PCR 动物禁食6h后,颈椎脱臼处死。取胆总管及肝内胆管,PBS漂洗干净。用总RNA抽提试剂Trizol提取总核糖核酸(RNA),再应用Dynbeads dT(25)从所提取的总RNA中提取出总信使核糖核酸(mRNA),其后逆转录成互补脱氧核糖核酸(cDNA)。c-kit的扩增条件为:94 ℃,5min;94 ℃,15s;50 ℃,60s;72 ℃,60s 40个循环,最后72℃,8min。c-kit上游引物序列:5′-GTA CAT AGA AAG AGA CGT GAC TCC T-3′,下游引物序列:5′-GAG TTG ACC CTC ACG GAA TGG TCC A-3′,扩增产物为548bp。β-actin上游引物序列5′-GGC TAC AGC TTC ACC ACC AC-3′,下游引物序列:5′-TAC TCC TGC TTG CTG ATC CAC-3′,扩增产物为285bp。扩增产物(3μL)在12%琼脂糖凝胶中电泳分离,溴化乙锭染色观察DNA条带。
1.3.3 结果分析 使用德国Labimage图像分析系统对电泳结果进行量化分析,计算各个组别的c-kit/β-actin的比值作为mRNA表达的相对定量。
1.4 统计学处理 采用SPSS19.0统计软件进行统计分析,计量资料用±s表示,并用完全随机设计方差分析进行统计检验,检验水准α=0.05,以P<0.05为差异有统计学意义。
2 结 果
2.1 药物性肝内胆汁淤积模型建立 模型组 ALT、TBIL、ALP和γ-GT水平较对照组相比明显升高(F=34.88,P<0.05;F=51.86,P<0.05;F=27.25,P<0.05;F=28.08,P<0.05),大黄素组上述指标水平较对照组也有明显升高,但比模型组低,组间差异有统计学意义(F=34.88,P<0.05;F=51.86,P<0.05;F=27.25,P<0.05;F=28.08,P<0.05),见表1。
病理组织观察:光镜下,对照组:肝小叶结构完整,肝细胞形态正常。无变性坏死、炎症细胞浸润和纤维组织增生等改变。模型组:肝细胞内见胆色素沉积,中央静脉淤血,可见肝细胞大量混浊肿胀、空泡变性,灶性坏死,汇管区较多炎性细胞浸润及胆管上皮细胞增生。表明实验大鼠服用ANIT后,成功构建肝内胆汁淤积型肝炎模型。
表1 不同组别肝功能相关生化指标比较(±s,n=5)

表1 不同组别肝功能相关生化指标比较(±s,n=5)
a:P<0.05,与对照组比较;b:P<0.05,与模型组比较。
组别 ALT(U/L) TBIL(μmol/L) ALP(U/L) γ-GT(U/L 8.7±1.1 54.1±13.5 312.2±73.3 2.2±0.6模型组 398.2±87.4a465.0±90.7a 680.1±82.6a7.2±1.3a大黄素组 280.5±97.2ab 323.0±65.5ab 412.0±87.4ab 4.4±1.1)对照组ab

图1 不同组别胆管c-kit mRNA表达

图2 不同组别胆管c-kit mRNA表达对比分析图
2.2 RT-PCR法检测c-kit mRNA的表达水平 结果显示,对照组、模型组及大黄素组位于548bp处的条带均有表达(图1)。3组c-kit mRNA表达的相对量分别为0.98±0.195,0.47±0.064,0.86±0.120(图2)。β-actin mRNA的扩增片段为285bp。模型组c-kit mRNA表达量明显低于大黄素组及对照组(P<0.05)。大黄素组低于对照组,但组间无统计学差异(P>0.05)。
2.3 免疫组织化学法检测大鼠胆管中c-kit蛋白的表达水平 免疫组织化学结果显示c-kit主要在肌层表达,呈棕黄色,表现为以胞体为中心的向相反方向延伸的2个或2个以上长突起,常常与邻近的ICC突起相互连接构成网络[6]。对照组、模型组、大黄素组c-kit免疫组织化学表达量IOD比较c-kit表达量分别为34.2±12.86、10.5±2.32、28.7±9.86,模型组明显低于对照组及大黄素组(P<0.05),见图3。
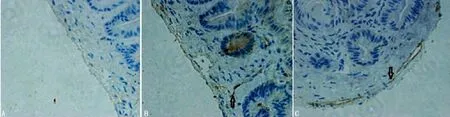
图3 大鼠胆管c-kit免疫组织化学结果(×200)
3 讨 论
药物性肝内胆汁淤积的发病率较高,其病因和发病机制尚不清楚,临床疗效不理想[7]。本实验试图通过药物性胆汁淤积模型阐明药物性肝内胆汁淤积与胆管ICC的关系及大黄素改善肝内胆汁淤积的机制。
ICC是胃肠道的起搏细胞,它产生和传导慢波引起平滑肌自发节律性收缩,在调节胃肠道蠕动方面起着重要作用[8]。同时,ICC在胆囊、胆囊管、肝内胆管、胆总管和十二指肠等多处存在,并参与调控胆管的自主节律性运动[9],而胆道梗阻动物模型中胆囊ICC形态、结构与对照组相比有明显异常[10],因此本研究推测胆道ICC在调节胆道运动及肝内胆汁淤积中可能发挥重要作用。近来研究表明ICC能特异性表达c-kit受体,持续的c-kit信号刺激是小鼠胃肠道ICC形成和维持的必须要素[11],因此本研究选择c-kit为切入点。本研究结果提示:模型组胆管ICC特异性c-kit mRNA及其蛋白表达较对照组明显减少,提示药物性胆汁淤积与胆管ICC减少有关。由此推测胆道系统内的ICC在肝内外胆道的运动调节及胆汁淤积形成中可能发挥重要作用。
大黄素为蒽醌类衍生物,是中药大黄的主要有效单体,具有多种药理作用[12-13]。本实验结果提示大黄素能明显改善药物性肝内胆汁淤积大鼠血清中ALT、ALP、TBIL及γ-GT水平,与模型组相比差异有统计学意义(P<0.05)。已有研究证实:大黄素在一定浓度范围内能显着增加结肠ICC的数量,在一定程度上明显促进肠道的蠕动[14]。本实验结果显示:大黄素能明显改善模型组相关生化指标及胆汁淤积程度,同时大黄素干预后胆管c-kit表达量较对照组明显下降,但其明显高于模型组,提示大黄素作用后胆管内c-kit阳性ICC量较模型组明显增多。因此,本研究推测,胆管ICC与肝内胆汁淤积有一定关系,胆管ICC减少可能与肝内胆汁淤积形成有关。同时,大黄素可能通过促进胆管ICC数量相对增多或其对胆管ICC的保护作用而发挥其改善肝内胆汁淤积的作用。
关于大黄素对胆管ICC影响的作用机制方面,目前研究比较多的是干细胞因子(stem cell factor,SCF)/c-kit信号途径,该通路在ICC的生长发育中起重要作用。SCF能剂量依赖性地促进ICC的发育,并且在维持其表型中起重要作用。一旦去除SCF,则ICC会明显减少[15-16]。因此,大黄素对于胆管ICC的影响,可能就是通过SCF/c-kit途径及其下游通路,对肝内胆汁淤积起治疗作用。该信号通路是本研究下一步的主要研究方向。
综上所述,胆管ICC与药物性肝内胆汁淤积形成过程可能存在密切关系,胆管ICC可能成为肝内胆汁淤积药物治疗的新靶点。为进一步证实本研究的设想,目前本实验组正进行c-kit阻断及ICC缺失动物模型及相应胆汁淤积模型胆管ICC数量的研究,以期进一步阐明肝内胆汁淤积与ICC的关系。
[1] Huizinga JD,Chen JH,Mikkelsen HB,et al.Interstitial cells of Cajal,from structure to function [J].Front Neurosci,2013,7:43.
[2] Pasternak A,Gajda M,Gil K,et al.Evidence of interstitial Cajal-like cells in human gallbladder[J].Folia Histochem Cytobiol,2012,50(4):581-585.
[3] Lee BH,Huang YY,Duh PD,et al.Hepatoprotection of emodin and Polygonum multiflorum against CCl(4)-induced liver injury[J].Pharm Biol,2012,50(3):351-359.
[4] 蒋峻华,熊早生,杨欣,等.α-萘异硫氰酸酯实验性黄疸模型及其在中药研究中的应用[J].中成药研究,1981(4):39-41.
[5] 周方,许红梅.大黄素对肝内胆汁淤积大鼠P-gp表达的影响[J].中国中药杂志,2010,35(7):908-911.
[6] 张红军,于彬,梅峰,等.豚鼠Oddi括约肌内Cajal样细胞及NOS表达阳性神经元的分布[J].消化外科,2006,5(3):201-205.
[7] Rutherford AE,Pratt DS.Cholestasis and cholestatic syndromes[J].Curr Opin Gastroenterol,2006,22(3):209-214.
[8] Sanders KM,Koh SD,Ward SM.Interstitial cells of cajal as pacemakers in the gastrointestinal tract[J].Annu Rev Physiol,2006,68:307-343.
[9] Huizinga JD,Faussone Pellegrini MS.About the presence of interstitial cells of Cajal outside the musculature of the gastrointestinal tract[J].J Cell Mol Med,2005,9(2):468-473.
[10] 李湘楚,肖勇,余保平,等.胆道梗阻对胆囊动力及Cajal间质细胞形态的影响[J].中华消化杂志,2011,31(6):396-400.
[11] Heinrich MC,Rubin BP,Longley BJ,et al.Biology and genetic aspects of gastrointestinal stromal tumors:KIT activation and cytogenetic alterations[J].Hum Pathol,2002,33(5):484-495.
[12] Jung HA,Chung HY,Yokozawa T,et al.Alaternin and emodin with hydroxyl radical inhibitory and/or scavenging activities and hepatoprotective activity on tacrine-induced cytotoxicity in HepG2cells[J].Arch Pharm Res,2004,27(9):947-953.
[13] Ho TY,WU SL,Chert JC,et al.Emodin blocks the SARS coronavirus spike protein and angiotensin-converting enzyme 2interaction[J].Antiviral Res,2007,74(2):92-101.
[14] Peng C,Wang L,Wang YH.The toxicity of aconitine,emodin on ICC cell and the antagonist effect of the compatibility[J].Eur J Drug Metab Pharmacokinet,2009,34(3/4):213-220.
[15] Rich A,Miller SM,Gibbons SJ,et al.Local presentation of steel factor increases expression of c-kit immunoreactive interstitial cells of Cajal in culture[J].Am J Physiol Gastrointest Liver Physiol,2003,284(2):G313-320.
[16] Nakahara M,Isozaki K,Vanderwinden JM,et al.Dose-dependent and time-limited proliferation of cultured murine interstitial cells of Cajal in response to stem cell factor[J].Life Sci,2002,70(20):2367-2376.



