陈 康,蔡晓峰,庹 瑶,赖 佳,李旭清
(解放军第三二四医院眼科,重庆 400029)
论着·基础研究
Smad7转染人骨髓间充质干细胞的初步实验研究*
陈 康,蔡晓峰,庹 瑶,赖 佳,李旭清△
(解放军第三二四医院眼科,重庆 400029)
目的 将Smad7转染到人骨髓间充质干细胞(BMMSC),并进行绿色荧光标记,将其植入兔青光眼手术模型,观察BMMSC存活情况。方法 采用BP反应和LR反应,将绿色荧光标记的Smad7基因片段通过噬菌体插入BMMSC中,通过集落筛选,选出阳性表达细胞株。15只新西兰大耳白兔行小梁切除,局部予以BMMSC,观察细胞存活情况。结果 BMMSC的Smad7表达稳定,绿色荧光标记成功。BMMSC在兔活体小梁存活,荧光表达满意,眼压稳定。结论 绿色荧光标记的Smad7能稳定转染到BMMSC,在兔小梁切除术模型表达稳定。
受体,转化生长因子-β;小梁切除术;Smad7;骨髓间充质干细胞
滤过口堵塞是青光眼手术面临的实际问题,主要原因是局部的成纤维细胞增殖,其与转化生长因子-β (transforming growth factor-β,TGF-β) 关系密切,如何在滤过口持续有效抑制TGF-β是研究的重点[1-3]。TGF-β下游细胞信号传递过程中,Smad7是一种重要的抑制因子,作用于TGF-β下游细胞信号的多环节[4-5]。本实验探讨能否将Smad7转染到人骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMMSC)后植入兔青光眼小梁术后模型,观察BMMSC存活情况,希望能将其用于青光眼滤过手术的动物模型研究。
1 材料与方法
1.1 材料与动物 人骨髓间充质干细胞(广州赛业),Gateway®LR ClonaseTMⅡ Plus Enzyme Mix、Gateway®BP ClonaseTMⅡ Enzyme Mix(Invitrogen公司),QIAquick Gel Extraction 试剂盒(Qiagen公司),PrimeSTARTMHS DNA Polymerase(Takara公司),Taq DNA Polymerase(Fermentas公司),GeneRulerTMdNTP Mix、100 bp DNA Ladder(Fermentas公司)。新西兰大耳白兔(重庆大坪动物研究所)。
1.2 设备 PCR仪(Bio-Rad公司),UV transilluminator(UVP公司),水平电泳槽、电泳仪(北京61仪器厂),全温空气摇床(上海福玛公司),冰冻切片机(Leica CM 1850UV,北京中仪光科科技有限公司),荧光显微镜(奥林巴斯中国有限公司),手术显微镜、全自动眼压计(拓扑康公司)。
1.3 绿色荧光标记的Smad7转染BMMSC并鉴定
1.3.1 重叠 PCR 扩增 attB1-gene1-attB2 attB1-gene1-attB2引物设计,上游引物5′-GGG ATA CCA CAT GTT CAA GAC CAT ACG A-3′,下游引物5′-CCT AAG CTT GAG CTA CCG TCT GTT GGA GA-3′。PCR 反应体系:5×Primer STARTM Buffer 10.0 μL,上、下游引物各1.0 μL,DNA模板 1.0 μL,dNTP Mixture 4.0 μL,Primer STARTM HS DNA Polymerase 0.5 μL,加入ddH2O至50.0 μL。98 ℃,3 min;98 ℃ 10 s,60 ℃ 10 s,72 ℃ 60 s,30 个循环;72 ℃ 5 min终止反应。
1.3.2 通过Gateway技术建立 pDown-反应体系 BP clonase 1 μL,pDonr221、attB1-gene1-attB2各100 ng,加入TE至5 μL。产物转入大肠杆菌Stbl3中。电击穿Stb13细胞加BP反应物2 μL,0 ℃反应30 min;细胞42 ℃热击90 s,0 ℃反应2 min;加入S.O.C.溶液300 μL,225 r/min、37 ℃,摇床孵育1 h;含50 μg/mL卡拉霉素(Kan)的LB平板上涂100 μL转化后的菌液,37 ℃孵育过夜;阳性克隆菌落通过PCR筛选;取阳性克隆并进行克隆测序。
1.3.3 利用Gateway技术构建 pUP启动子 25 ℃ BP反应3 h;大肠杆菌Stbl3转入BP反应产物;挑选阳性克隆并进行测序。同样步骤构建 pTail-IRES/gene2。
1.3.4 利用 Gateway技术构建最终表达载体 小量提取质粒pDown-和骨架载体;25 ℃,LR 反应3 h。反应体系:pDown-gene1 10 ng;pUP启动子12 ng;pTail-IRES/gene2 13 ng;骨架载体 60 ng;LR clonase 1 μL;TE buffer加至5 μL;25 ℃,BP反应3 h;大肠杆菌Stbl3中转入BP反应产物;挑选阳性克隆并进行测序。
1.4 骨髓间充质干细胞动物活体移植及观察 新西兰大耳白兔15只,雄性,体质量(3.7±0.4)kg,静脉注射法按照1 mg·mL-1·kg-1予以麻醉,做角膜缘结膜切口,巩膜瓣4 cm×5 cm,角巩缘后做1 cm×3 cm半层巩膜入前房,巩膜瓣和结膜下滴1×105/mL细胞悬液3滴,间断缝合巩膜瓣和结膜,注意观察动物反应及眼压变化,1周后空气栓塞处死动物,滤过口附近巩膜组织做荧光染色。
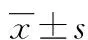
2 结果
2.1 Smad7蛋白鉴定 空白BMMSC细胞编号1组、导入绿色荧光蛋白BMMSC细胞编号2组、导入Smad7与绿色荧光蛋白BMMSC细胞编号3组。其中1组(17 625.33±6 840.77)和2组(19 805.35±12 442.19)的Smad7表达相似,3组(30 957.55±10 324.51)Smad7表达明显升高,说明Smad7基因导入成功,表达稳定,见图1。
图1 Smad7蛋白在各组细胞中的表达变化
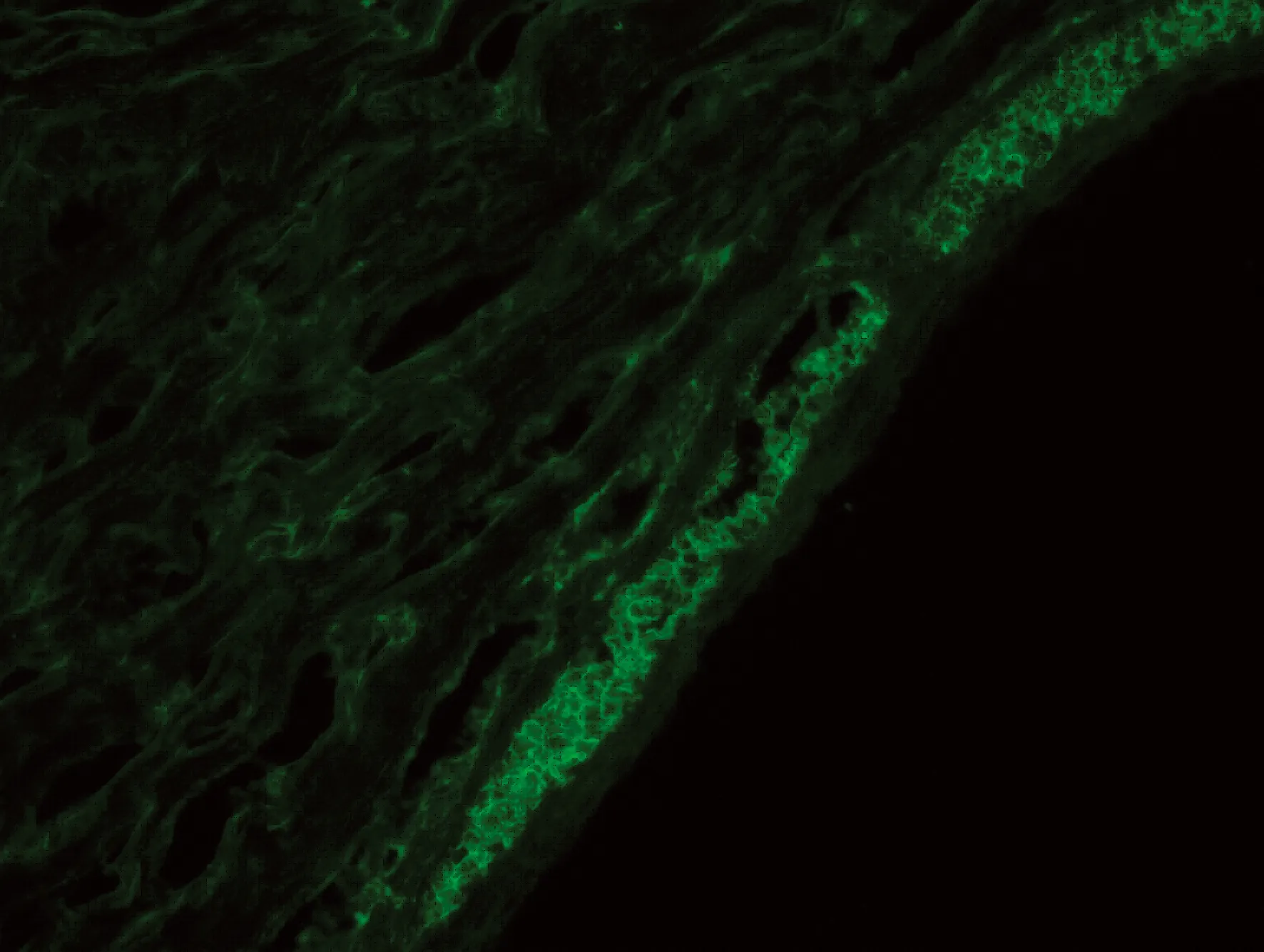
图2 含绿色荧光蛋白BMMSC在兔小梁网组织中的表达(荧光显微镜×200)
2.2 动物术后情况 观察过程中动物无死亡,局部无感染、排斥反应,无局部肉芽组织形成。术后1~3 d,小梁网手术区域局部结膜充血,角膜透明,前房无角膜后沉淀物,眼压稳定,按压下方眼球见滤过泡隆起;术后4~7 d局部结膜充血逐渐减退,前节无异常,眼压稳定,按压眼球滤过泡扁平隆起。
2.3 动物模型荧光照相结果 术后7 d,小梁网表面见密集荧光标记的骨髓间充质干细胞,说明移植的BMMSC在小梁网组织原位存活,局部细胞聚集浓度较高,未见周围扩散现象,见图2。
2.4 术后眼压 3组兔术后眼压结果(n=10):第1天(13.5±2.4)mm Hg,第3天(14.8±1.6)mm Hg,第7天(15.4±1.9)mm Hg,各组间差异无统计学意义(P>0.05)。
3 讨论
BMMSC来源方便,具有向不同组织分化的潜能,遗传背景比较稳定是理想的靶细胞[6-7]。TGF-β/Smad信号通路是目前研究的热门。TGF-β亚家族至少发现6种结构相似分子TGF-β Ⅰ~Ⅵ,其生物学作用相似且同源性很高,人类主要是TGF-β Ⅰ~Ⅲ。Samd家族中TGF-β信号通路的下游蛋白有Smad2、Smad3、Smad4、Smad6、Smad7等,参与了成纤维细胞增殖调控的整个环节。Smad信号蛋白分为3种:限制型(Smad1、Smad2、Smad3、smad5、Smad8);共有型(Smad4);抑制型(Smad6、Smad7)。其中抑制型蛋白Smad7竞争性结合TGF-βⅠ型受体,核转位至细胞质,抑制蛋白激酶,干扰限制型Smad蛋白的磷酸化,导致TGF-β信号通路受限[8-9]。在生理状态下抑制型Smad7主要位于细胞核,受TGF-β刺激,入核发挥生理调节作用。研究发现TGF-β限制型信号蛋白能诱导产生抑制型Smad7,而Smad7通过负反馈调节来抑制TGF-β过度作用[10-11]。
Smad7对于眼的胚胎发育有重要作用,敲除Smad7导致组织增殖和凋亡异常,出现组织缺损和小眼症[12]。通过转染Smad7基因,能有效抑制肾纤维化动物模型的肾间质纤维化的程度。将Smad7利用腺病毒转染小鼠肺纤维化动物模型,发现Ⅰ型胶原和羟脯氨酸的含量降低,结果动物的肺纤维化程度减轻[13]。Smad7与增殖性玻璃体视网膜病变联系密切[14];干扰Smad7表达导致小梁网细胞表达TGF-β2水平下降,抑制细胞外基质过度沉积[15-16];阻断Smad7能抑制损伤导致的角膜内皮增殖[17]。
本研究将BMMSC在兔活体小梁存活,荧光表达满意,眼压控制稳定,为下一步动物实验打下基础,但是观察时间还有限,还需要不同对照组进行对比研究,需要延长观察时间了解移植后的最终抗增殖效果,上述情况还在研究过程中。
[1]Rosentreter A,Schild AM,Jordan JF,et al.A prospective randomised trial of trabeculectomy using mitomycin C vs an ologen implant in open angle glaucoma[J].Eye,2010,24(9):1449-1457.
[2]Palejwala N,Ichhpujani P,Fakhraie G,et al.Single needle revision of failing filtration blebs:a retrospective comparative case series with 5-fluorouracil and mitomycin C[J].Eur J Ophthalmol,2010,20(6):1026-1034.
[3]Sapitro J,Dunmire JJ,Scott SE,et al.Suppression of transforming growth factor-β effects in rabbit subconjunctival fibroblasts by activin receptor-like kinase 5 inhibitor[J].Mol Vis,2010,16(16):1880-1892.
[4]Yu AL,Birke K,Moriniere J,et al.TGF-β2 induces senescence-associated changes in human trabecular meshwork cells[J].Invest Ophthalmol Vis Sci,2010,51(11):5718-5723.
[5]Kitagawa K,Yanagisawa S,Watanabe K,et al.A hyperdry amniotic membrane patch using a tissue adhesive for corneal perforations and bleb leaks[J].Am J Ophthalmol,2009,148(3):383-389.
[6]JohnsonTV,BullND,HuntDP,etal.Neuroprotectiveeffectsofintravitrealmesenchymalstemcell transplantation in experimental glaucoma[J].Invest Ophthalmol Vis Sci,2010,51(4):2051-2059.
[7]Johnson TV,Martin KR.Development and characterization of an adult retinal explant organotypic tissue culture system as an in vitro intraocular stem cell transplantation model[J].Invest Ophthalmol Vis Sci,2008,49(8):3503-3512.
[8]Ghosh AK,Quaggin SE,Vaughan DE.Molecular basis of organ fibrosis:potential therapeutic approaches[J].Exp Biol Med,2013,238(5):461-481.
[9]Braunger BM,Pielmeier S,Demmer C,et al.TGF-β signaling protects retinal neurons from programmed cell death during the development of the mammalian eye[J].J Neurosci,2013,33(35):14246-14258.
[10]Meng XM,Chung AC,Lan HY.Role of the TGF-β/BMP-7/Smad pathways in renal diseases[J].Clin Sci,2013,124(4):243-254.
[11]Lan HY,Chung AC.TGF-β/Smad signaling in kidney disease[J].Semin Nephrol,2012,32(3):236-243.
[12]Zhang R,Huang H,Cao P,et al.Sma-and Mad-related protein 7(Smad7) is required for embryonic eye development in the mouse[J].J Biol Chem,2013,288(15):10275-10285.
[13]Bhaskaran M,Kolliputi N,Wang Y,et al.Trans-differentiation of alveolar epitheIial typeⅡ ceIls to type I ceIlsinVolves autocrine signaling by transforming growth factorbeta 1 through the Smad pathway[J].J Bio Chem,2007,282(15):3968-3976.
[14]Rojas J,Fernandez I,Pastor JC,et al.A genetic case-control study confirms the implication of SMAD7 and TNF locus in the development of proliferative vitreoretinopathy[J].Invest Ophthalmol Vis Sci,2013,54(3):1665-1678.
[15]Su Y,Yang CY,Li Z,et al.Smad7 siRNA inhibit expression of extracellular matrix in trabecular meshwork cells treated with TGF-β2[J].Mol Vis,2012,18(12):1881-1884.
[16]Fuchshofer R,Stephan DA,Russell P,et al.Gene expression profiling of TGFbeta2-and/or BMP7-treated trabecular meshwork cells:Identification of Smad7 as a critical inhibitor of TGF-beta2 signaling[J].Exp Eye Res,2009,88(6):1020-1032.
[17]Sumioka T,Ikeda K,Okada Y,et al.Inhibitory effect of blocking TGF-beta/Smad signal on injury-induced fibrosis of corneal endothelium[J].Mol Vis,2008,14(7):2272-2281.
Primary research of human bone marrow mesenchymal stem cells transfected by Smad7*
ChenKang,CaiXiaofeng,TuoYao,LaiJia,LiXuqin△
(DepartmentofOphthalmology,PLA324Hospital,Chongqing400029,China)
Objective Human bone marrow mesenchymal stem cells were transfected by Smad7 and labeled with green fluorescent mark.BMMSCs were implanted into rabbit glaucoma operational model and observed surviving condition.Methods Through BP and LR reaction,Smad7 with green fluorescent mark was inserted into human bone marrow mesenchymal stem cells by bacteriophage,filtered positive colony and picked out cell line.15 New Zealand white rabbits were enforced trabeculectomy with BMMSC,then following up cell survival condition.Results Smad7 expressed stable in human bone marrow mesenchymal stem cells with satisfactory green fluorescent mark.BMMSC survived in rabbit trabecula with stable green fluorescent and effective ocular press.Conclusion Smad7 with green fluorescent mark could be inserted into human bone marrow mesenchymal stem cells stably,and has effective results in rabbit model.
receptors,transforming growth factor bata;trabeculectomy;Smad7;bone marrow mesenchymal stem cells
10.3969/j.issn.1671-8348.2015.06.004
重庆市卫生局课题(2011-2-588)。 作者简介:陈康(1972-),副主任医师,博士,主要从事青光眼和眼表疾病的临床研究。△
,E-mail:lixuqingcq@gmail.com。
R775.9
A
1671-8348(2015)06-0730-02
2014-10-10
2014-12-15)



