李 伟,曾晓华,徐发良,熊忠讯,罗 杰
(重庆市肿瘤研究所乳腺外科 400030)
目前,随着乳腺癌发病率的增加,在一些发达国家和地区成为了主要的恶性肿瘤[1]。淋巴转移是造成乳腺癌患者术后复发及死亡的重要原因之一,是乳腺癌患者一项重要的临床预后因素[2-3]。传统的静脉化疗由于在局部淋巴结中药物浓度很低,不能完全解决淋巴转移的问题,而且还可能出现严重的不良反应。因此,淋巴靶向化疗成了人们研究的热点。目前,国内外已有纳米炭(carbon nanoparticles,CNP)吸附化疗药物行淋巴靶向化疗的报道,但纳米炭吸附多西紫杉醇(nano-carbon adsorption taxotere,TAX-CNP)用于乳腺癌的报道较少,对其淋巴化疗的靶向性、合理注射时间及短期疗效报道甚少。
1 材料与方法
1.1 资料与试剂
1.1.1 一般资料 选择2013年1~12月入住重庆市肿瘤研究所乳腺外科的原发性乳腺癌患者160例,均签署知情同意书。根据患者意愿进行分组。A组:80例,注射1mL多西紫杉醇(taxotere,TAX)加1mL CNP。B组:80例,外周静脉输注含1mL TAX的0.9%氯化钠溶液100mL。所有患者经术前粗针活检病理学检验证实为乳腺癌,全身情况尚可(KPS评分大于80分),术前无化疗、放疗及生物治疗史。临床分期按国际抗癌联盟(UICC)TNM分期法;两组患者均为女性,在年龄、肿块大小、所属象限、临床分期及病理类型等方面比较差异均无统计学意义(P>0.05),具有可比性。两组患者临床病理因素的关系见表1。
1.1.2 主要试剂与设备 TAX注射液购自江苏奥赛康药业有限公司。CNP混悬注射液购自重庆莱美药业有限公司。U3000型高效液相色谱仪购自美国戴安公司。原位末端标记(TUNEL)试剂盒购自美国Roch公司。Elite流式细胞仪购自美国Beckman Coulter公司。
1.2 方法
1.2.1 术前化疗 A组根据术前注射时间即12、24、36及48h分为A1、A2、A3及A4共4个小组,B组根据术前开始输注时间即12、24、36及48h分为B1、B2、B3及B4共4个小组。A组抽取1mL TAX加入1mL CNP中,于37℃以120r/min的转速在液体混合器中振摇15min,抽取TAX-CNP分别于术前12、24、36及48h在肿瘤周缘0.5~1.0cm平均分成4~6点皮下注射,每个点注射0.2~0.4mL;B组抽取1mL TAX分别在上述4个不同时间点经外周静脉输注。
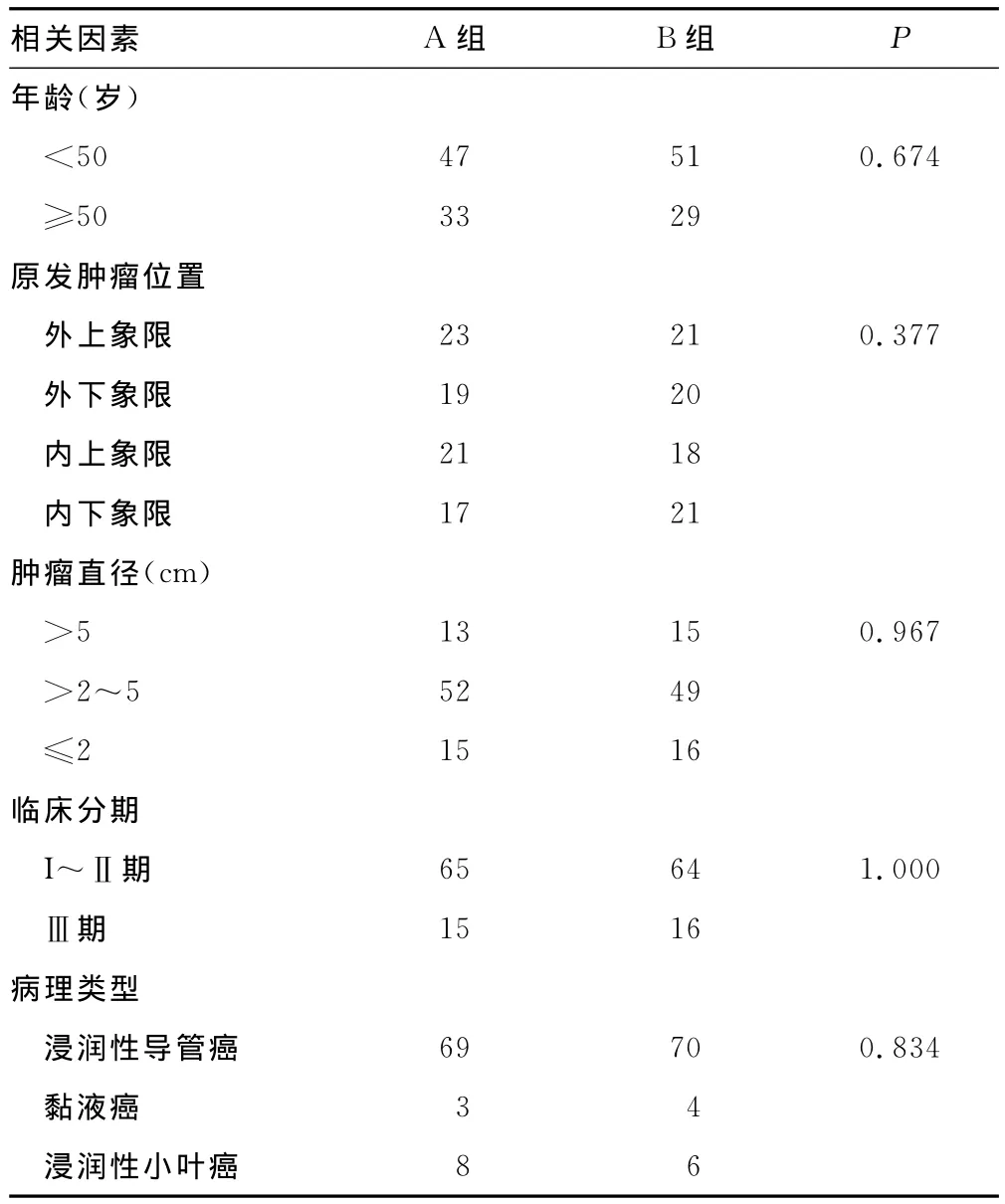
表1 两组患者临床病理因素的关系
1.2.2 取材 所有患者均行乳腺癌改良根治术,摘取标本中全部淋巴结,将每一淋巴结均匀分为2份,1份送作病理检查,另1份置于-70℃冰箱冷藏待测。
1.2.3 药物浓度检测 选取A组每小组黑染淋巴结与B组每小组的淋巴结各20枚。将每枚淋巴结切成肉糜,称取(0.25±0.05)g,涡旋摇匀及离心,分取上清液涡旋离心。提取上清液置50℃恒温水浴箱中吹干,残留物溶于50μL流动相中,取进样液20μL注入高效液相色谱仪,计算各图谱中的TAX峰面积,按标准曲线方程换算检测样品的药物浓度。
1.2.4 TUNEL法检测细胞凋亡指数(apoptotic index,AI)A组每小组均选取黑染且有癌转移的淋巴结20枚,B组每小组均选取有癌转移的淋巴结20枚,以TUNEL法检测细胞AI。
1.2.5 流式细胞仪检测细胞凋亡率 选取A组每小组黑染且癌转移淋巴结20枚,选取B组每小组癌转移淋巴结20枚,将其切成直径约0.5cm左右的小块,以0.25%EDTA-胰蛋白酶消化,经400目筛网滤过,制成单细胞悬液。沉淀细胞用孵育缓冲液重悬,Annexin V-FITC和PI避光染色,采用流式细胞仪检测癌细胞的凋亡率。
1.3 统计学处理 采用SPSS19.0统计软件处理实验数据。AI、细胞凋亡率及药物浓度均采用±s表示,用t检验;采用LSD法进行各组之间的两两比较,以P<0.05为差异有统计学意义。
2 结果
2.1 A组与B组药物浓度比较 A组每一小组淋巴结内TAX浓度均远高于B组每一小组淋巴结内TAX浓度,同时A组TAX浓度高于B组,两组比较差异有统计学意义(P<0.05),见表2。
表2 各组淋巴结的TAX浓度比较(±s,μg/g)
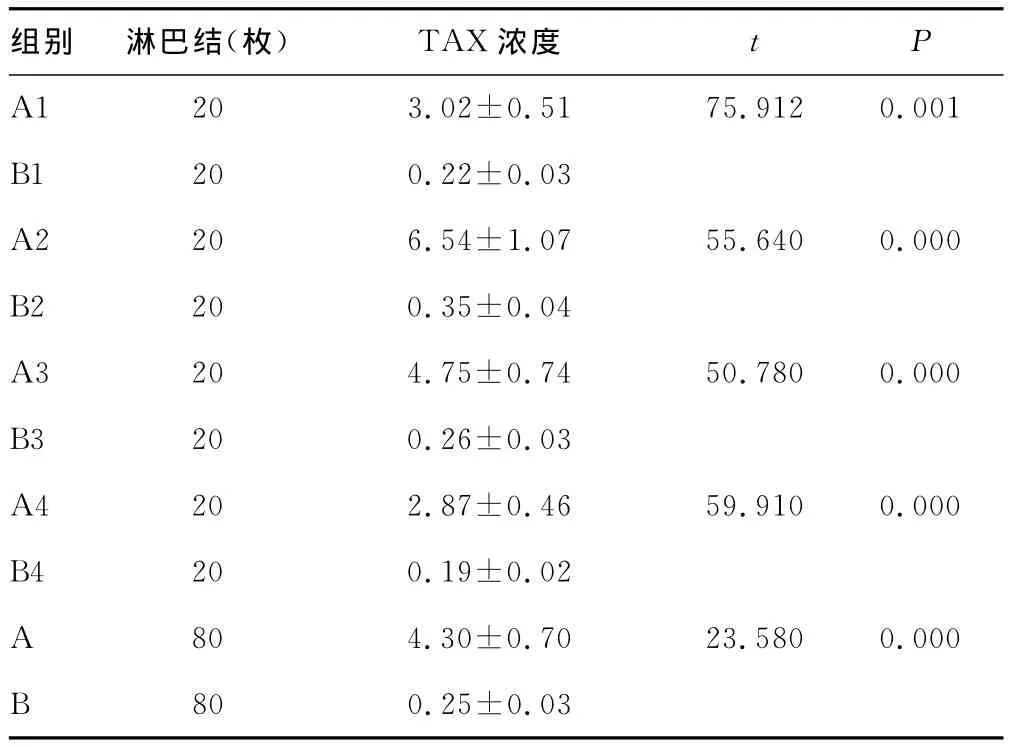
表2 各组淋巴结的TAX浓度比较(±s,μg/g)
组别 淋巴结(枚)TAX浓度t P A1 20 3.02±0.51 75.912 0.001 B1 20 0.22±0.03 A2 20 6.54±1.07 55.640 0.000 B2 20 0.35±0.04 A3 20 4.75±0.74 50.780 0.000 B3 20 0.26±0.03 A4 20 2.87±0.46 59.910 0.000 B4 20 0.19±0.02 A 80 4.30±0.70 23.580 0.000 B 80 0.25±0.03
2.2 TUNEL法检测的A组与B组细胞AI比较 凋亡细胞以细胞核呈现黄色为阳性细胞。AI的判定在400倍高倍镜下选择视野,每张切片计数1 000~1 500个细胞中阳性细胞标记数[4],见图1~2。A1组细胞AI明显低于A2、A3、A4组(P<0.05),A2、A3、A4组间AI比较差异均无统计学意义(P>0.05),见表3。A组癌转移淋巴结细胞AI明显高于B组(P<0.05),见表5。
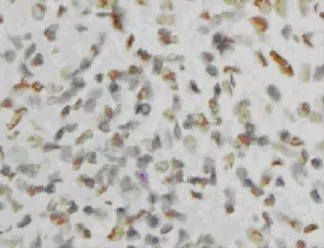
图1 A2组细胞凋亡的表达(TUNEL,×400)
表3 各组转移淋巴结AI比较(±s,%)
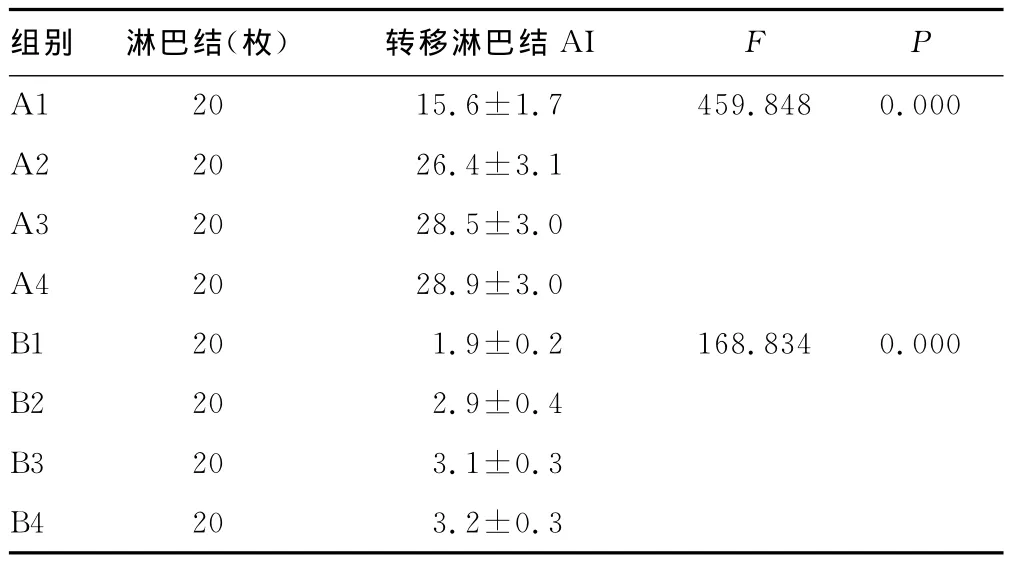
表3 各组转移淋巴结AI比较(±s,%)
组别 淋巴结(枚)转移淋巴结AI F P A1 20 15.6±1.7 459.848 0.000 A2 20 26.4±3.1 A3 20 28.5±3.0 A4 20 28.9±3.0 B1 20 1.9±0.2 168.834 0.000 B2 20 2.9±0.4 B3 20 3.1±0.3 B4 20 3.2±0.3
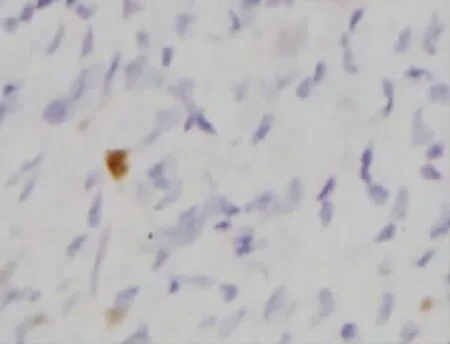
图2 B2组细胞凋亡的表达(TUNEL,×400)
2.3 流式细胞仪检测的A组与B组细胞凋亡率比较 A1组细胞凋亡率明显低于A2、A3、A4组,差异有统计学意义(P<0.05);A2、A3、A4组癌转移淋巴结细胞凋亡率比较差异无统计学意义(P>0.05),见表4。A组细胞凋亡率明显高于B组,差异有统计学意义(P<0.05),见表5。
表4 各组转移淋巴结细胞凋亡率比较(±s,%)
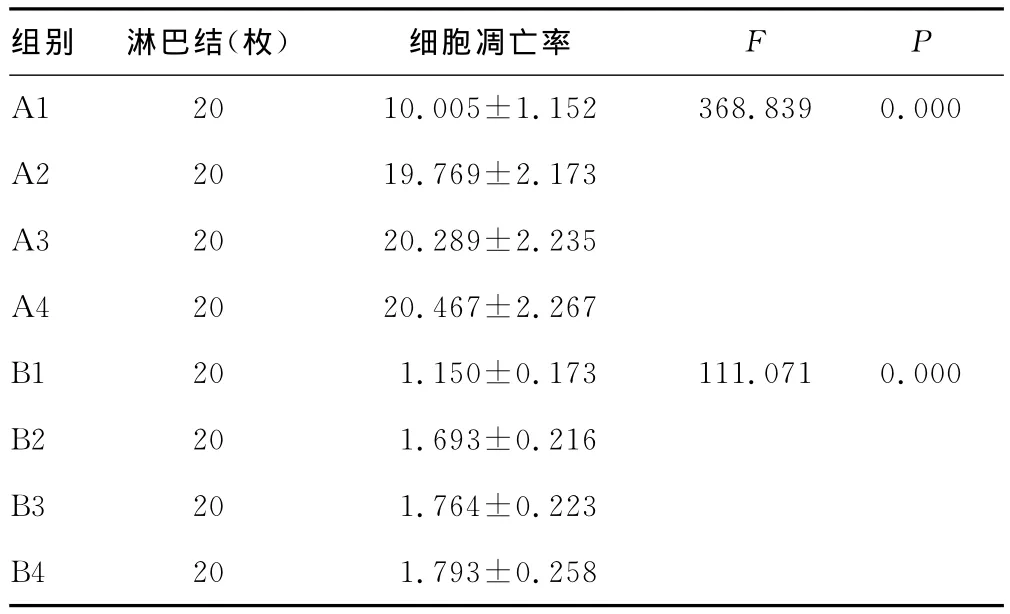
表4 各组转移淋巴结细胞凋亡率比较(±s,%)
组别 淋巴结(枚)细胞凋亡率F P A1 20 10.005±1.152 368.839 0.000 A2 20 19.769±2.173 A3 20 20.289±2.235 A4 20 20.467±2.267 B1 20 1.150±0.173 111.071 0.000 B2 20 1.693±0.216 B3 20 1.764±0.223 B4 20 1.793±0.258
表5 两 组转移淋巴结AI及细胞凋亡率比较(±s,%)
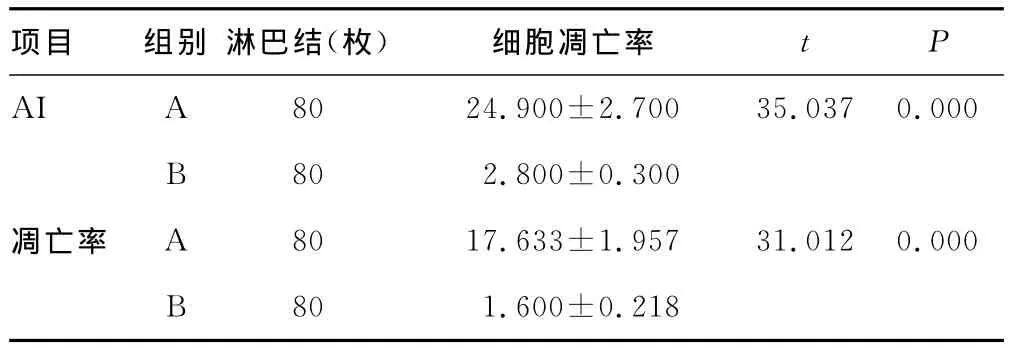
表5 两 组转移淋巴结AI及细胞凋亡率比较(±s,%)
项目 组别淋巴结(枚)细胞凋亡率t P AI A 80 24.900±2.700 35.037 0.000 B 80 2.800±0.300凋亡率 A 80 17.633±1.957 31.012 0.000 B 80 1.600±0.218
3 讨论
TAX是一种新型抗肿瘤药物,具有直接诱导肿瘤细胞凋亡的作用[5]。近年来研究表明,TAX对于乳腺癌、非小细胞肺癌、激素抵抗性前列腺癌、食管癌等具有显着疗效[6]。作为单药治疗乳腺癌的有效率就已达43.99%[7],主要是因为其在细胞内的浓度比紫杉醇高2倍,而且在细胞内滞留时间长。
CNP除了成为淋巴结示踪剂外,因其有更多的比表面积,还具有高吸附容量及缓释性等优点[8-10]。区域淋巴化疗使用CNP作为载体提供抗癌药物,可以提高淋巴结内的药物浓度及降低血浆药物浓度,由此降低系统性毒性[11]。而且,CNP作为一种载体对机体无明显毒性及致畸作用,在体内具有较高的安全性[12-14]。本实验结果显示,A组淋巴结药物浓度明显高于B组,表明TAX-CNP靶向化疗药物具有较好的淋巴趋向性;当然,如果加大TAX的药物剂量,淋巴结内药物浓度是否会随之升高,目前,还不明确,需要进一步研究。
乳腺癌淋巴靶向化疗药物术前较为合理的注射时间目前没有明确的定论。本实验研究显示,A组术前24、36及48h注射后癌转移淋巴结的AI、细胞凋亡率均较术前12h注射高,虽然从数据上显示术前24、36及48h随着时间的延长,AI及细胞凋亡率均稍有所增高,但3小组之间比较差异无统计学意义(P>0.05);同时结合临床术前准备的实际,术前24h注射系较为合理的时间。
抗癌药物通过诱导肿瘤细胞凋亡是其主要治疗作用之一[15]。凋亡检测方法众多,原理各异,每种凋亡检测方法各具特点,但均有一定的局限性。流式细胞术检测早期凋亡更为灵敏,既可定性又可定量,且具有简单、快速的特点,可进行多参数和活体细胞分析,是目前较为理想的凋亡定量检测方法之一;TUNEL法主要用于细胞凋亡的晚期检测,可检测出尚未出现明显凋亡形态学特征但已发生DNA裂解的细胞核,可结合细胞同期的分析,可同时了解凋亡细胞DNA断裂和细胞周期分布之间的关系,近来已成为鉴别和定量凋亡细胞的最常用方法之一。淋巴靶向化疗药物的短期疗效也一直是关注的焦点。本实验结果显示,A组癌转移淋巴结AI及细胞凋亡率均明显高于B组,表明TAX-CNP靶向化疗药物可以显着提高转移淋巴结细胞凋亡的发生,降低局部短期复发率。对于TAXCNP的长期疗效还有待进一步的临床观察。
目前,只有少数使用CNP研究区域淋巴化疗,非常需要一些额外的信息。例如,靶向化疗药物在淋巴系统的疗效评估,淋巴结的区域复发率,靶向化疗在乳腺癌患者手术后的效果、长期存活率及安全性问题等,这些都需要进一步的研究。此外,由于CNP颗粒不是一个可生物降解的材料,可以退化在体内,还需要更多的研究来确定长期的毒副作用是否会发生。
局部注射后靶向化疗药物随淋巴循环分布,对于不能手术清除的淋巴结如内乳区淋巴结、部分跳跃转移的淋巴结也有较好的作用,而且用量少,不良反应轻,是一种较为理想的化疗方法。本研究结果积累了TAX在乳腺癌淋巴靶向化疗中比较合理的注射时间、短期疗效和靶向性等经验。本研究为淋巴靶向化疗药物在乳腺癌中的应用提供了理论依据,为乳腺癌患者的治疗开辟了一条新的路径,同时对指导其他淋巴靶向化疗药物的研究也有一定帮助。新型靶向化疗药物的应用,减少了患者术后复发及转移的机会,极大地提高了生存率,为患者节省了一定的医疗费用;为将来使用淋巴靶向化疗制剂部分替代价格昂贵、不良反应明显的静脉化疗药物提供了可能。但对如何联合用药、多途径用药和规范乳腺癌淋巴化疗的标准以及如何开展个体化治疗有待深入探索。
[1] Papademetriou K,Ardavanis A,Kountourakis P.Neoadjuvant therapy for locally advanced breast cancer:focus on chemotherapy and biological targeted treatments′armamentarium[J].J Thorac Dis,2010,2(3):160-170.
[2] Bernet L,Cano R.Metastatic sentinel node and axillary lymphadenectomy revisited[J].Gland Surg,2012,1(1):7-8.
[3] Wheeler SB,Reeder-hapes K,Meyer AM.A balancing act for breast cancer?Everolimus for hormone receptor positive patients[J].Transl Cancer Res,2012,1(2):109-112.
[4] 赵文和,王世夫,丁伟,等.脱氧氟尿苷诱导胃腺癌细胞凋亡的临床研究[J].中华普通外科杂志,2005,20(3):184-186.
[5] Rahman KM,Banerjee S,Ail S,et al.3,3-Diindolylmethane enhances taxotere-induced apoptosis in hormone-refractory prostate cancer cells through surviving down-regulation[J].Cancer Res,2009,69(10):4468-4475.
[6] Minabmide J,Aoyama N,Takada K,et al.Evaluation ofdocetaxel,CDDP and 5-FU combined therapy as second-line chemotherapy for esophagus caucer[J].Gan To Kagaku Ryoho,2007,34(1):49-52.
[7] 王子平,孙燕,张湘茹,等.多西他赛治疗晚期乳腺癌的临床研究[J].中华肿瘤杂志,2006,28(6):468-470.
[8] Kegel FS,Rietman BM,Verliefde AR.Reverse osmosis followed by activated carbon filtration for efficient removal of organic micropollutants from river bank filtrate[J].Water Sci Technol,2010,61(10):2603-2610.
[9] Sze MF,Mckay G.An adsorption diffusion model for removal of para-chlorophenol by activated carbon derived from bituminous coal[J].Environ Pollut,2010,158(5):1669-1674.
[10] Bu L,Wang K,Zhao QL,et al.Characterization of dissolved organic matter during landfill leachate treatment by sequencing batch reactor,aeration corrosive cell-Fenton,and granular activated carbon in series[J].J Hazard Mater,2010,179(1-3):1096-1105.
[11] Chen J,Wang L,Yao Q,et al.Drug concentrations in axillary lymph nodes after lymphatic chemotherapy on patients with breast cancer[J].Breast Cancer Res,2004,6(4):R474-477.
[12] Magrez A,Kasas S,Salicio V,et al.Cellular toxicity of carbon-based nanomaterials[J].Nano Lett,2006,6(6):1121-1125.
[13] 范林军,钟玲,郭德玉,等.纳米炭对乳腺癌腋窝淋巴结示踪效果及安全性的研究[J].中华乳腺病杂志,2010,6(4):47-50.
[14] 孙明磊,谢卫红,王昌美,等.平阳霉素-活性炭纳米微粒行口腔癌淋巴化疗的靶向性评价[J].华西口腔医学杂志,2011,29(3):253-263.
[15] 姚静,谢大兴,吴剑宏,等.流式细胞术的凋亡检测技术在人胃肠实体瘤药敏试验中的应用[J].中华实验外科杂志,2007,24(10):1204-1206.



