景 胜,黄 静,包晓航,周功锐,王 颖,杨天德△
(第三军医大学:1.新桥医院麻醉科,重庆 400037;2.组织胚胎学教研室,重庆 400038)
丙泊酚对新生小鼠海马星形胶质细胞和小胶质细胞的影响
景 胜1,黄 静1,包晓航1,周功锐1,王 颖2,杨天德1△
(第三军医大学:1.新桥医院麻醉科,重庆 400037;2.组织胚胎学教研室,重庆 400038)
目的 观察丙泊酚麻醉对新生小鼠海马星形胶质细胞(AST)和小胶质细胞的影响。方法将健康同窝日龄7 d(P7)C57小鼠15只,随机分为丙泊酚高剂量组、低剂量组和10%脂肪乳对照组,每组5只,所有小鼠从P7开始接受药物处理。高、低剂量组分别腹腔注射丙泊酚60、30 mg/kg;对照组腹腔注射同等体积的10%脂肪乳。药物处理24 h后取材,采用免疫组化方法检测AST标记物胶质纤维酸性蛋白(GFAP)与小胶质细胞标记物离子钙接头分子(Iba1)在海马内的表达。结果丙泊酚高剂量组小鼠海马齿状回分子层中GFAP标记的AST数量较对照组明显减少(P<0.01),低剂量丙泊酚对新生鼠海马中AST数量无显着影响;高剂量和低剂量丙泊酚均显着性降低海马小胶质细胞数量(P<0.01)。结论丙泊酚抑制新生小鼠海马AST和小胶质细胞的发育,且存在剂量依赖关系。
二异丙酚;海马;神经胶质;星形细胞;小神经胶质细胞;新生小鼠
丙泊酚因其半衰期短、苏醒完全且具有止吐功能,已广泛应用于儿科临床麻醉、辅助性诊断检查及ICU镇静。越来越多的实验研究表明,全身麻醉(全麻)药物可能损伤发育期大脑,导致持续性神经行为异常[1]。目前研究全麻药物对发育期脑功能影响主要聚焦在与神经功能发育密切相关的神经元上;却忽视了药物对中枢神经系统中数量几乎是神经元10倍的神经胶质细胞的影响。最新研究表明,脑内神经胶质细胞对脑认知功能有重要作用[2]。全麻药物丙泊酚是否通过调控与远期脑功能密切相关的海马中神经胶质细胞进而影响脑功能尚未明确。本实验运用免疫组化方法检测丙泊酚对新生小鼠海马神经胶质细胞的影响,以进一步探讨丙泊酚影响发育中大脑功能的机制。
1 材料与方法
1.1材料 药品及试剂:丙泊酚购自AstraZenenca公司(批号为KL569);10%脂肪乳购自安徽丰原药业股份有限公司(批号为120811M1);离子钙接头分子(Iba1)抗体购自Wako公司;胶质纤维酸性蛋白(glial fibrillary acidic protein,GFAP)抗体购自北京中杉公司;生物素化兔抗二抗购自Invitrogen公司;显色试剂盒DAB购自北京中杉公司。仪器:冰冻切片机为Leica的CM1950型;照相仪器为ZEISS的AX10型。
1.2方法
1.2.1动物处理 健康C57/BL6临产孕鼠由第三军医大学大坪医院实验动物中心提供,室温饲养在正常昼夜交替采光的环境中,自由充足摄取食物和水,小鼠出生当日记为P0。将日龄7 d(P7)同窝小鼠15只按照随机数字表分为3组:丙泊酚高、低剂量组及10%脂肪乳对照组,每组5只。高、低剂量组小鼠分别腹腔注射丙泊酚60、30 mg/kg,对照组小鼠腹腔注射等体积10%脂肪乳。注射药物后将小鼠放置于37 ℃恒温充氧保温箱中,直至小鼠麻醉苏醒。注射药物24 h后收取小鼠大脑标本。
1.2.2免疫组化检测 小鼠断头处死取材,将脑标本置于新鲜配制的4%多聚甲醛中固定24 h,随后依次采用10%、20%及30%蔗糖溶液梯度脱水,待其充分脱水后,以40 μm冰冻切片,后将脑片置于冻存液中-20 ℃保存备用。0.01 mol/L PBS漂洗后,3%H2O2室温处理20 min,PBS漂洗后0.3% Triton X-100置于37 ℃孵箱孵育30 min,3%胎牛血清(BSA)封闭反应1 h。分别加入兔来源的一抗工作液GFAP(1∶200)及Iba1(1∶1 000),4 ℃孵育过夜。PBS漂洗后分别加入生物素化抗兔二抗(1∶200),置于37 ℃孵箱中反应2 h。PBS漂洗后与链霉亲和素-生物素复合物(SABC)在37 ℃中孵育1 h,DAB显色,贴片晾干,中性树脂封片。通过检测星形胶质细胞(Astrocvte,AST)的特异性标记物GFAP评估丙泊酚对小鼠海马中AST的影响;通过检测小胶质细胞的标记物Iba1评估丙泊酚对小鼠海马中小胶质细胞的影响。
1.2.3计数GFAP及Iba1阳性细胞 每只小鼠选取海马区域大小相似切片各3张,在显微镜下统计海马中的GFAP及Iba1阳性细胞数。
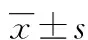
2 结 果
2.13组小鼠海马中GFAP标记的AST数量比较 GFAP标记的AST主要分布于海马齿状回分子层(图1)。丙泊酚药物处理后新生小鼠海马中GFAP数量出现下降,与对照组比较,低剂量组差异无统计学意义(P>0.05),高剂量组出现显着性减少(P<0.01),见表1。
2.23组新生小鼠海马中Iba1标记的小胶质细胞数量比较 新生期小鼠腹腔注射丙泊酚后,海马中Iba1阳性细胞数量出现下降(图2)。与对照组比较,低、高剂量组小鼠海马中小胶质细胞的数量均显着减少,差异有统计学意义(P<0.01),见表1。
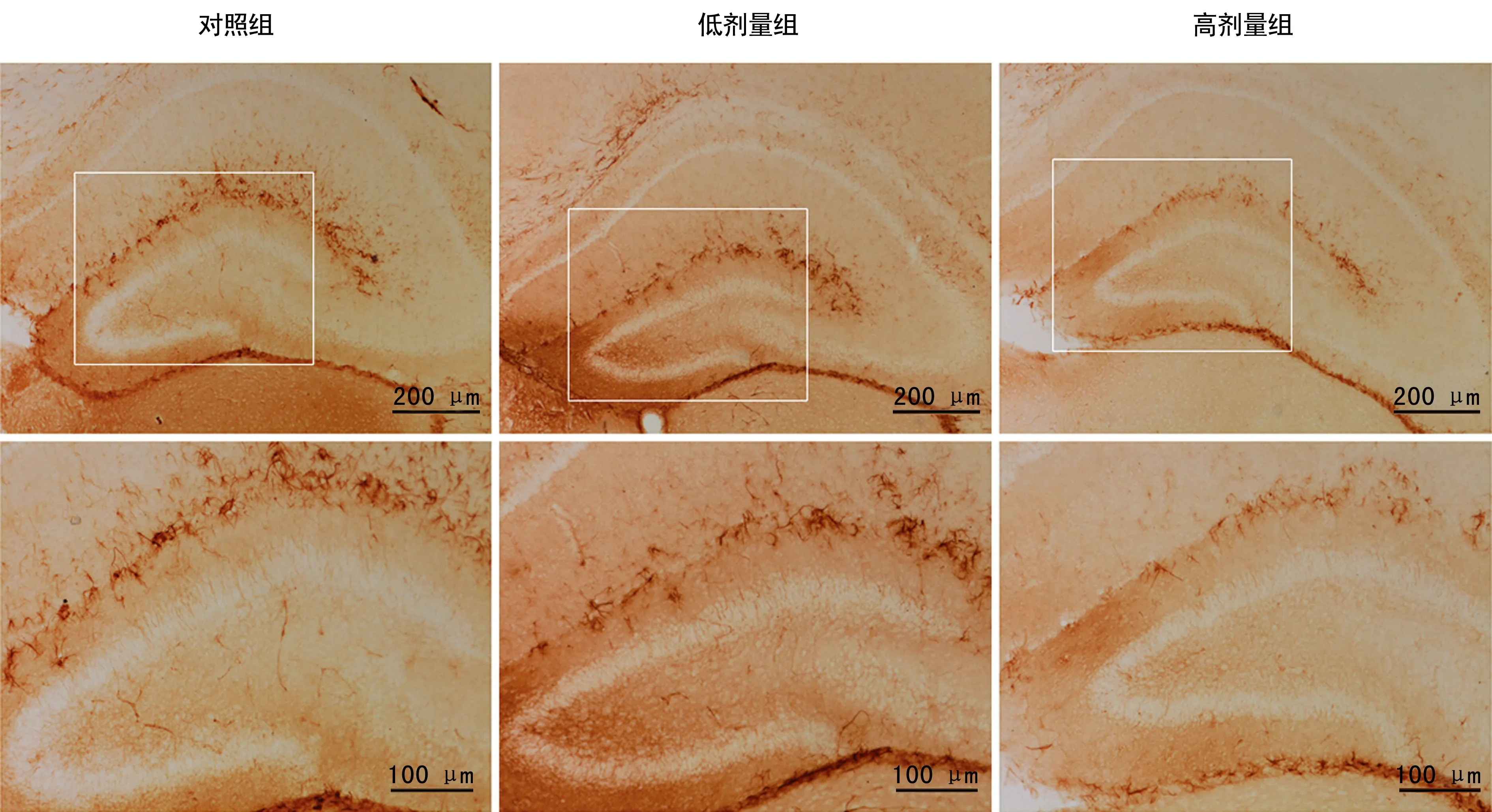
图1 3组小鼠海马中AST免疫组化结果
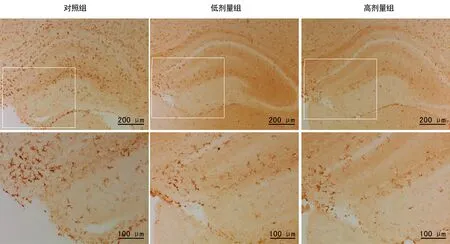
图2 3组小鼠海马中Microglia免疫组化结果
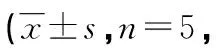
表1 3组小鼠海马中GFAP及Iba1阳性细胞比较个)
a:P<0.01,与对照组比较。
3 讨 论
大脑功能发育是一个漫长且错综复杂的过程。Hudson等[3]认为脑功能在婴幼儿或老龄人极易受到外界因素的影响。McCann等[4]认为在大脑快速发育期外界对脑发育影响最大。此期因物种而异:啮齿类动物,这段时间是从生后7 d持续到生后第10天(甚至第17天);在灵长类动物(恒河猴),大脑快速发育期是从生后第5天持续到生后第16天;而在人类,认为大脑快速发育期从第3期妊娠持续到生后3岁[5]。近年来,全麻药物对发育机体的中枢神经系统(CNS)的毒性作用越来越引起大家的重视。丙泊酚因其诱导、苏醒快且不良反应小已成为儿科临床中最常用的静脉麻醉药。既往研究表明,在大脑快速发育期接触全麻药物后,全麻药物通过促进脑内神经元凋亡或抑制神经元的神经发生等方式影响脑功能发育[6]。而全麻药物是否通过调控在CNS发育过程中与神经元同样具有举足轻重的神经胶质的报道较少。
既往研究表明,神经胶质细胞与脑认知功能关系密切[7]。神经胶质细胞是广泛分布于CNS内除了神经元以外的所有细胞,主要由小胶质细胞、AST及少突胶质细胞构成,而在海马中主要存在的神经胶质细胞是前两种细胞。AST是神经胶质细胞中体积最大的一种细胞,它可以通过存在于AST内的一种中间丝蛋白,即GFAP进行特异性标记。AST能合成和分泌多种细胞因子,它不仅参与CNS内炎症及免疫应答,而且对神经元迁移、突起生长及再生等有重要影响。离体实验表明,长时间使用丙泊酚导致单纯培养的AST存活率下降[8-9]。临床浓度的丙泊酚对发育中神经系统的影响并不局限于神经元,它对皮层AST也能产生抑制[10]。Gomez-Pinilla等[11]研究发现,大鼠在学习记忆的过程中海马中AST的数量和突起密度均出现增加。本研究发现,在丙泊酚低剂量组,海马中AST数量较注射等体积10%脂肪乳的对照组差异无统计学意义(P>0.05),但高剂量组海马中AST数量明显减少(P<0.01),提示丙泊酚能抑制AST表达,并呈现一定剂量依赖性。高剂量丙泊酚抑制AST 表达从而触发后续连锁反应可能是丙泊酚暴露导致脑功能及行为异常的病理学基础之一。
小胶质细胞是CNS内一群独特的细胞群体,在脑内各部分均有分布,其来源至今尚无明确定论。小胶质细胞相当于脑中的巨噬细胞,是CNS中最主要的免疫防线。活化的小胶质细胞可释放很多介质,可构成CNS抵御外界感染、炎症、神经退行性变等的关键环节。Iba1是一种新的钙结合蛋白,能够特异标记小胶质细胞。Luo等[12]发现,丙泊酚可抑制脑外伤后大脑中小胶质细胞的活化。本文对照组新生鼠大脑海马中Iba1大量表达,而丙泊酚处理组表达明显减弱,说明丙泊酚能抑制新生小鼠海马中小胶质细胞的活化。小胶质细胞活化能力降低可导致海马抵御外界影响能力降低,致使海马中神经元易受到攻击,最终影响机体远期的脑功能。这可能是丙泊酚暴露导致婴幼儿脑功能改变及行为异常的机制之一。另有研究表明,AST可以激活小胶质细胞释放可溶性因子来阻止和限制CNS炎性反应过度的表达。本研究中丙泊酚抑制AST表达是否协同导致小胶质细胞的影响还有待验证。
综上所述,本研究结果显示,丙泊酚抑制新生小鼠海马神经胶质细胞的表达,且呈现出剂量依赖性。本研究推测高剂量丙泊酚可能通过抑制神经胶质细胞的生长,触发后续系列的连锁反应导致机体远期脑功能改变。
[1]Olsen EA,Brambrink AM.Anesthesia for the young child undergoing ambulatory procedures:current concerns regarding harm to the developing brain[J].Curr Opin Anaesthesiol,2013,26(6):677-684.
[2]Han X,Chen M,Wang F,et al.Forebrain engraftment by human glial progenitor cells enhances synaptic plasticity and learning in adult mice[J].Cell Stem Cell,2013,12(3):342-353.
[3]Hudson AE,Hemmings HC.Are anaesthetics toxic to the brain?[J].Br J anaesth,2011,107(1):30-37.
[4]McCann ME,Soriano SG.General anesthetics in pediatric anesthesia:influences on the developing brain[J].Curr Drug Targets,2012,13(7):944-951.
[5]Sowell ER,Peterson BS,Thompson PM,et al.Mapping cortical change across the human life span[J].Nat Neurosci,2003,6(3):309-315.
[6]Sinner B,Becke K,Engelhard K.General anaesthetics and the developing brain:an overview[J].Anaesthesia,2014,69(9):1009-1022.
[7]孟凡珍,万燕杰,徐静,等.中枢神经胶质细胞与认知功能[J].实用医学杂志,2008,24(23):4145-4146.
[8]Berns M,Seeberg L,Schmidt M,et al.High-dose propofol triggers short-term neuroprotection and long-term neurodegeneration in primary neuronal cultures from rat embryos[J].J Int Med Res,2009,37(3):680-688.
[9]Turina D,Loitto VM,Bjornstrom K,et al.Propofol causes neurite retraction in neurones[J].Br J Anaesth,2008,101(3):374-379.
[10]张砡,李俣,李伟光,等.丙泊酚对新生大鼠大脑皮层星形胶质细胞合成凝血酶敏感蛋白1的影响[J].南方医科大学学报,2013,33(9):1316-1320.
[11]Gomez-Pinilla F,So V,Kesslak JP.Spatial learning and physical activity contribute to the induction of fibroblast growth factor:neural substrates for increased cognition associated with exercise[J].Neuroscience,1998,85(1):53-61.
[12]Luo T,Wu J,Kabadi SV,et al.Propofol limits microglial activation after experimental brain trauma through inhibition of nicotinamide adenine dinucleotide phosphate oxidase[J].Anesthesiology,2013,119(6):1370-1388.
Effects of propofol on hippocampal astrocytes and microglia in neonatal mice
JingSheng1,HuangJing1,BaoXiaohang1,ZhouGongrui1,WangYing2,YangTiande1△
(1.DepartmentofAnesthesiology,XinqiaoHospital,ThirdMilitaryMedicalUniversity,Chongqing400037,China;2.DepartmentofHistologyandEmbryology,ThirdMilitaryMedicalUniversity,Chongqing400038,China)
Objective To observe the effects of propofol on the hippocampal astrocytes and microglia in the nenotal mice.Methods 15 healthy mice from the same litters on postnatal 7 d were randomized into 3 groups:high dose propofol group,low dose propofol group and 10% intralipid control group.All mice were treated with drugs on postnatal 7 d by intraperitoneal injection and were sacrificed at 24 h after drugs treatment.The high dose group was injected with propofol 60mg·kg-1;the low dose group was injected with propofol 30mg·kg-1;the control group was injected with the equal volume of 10% intralipid.The immunohistochemistry assay was used to detect the expression of glial fibrillary acidic protein (GFAP) and ionized calcium binding adapter molecular 1 (Iba1) for observing the effect of propofol on the astrocytes(AST) and microglia in the hippocampus.Results Compared with the control group,the number of GFAP-labeled AST in the dentate gyms(DG) molecular layer of hippocampus in P7 mice of the high dose propofol group was significantly reduced(P<0.01),while no obvious effect of the low-dose propofol on the number of AST was observed;high dose and low dose propofol all significantly decreased the number of Iba1-labeled microglia.Conclusion Propofol can inhibit the growth of the hippocampal AST and microglia in a dose-dependent manner.
propofol;hippocampus;neuroglia;astrocyte;microglia;neonatal mice
景胜(1982-)主治医师,硕士研究生,主要从事麻醉药物毒性研究。
△通讯作者,Tel:13883008811;E-mail:31011@sina.com。
·基础研究
10.3969/j.issn.1671-8348.2015.11.009
R994.1;R329.24
A
1671-8348(2015)11-1469-03
2014-11-08
2015-01-15)



