汪 峰,何 玉,刘 宓,常 啸,任智晶,潘 卫,李 兴
(贵阳医学院医学检验学院 550004)
糖尿病对于人体健康危害极大,随着病程的发展,部分患者会出现认知功能和行为缺陷等障碍,严重影响其生活质量。钟远等[1]研究显示,慢性高血糖是认知功能损害的独立危险因素。Leibson等[2]研究显示,糖尿病患者中老年性痴呆的发病率明显高于正常老年人。Cukierman等[3]的研究显示,糖尿病患者认知功能明显低于非糖尿病患者,其认知功能损伤的概率是非糖尿病患者的1.5倍,未来发生痴呆的概率是后者的1.6倍。但是目前人们对于糖尿病认知功能障碍的发病机制尚不是十分清楚,临床上也无规范、特异的方法来诊断该病。因此建立一个良好的糖尿病伴认知功能障碍的动物模型,对于进一步研究糖尿病认知功能损害很有意义。
本研究通过大鼠腹腔注射链脲佐菌素(STZ)诱导形成糖尿病大鼠模型,观察糖尿病大鼠认知功能的变化,并确立糖尿病认知功能障碍大鼠模型建立的时间,为糖尿病并发认知功能障碍的研究提供一种较好的工具。
1 材料与方法
1.1 材料及主要试剂 健康清洁级SD 大鼠,雄性,体质量180~220g(贵阳医学院动物中心);血糖仪及血糖试纸(美国雅培公司);STZ(美国Sigma公司)。
1.2 方法
1.2.1 腹腔注射STZ 诱导SD 大鼠形成糖尿病 研究选择72只雄性SD 大鼠适应性饲养1周,经Morris水迷宫实验挑选无认知功能障碍的大鼠,同时采集尾部静脉血测定大鼠空腹血糖,血糖值在3.0~5.0mmol/L。将大鼠分为6组:3 个对照组(第6、9、12 周组)和3 个模型组(第6、9、12周组),每组12 只。模型组大鼠在禁食12h后腹腔注射0.1 mol/L 枸橼酸-枸橼酸钠缓冲液(pH 4.2)溶解的STZ(按50mg/kg剂量)1 mL,对照组大鼠则注射等量的0.1mol/L 枸橼酸-枸橼酸钠缓冲液(复制糖尿病大鼠模型成功的标准为:注射STZ 溶液72h后空腹血糖大于或等于16.7mmol/L[4-5],且连续3 周其空腹血糖保持在16.7mmol/L 以上[6])。
1.2.2 Morris水迷宫实验检测认知功能 分别在成模后的第6、9、12周采用Morris 水迷宫实验检测大鼠的认知功能。通过定位航行和空间探索实验来分析SD 大鼠的认知功能。
1.2.3 动脉灌注法取材及光学显微镜和电子显微镜进行形态学观察 通过动脉灌注的方法留取大鼠海马组织,固定后制作组织切片并进行HE染色,光学显微镜进行形态学观察;用专用电镜固定液继续固定后制作超薄组织切片并染色,透射电子显微镜进行形态学观察。
1.2.4 其他样本的留取 血清样本:采用股动脉放血法收集血液4~5mL,并及时分离血清后置-80 ℃保存待用。组织样本:断头取脑,分别分离大鼠海马组织及脑血管(基底动脉)并置-80 ℃保存待用。
1.3 统计学处理 采用SPSS13.0 软件进行数据处理,计量资料采用±s表示,组间比较采用t检验和单因素方差分析,以P<0.05为差异有统计学意义。
2 结 果
2.1 大鼠的空腹血糖结果 与同时间段的对照组大鼠比较,模型组大鼠的空腹血糖水平均显着升高,差异有统计学意义(P<0.01),见表1。
表1 各组大鼠空腹血糖结果(±s,mmol/L)

表1 各组大鼠空腹血糖结果(±s,mmol/L)
a:P<0.01,与同时间点对照组比较。
组别 n 造模前造模后6 周 9 周 12周对照组36 3.64±0.52 4.04±0.63 4.27±0.44 4.23±1.02模型组 36 3.81±0.50 18.6±1.29a 19.0±1.36a 22.1±2.53 a
2.2 大鼠体质量和大脑质量以及两者之间的比值 与同时间段的对照组大鼠比较,模型组大鼠的大脑质量明显减轻,差异有统计学意义(P<0.05,P<0.01);模型组大鼠的体质量较同时间的对照组明显减轻,大脑质量与体质量的比值明显增高,差异有统计学意义(P<0.01),见表2。
2.3 大鼠Morris水迷宫实验结果 与同时间段的对照组大鼠比较,模型组大鼠的逃避潜伏期和首次穿越时间均明显增加,穿越次数明显减少,差异有统计学意义(P<0.01),见表3。
表2 各组大鼠的体质量和大脑质量以及两者之间的比值结果(±s,n=36)
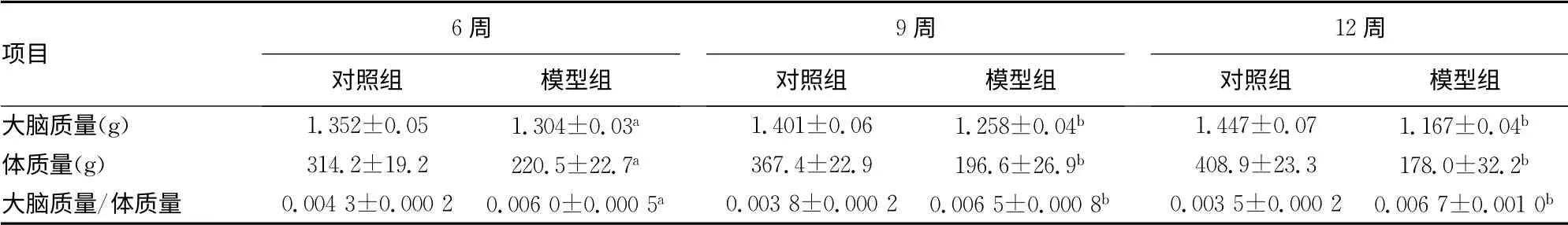
表2 各组大鼠的体质量和大脑质量以及两者之间的比值结果(±s,n=36)
a:P<0.05,b:P<0.01,与同时间点对照组比较。
项目6周对照组 模型组9周对照组 模型组12周对照组 模型组大脑质量(g) 1.352±0.05 1.304±0.03a 1.401±0.06 1.258±0.04b 1.447±0.07 1.167±0.04 b体质量(g) 314.2±19.2 220.5±22.7a 367.4±22.9 196.6±26.9b 408.9±23.3 178.0±32.2b大脑质量/体质量 0.004 3±0.000 2 0.006 0±0.000 5a 0.003 8±0.000 2 0.006 5±0.000 8b 0.003 5±0.000 2 0.006 7±0.001 0 b
表3 各组大鼠水迷宫实验结果(±s,n=36)
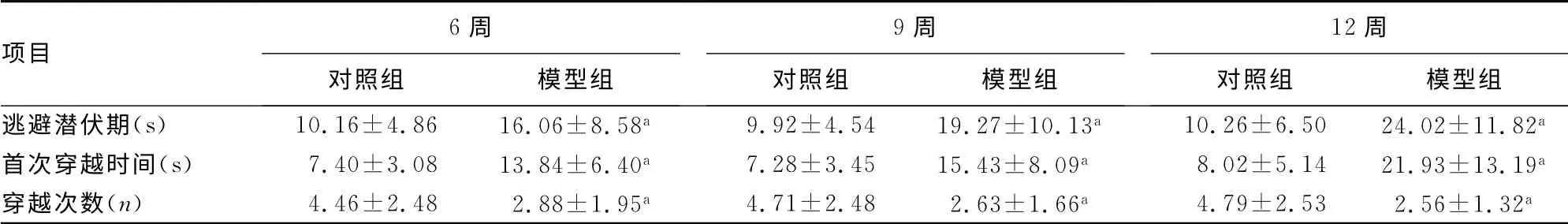
表3 各组大鼠水迷宫实验结果(±s,n=36)
a:P<0.01,与同时间点对照组比较。
项目6周对照组 模型组9周对照组 模型组12周对照组 模型组逃避潜伏期(s) 10.16±4.86 16.06±8.58a 9.92±4.54 19.27±10.13a 10.26±6.50 24.02±11.82 a首次穿越时间(s) 7.40±3.08 13.84±6.40a 7.28±3.45 15.43±8.09a 8.02±5.14 21.93±13.19a穿越次数(n) 4.46±2.48 2.88±1.95a 4.71±2.48 2.63±1.66a 4.79±2.53 2.56±1.32 a
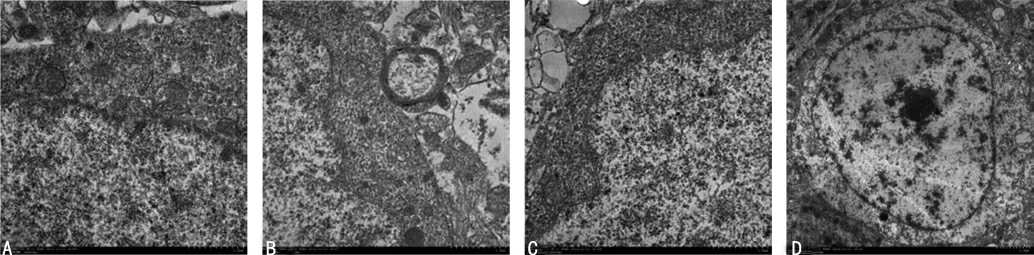
图3 各组大鼠海马神经元细胞电子显微镜下超微结构
2.4 大鼠海马组织透射电镜观察结果 各时间段对照组大鼠海马神经元细胞的细胞核形态规则,核内染色质丰富,分布均匀,核仁明显,细胞质内细胞器丰富,粗面内质网分布规则,网腔均匀一致,线粒体数量较多,排列密集;模型组大鼠从成模后第6 周开始至第12 周,其海马神经元细胞逐渐出现细胞体积变小,核膜皱缩,核内染色质分布不均,颗粒化,凝集成块并边集,粗面内质网网腔扩张,分布不规则,线粒体肿胀,呈不规则形,双层膜结构不清,并且这些形态学改变随着糖尿病病程的延长日趋明显,见图3。
2.5 大鼠海马组织切片HE 染色观察结果 各时间段对照组大鼠海马CA1区的神经元细胞(主要是锥体细胞)形态均较正常,大多呈圆形或椭圆形,细胞核大而圆,细胞质淡染、呈嗜碱性,且排列规则有序;成模后第6周及第9周的模型组大鼠海马CA1区的神经元细胞形态与对照组相比并未见明显异常,但成模后第12周模型组大鼠海马CA1区的神经元细胞形态出现了较明显的异常,主要表现为神经元数量有所减少,细胞肿胀,细胞核碎裂或者消失,细胞排列紊乱疏松,见图4。
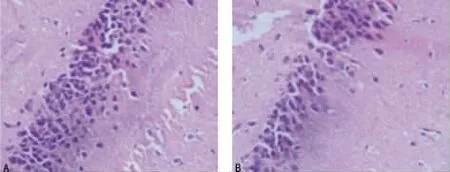
图4 对照组与模型组大鼠海马CA1区的组织学改变(HE×400)
3 讨 论
随着糖尿病的发生,许多糖尿病患者的认知能力会出现不同程度下降,尤其在老年人中正在成为一个不容忽视的医学和社会问题。Dalai等[7]研究显示,糖尿病时血管内皮功能和血小板凝集功能障碍加重,导致血管内皮增殖和血浆粘稠度增加,从而出现腔隙性脑梗死及脑血栓等并发症。而糖尿病的慢性毒性作用会导致微血管受损,数目减少,基底膜增厚,血脑屏障完整性受到破坏,影响营养物质的运输和血流不畅,进而导致脑组织受损[8]。糖尿病患者由于糖代谢紊乱,会导致脑血管改变,进而损害中枢神经系统,使得大脑在结构、神经生理及神经精神等方面发生病理改变,最终可能形成以获得性认知功能和行为缺陷为特征的糖尿病慢性并发症,即糖尿病脑病[9-10]。因此,建立稳定可靠的糖尿病认知功能障碍的动物模型,对于该病的进一步研究显得十分重要和必要。自1960年开始有研究人员利用STZ诱发动物制作糖尿病模型以来[11],STZ已成为当前广泛采用的糖尿病动物模型化学诱导剂。但STZ诱导糖尿病动物模型的成功率受诸多因素影响,包括给药的剂量、给药方法、STZ的溶剂以及大鼠的品种等,因此造模的成功率也有所不同。一般认为,一次性大剂量(50~90 mg/kg)的STZ腹腔或静脉注射可直接破坏胰岛β细胞导致糖尿病的发生,其具有简便、用药量小、药物毒性较低、胰岛β细胞损伤特异性高等诸多优点。本课题组在前期研究中发现采用50mg/kg的STZ剂量及pH 4.2、0.1mol/L 枸橼酸-枸橼酸钠缓冲液进行溶解对大鼠进行腹腔注射的成模率高、死亡率低[12]。
尽管目前有关糖尿病脑病的发病机制并不十分清楚,直接建立糖尿病脑病动物模型还存在着诸多困难,但已有研究表明,神经细胞的变性和凋亡导致中枢神经细胞的数目减少是痴呆以及其他中枢神经变性性疾病发生认知功能障碍的重要病理基础[13]。因此,在此认识的基础上,本研究首先采用STZ(按50mg/kg的剂量)诱导的糖尿病大鼠模型,在成模后的不同时间段进行Morris水迷宫实验显示,模型组大鼠的逃避潜伏期、首次穿越时间均明显比对照组延长或增加,而穿越次数则明显比对照组减少,说明所复制的糖尿病大鼠已经发生了不同程度的学习记忆功能障碍,且随着病程的延长其学习记忆功能障碍也表现得越来越明显和严重;不同时间段各组大鼠的海马组织分别用透射电子显微镜以及HE 染色后用普通光学显微镜观察其形态学上的变化显示,随着模型组大鼠学习记忆功能障碍程度的增加,与同时间段的对照组比较,其海马神经元在形态学上的改变越来越明显,且数量也在减少,这说明海马神经元细胞凋亡的加快与其认知功能障碍程度的加重息息相关,存在着因果关系。王宪玲等[14]在对自发性2型糖尿病小鼠进行研究时也得出了类似的结果。此外,通过对模型组大鼠大脑质量的分析可以看出,随着糖尿病病程的延长,特别是从成模后第六周开始,与同时间段的对照组大鼠相比较,其大脑质量差异有统计学意义(P<0.05),这与Bao等[15]的研究结果相似。我们的研究结果表明,通过以上方法来建立糖尿病并发认知功能障碍大鼠模型的方法是科学和合理的。
本研究通过对模型组大鼠的动态观察,发现模型组大鼠从第6周开始出现认知功能障碍,并随着糖尿病病程的延长呈进行性加重。采用透射电子显微镜及HE 染色等手段对其海马组织进行观察,海马神经元细胞从发病后第6周开始出现凋亡前的形态学改变,并随着糖尿病病程的延长而日趋明显。但成模后第6周及第9周的模型组大鼠海马CA1区的神经元细胞形态与对照组相比并未见明显异常,而成模后第12周的模型组大鼠海马CA1 区的神经元细胞形态则出现了较明显的异常,主要表现为神经元数量有所减少,细胞肿胀,细胞核碎裂或者消失,细胞排列紊乱疏松。
以上结果表明,利用STZ诱导SD 大鼠形成糖尿病后,随着病情的发展,糖尿病大鼠逐渐出现了认知功能障碍。至第12周,其大脑海马神经元在形态学上发生了明显变化,并出现了相应的行为学改变,因此可以将该时间段作为糖尿病并发认知功能障碍大鼠模型的建立时间。
[1] 钟远,贾伟平.中老年2型糖尿病早期认知功能改变的临床研究[J].实用诊断与治疗杂志,2005,19(8):128.
[2] Leibson CH,Rocca WA,Hanson VA,et al.Risk of dementia among persons with diabetes mellitus:apopulation-based cohort study[J].Am J Epidemiol,1997,145(4):301-308.
[3] Cukierman T,Gerstein HC,Williamson JD.Cognitive decline and dementia in diabetes.systematic overview of prospective observational studies[J].Diabetologia,2005,48(12):2460-2469.
[4] 张芳林,李果,刘优萍.2型糖尿病大鼠模型的建立及其糖代谢特征分析[J].中国实验动物学报,2002(1):18-22.
[6] 汪峰,杨国珍,刘宓,等.链脲佐菌素诱导的糖尿病大鼠模型稳定性观察[J].贵阳医学院学报,2012(1):40-42.
[7] Dalai PM,Parab PV.Cerebrovascular disease in type 2diabetes mellitus[J].Neurol India,2002,50(4):380-385.
[8] Muranyi M,Fujioka M,He Q,et al.Diabetea activates cell death pathway after transient focal cerebral i-hetnia[J].Diabete,2003,52(2):481-486.
[9] Fazeli SA.Neuroprotection in Diabetic Encephalopathy[J].Neurodegener Dis,2009,6(5/6):213-218.
[11] Rakieten N,Rackietan ML,Nadkarni MR.Studies on the diabetogenic action of streptozotocin(NSC-37917)[J].Cancer Chemother Rep,1963,29:91-98.
[12] 赵芳,蒋朝晖,杨国珍,等.不同剂量链脲佐菌素建立1型糖尿病大鼠模型[J].贵阳医学院学报,2010,35(1):22-25.
[13] Savitz SI,Rosenbaum DM.Apoptosis in neurological disease[J].Neurosurgery,1998,42(3):555-574.
[14] 王宪玲,贾建平.自发性2型糖尿病小鼠发病早期认知功能的研究[J].首都医科大学学报,2007,28(1):75-77.
[15] Bao Y,Jiang L,Shi YQ,et al.Increased expression of phosphorylated Smad2and Smad3in the hippocampus of streptozotocin-induced diabetic rats[J].Exp Clin Endocrinol Diabetes,2010,118(1):47-50.



