巴桑卓玛,邵秀娟,尼玛玉珍,龚嘎蓝孜,多吉卓玛,央 拉,柯 杨
(1.西藏大学医学院高原医学研究中心,西藏拉萨850000;2.中国科学院北京基因组研究所,北京100101;3.西藏自治区人民医院B超室,西藏拉萨850000 4.北京大学肿瘤医院遗传室,北京100142)
近一个世纪以来,高原成为对人类最具挑战性的环境之一。高原世居人群对高原低氧环境良好的适应能力,是长期自然选择和进化的结果,目前有研究初步证明藏族在高原人类群体中已获得了最佳高原适应性[1-2]。
登山运动本身是一种耐力运动,运动耗氧跟自然环境低氧对人体的压力存在相似作用,在高原从事登山运动更加剧了低氧。而西藏登山队不仅能在高原恶劣环境下生存,且能进行高强度的登山运动,但很少有人对西藏登山运动员的运动能力及遗传素质进行过系统的研究,因此本项目运用分子遗传流行病学手段,对多因素作用的复杂过程-运动能力的遗传素质和高原适应进行研究。
低氧诱导因子-1α(HIF-1α)是机体对低氧反应的一个极其重要的中介物质,可能作为活性氧的受体去感受环境中的低氧程度,继而对一系列的低氧反应基因进行转录调节,使红细胞生成增多,携氧能力增强,促进血管再生和重建能力提高[3]。同时糖酵解能力增强、细胞内的三磷酸腺苷(ATP)生成增多,满足机体的能量需要,提示它在细胞代谢和氧供给方面发挥重要的作用,而且还被认为是与杰出爆发力素质相关基因之一[4]。目前对HIF-1α基因多态性的研究已有一些报道,但与低氧训练、低氧适应效果个体差异性的研究较少,尚需进一步地研究。内皮型一氧化氮合酶(eNOS)是低氧调节内皮细胞基因表达及活性的因子之一。研究证实NO 可以调节肺血管舒张状态,改善肺局部通气/血流比值,防止血小板(PLT)凝集,促使气道平滑肌舒张。已有研究证实eNOS基因的多态与急性高原病易感性、高原肺水肿等相关[5-6]。肌红蛋白(myoglobin,MB)作为携氧珠蛋白中的一种,主要在骨骼肌细胞和心肌细胞中表达,尤其是在Ⅰ型肌纤维细胞中高表达,其主要功能是通过可逆性地与氧结合和释放,促进氧从细胞质弥散到线粒体,为肌肉组织储存和转运氧,在机体的氧利用中发挥了重要作用[7-8]。因此,本研究应用了“候选基因”策略,选择与高原适应相关的HIF-1α、MB和eNOS基因进行分析,并与表型特征做了关联分析。
1 资料与方法
1.1 一般资料 本课题共计获得115例来自西藏登山队、西藏登山学校和西藏圣山登山公司3家单位的专业登山运动员的临床表型数据及血液样本,最终有109例合格的血液样本用于基因分型。样品中男111 人,占运动员总人数的96.52%,女4人,占3.48%;籍贯为西藏日喀则的占84.35%、其他占15.65%;年龄16~56 岁,其中16~25 岁57 人(47.57%),26~35岁42人(36.52%),36~45岁3人(2.61%),46~55岁12人(10.43%),大于55岁的1人(0.87%)。从事登山年限1~5年的52人(45.22%),6~10年的30人(26.09%),11~15年的18人(15.65%),16~20年的1人(0.87%),20~30年9人(7.83%),30年的以上的5人(4.35%)。受试者均签订知情同意书。
1.2 方法
1.2.1 设计问卷调查表 内容包括:一般情况(姓名、性别、年龄、民族、籍贯等)和吸烟史、饮酒史、一些遗传性疾病家族史、治疗史等;ABO 血型系统的分型;台式血压仪检测血压;Nellcor NPB-40(USA)检测血氧饱和度;SYSMEXpocH-100i型全自动三分类血液分析仪(Japan)检测红细胞数(RBC)、血红蛋白(Hb)和红细胞压积(HCT);SPIDA5(Micro Medical Limited,Kent,ME1 2AZ,UK)检测肺功能;ACUSON CA94043 型超声诊断仪(USA)按照常规方法进行M 型、二维及彩色多普勒超声检测,根据仪器提供的测量软件获得心功能各项指标。
1.2.2 候选基因的选择和分型情况 从每个受试者一次性抽取2~5mL静脉血液,抽提DNA 用于基因检测。经过初步筛选后,有109人/份的数据符合标准且完整而用于最后的基因分型数据的统计和分析。选择了HIF-1α、MB和eNOS 3个候选基因利用HapMap databank(www.hapmap.org/cgi-perl/gbrowse/hapmap)共选择了14个tSNPs位点,其中HIF-1α共选 择 了 (rs966824、rs11549467、rs2301104、rs12434438、rs2301113)5 个tSNPs位点,MB 选择了(rs1997882、rs7293、rs16995883、rs4140603)4 个tSNPs位 点;eNOS 基 因 选 择 了(rs3918227、rs1800783、rs1799983、rs1808593、rs3918188)5个tSNPs位点,利用Taqman探针技术完成了全部有效样本的基因分型工作。
1.2.3 质量控制 为了使研究结果可信,采用了以下措施:(1)设计统一的调查表;(2)为了减小系统误差,对调查人员进行统一培训,统一调查标准;(3)保证每项测量数据的采集均由同一人完成。
1.3 统计学处理 采用SPSS16.0软件进行数据分析,计量资料用±s表示,χ2值进行哈迪温伯格值检验。单因素方差分析法应用于群体间表型的比较。plink软件对所得数据进行关联分析,采用线性回归模型计算基因型对临床表型的影响,以P<0.05为差异有统计学意义。
2 结 果
2.1 临床表型结果 本次调查获得115个登山运动员的临床表型数据,发现登山运动员虽然在高海拔进行高强度运动,但其心功能指数不仅没有下降,反而一些关键指标普遍强于平原或高原的正常参数值,如射血分数(EF)在藏族登山运动员人群中是(80.73±3.68)%,明显高于正常范围(67±8)%,见表1。

表1 藏族运动员表型数据的统计描述
2.2 候选基因分型 对3个基因MB、HIF1α及NOS3上14个SNPs位点利用Taqman探针技术完成了全部有效样本的基因分型工作。候选SNPs信息及最小等位频率见表2。所有表型数据的数量性状与选择的tSNPs位点进行了关联分析,位点与表型性状具有显着相关(P<0.05),见表3。
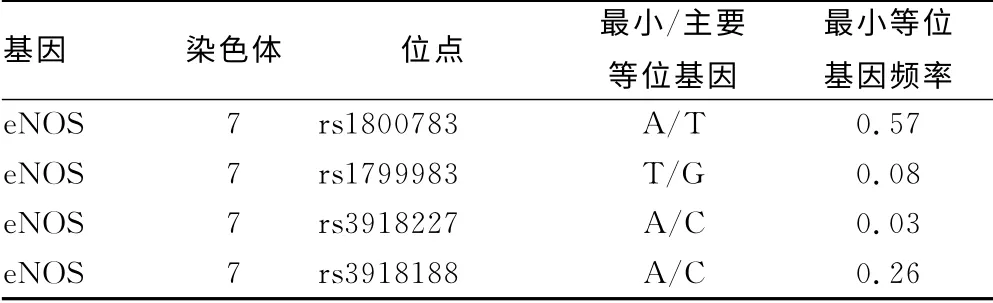
表2 候选SNPs信息及最小等位频率

续表2 候选SNPs信息及最小等位频率

表3 候选基因SNPs位点与表型数据的 数量性状关联分析
数量性状关联分析发现,eNOS 基因上一个SNP 与IVS相关;HIF-1α基因的2个SNP 与RVOT,AO 及MPV 相关;而MB上2个SNPs与Hb,RDW 及PLT 相关(P<0.05)。
3 讨 论
早在20世纪80年代,人们已经了解到人的运动能力受到很多遗传因素的影响,表现出很大的个体差异[9-10]。在长期低氧环境选择压力下世居高海拔人群则产生了低氧适应,表现为低氧耐受表型。而耐力表现与低氧耐受表型相似。有研究证明,在高原低氧条件下,心脏的最大储备能力与机体的最大摄氧能力及最大运动能力间密切相关。因此,在评价高原训练的生理效应时,心功能将是一项重要指标。有文献报道运动员在长期高强度体育训练等因素作用下会造成心脏重构,如心肌肥厚,心室扩大,心房扩张等现象,人们把这种运动员肥大心脏称为“运动员心脏”,有人认为这种心脏增大是运动员长期运动的生理适应的结果,有的认为是病理性的疾病,对此到目前为止仍然说法不一。此次调查发现运动员的很多表型数据,如心功能指数普遍高于正常阈值,藏族登山运动员表现出的反映心功能各项指标的增强,提示其可能为适应性的生理表型而非病理型的改变。
作为低氧应答时基因表达和恢复细胞内环境稳定的调节中心,HIF-1α对于胚胎的血管形成及存活、缺血心肌的新血管生成和低氧诱导的细胞凋亡过程都是非常重要的。此次通过关联分析,发现HIF-1α基因的rs2301113位点与心功能的检测指标右室流出道和主动脉内径相关。而另一个位点rs966824与平均血小板体积相关。有文献报道HIF-1α基因的rs2301113位点与非小细胞肺癌显着相关,并提示其可作为非小细胞肺癌患者手术后的预后指标[11]。而且其位点变异可能调节结肠直肠癌患者术后辅助化疗的疗效[12]。众所周知,人体很多疾病的病理过程都会有缺氧的问题(如心脑血管、肿瘤和呼吸系统等疾病),其中肿瘤由于血管微环境异常造成血液供应不足而导致缺氧[13]。因此,推测生理性的缺氧和病理性的缺氧在分子水平上有其共性的机制。
eNOS基因上的rs1800783 位点与室间隔膜厚度显着相关。有文献报道rs1800783与缺氧缺血性脑病和心血管疾病相关[14-15]。低氧是心血管疾病发病过程中一个重要的病理生理因素。在海拔8 848m 的地方,大气压还不到海平面的1/3,藏族登山运动员应对高原低氧和高强度运动的双重刺激,需要更高的摄氧能力和更大的心输出量,由此推测登山运动员可能存在某种机制应对这种刺激从而对心肌进行保护。而HIF-1α和eNOS等一些基因可能对这种心脏的重构有所贡献,对这一复杂性状可能发挥“微效”基因作用,但对此还未见到相关报道,还需要进一步深入研究和验证。在缺氧或肌肉急剧运动时,肌肉中MB的表达量是显着增高的。有文献报道,MB 在同样的氧分压下结合氧的量是Hb结合氧量的6倍,线粒体可以由此方式获取大量的氧。在对高原土生动物低氧适应的研究中发现,高原土生动物心肌和骨骼肌可储存大量氧气来满足其氧耗,进一步增强其对低氧环境的适应能力[16]。研究发现高原动物和人骨骼肌中的MB的含量比平原水平高[17]。在低氧分压状态下,组织既可以通过MB储存氧,同时也促进了氧向细胞内弥散,从而向线粒体供氧,有益于改善组织氧的弥散率,是低氧生理性适应机制的一个重要环节。通过此次与登山运动员的表型进行关联分析,笔者发现MB 上2 个SNPs(rs16995883和rs4140603)与Hb 水 平,RDW 及PLT 相 关。提示MB在低氧运动过程中在机体内氧的结合、转运等方面可能发挥的重要作用来应对环境低氧和运动低氧的双重压力,但没有发现这些位点的其他相关报道。
基因多态性可能是高原习服、高原适应和各种高原病的发病机制之一。从遗传学角度来看,高原低氧适应和运动能力及人体的很多表型特征是多基因相互作用的结果,虽然此次从基因的角度对高原低氧运动的分子机制给了一点提示,但由于运动员总体样本少,难以满足遗传学研究的需要,且单从单基因的角度观察其与表型的关联性难免有局限,再者西藏登山运动员年龄跨度较大,筛选出一批最佳对照人群十分困难,无法进行一些重要表型数据的对比研究,因此,本课题筛选出来的候选信号不能一概而论,对于候选信号的假阳性问题及候选基因如何发挥作用,仍需要深入探究。
[1] Simonson TS,Yang YZ,Huff CD,et al.Genetic Evidence for High-Altitude Adaptation in Tibet[J].Science,2010,329(5987):72-75.
[2] Xin Y,Yu L,Emilia HS,et al.Sequencing of 50human exomes reveals adaptation to high altitude[J].Science,2010.329(5987):75-78.
[3] 刘坤祥,孙学川,王圣巍,等.HIF-1α基因c1772T、G1790A 多态性与藏族人群高原低氧适应关系的研究[J].生物医学工程学杂志,2007,24(3):654-658.
[4] 杨若愚,王予彬,沈勋章,等.基因多态性与杰出运动能力[J].中国组织工程研究,2014,18(7):1121-1128.
[5] Wang P,Koehle MS,Rupert JL,et al.Genotype at the missense G894T polymorphism (Glu298Asp)in the NOS3gene associated with the susceptibility to acute mountain sickness[J].High Alt Med Biol,2009,10:261-267.
[6] 马福才,康龙丽.基因多态性与高原性肺水肿的易感性研究进展[J].国外医学:医学地理分册,2013,34(4):271-275.
[7] 马兰,格日力.肌红蛋白生物学作用与低氧[J].青海医学院学报,2011,32(1):69-72.
[8] Ordway GA,Garry DJ.Myoglobin:an essential hemoprotein in striated muscle[J].J Exp Biol,2004,207(20):344l-3446.
[9] Pérusse L,Rankinen T,Hagberg JM,et al.Advances in exercise,fitness,and performance genomics in 2012[J].Med Sci Sports Exerc,2013,45(5):824-831.
[10] Sawczuk M,Maciejewska A,Cieszczyk P,et al.The role of genetic research in sport[J].Sci Sports,2011,26(5):251-258.
[11] Liu B,Liu QC,Song Y,et al.Polymorphisms of HIF1A gene are associated with prognosis of early stage nonsmall-cell lung cancer patients after surgery[J].Med Oncol,2014,31(4):877.
[12] Zhang Y,Wang P,Zhou XC,et al.Genetic variations in the HIF1A gene modulate response to adjuvant chemotherapy after surgery in patients with colorectal cancer[J].Asian Pac J Cancer Prev,2014,15(11):4637-4642.
[13] Poon E,Harris AL,Ashcroft M.Targeting the hypoxiainducible factor(HIF)pathway in cancer[J].Expert Rev Mol Med,2009,11:e26.
[14] Kuzmanicšamija R,Primorac D,Rešic B,et al.Association of NOS3gene variants and clinical contributors of hypoxic-ischemic encephalopathy[J].Braz J Med Biol Res,2014,47(10):869-875.
[15] Juan P,Casas,Gianpiero L.et al.Endothelial Nitric Oxide Synthase Gene Polymorphisms and Cardiovascular Disease:A Huge Review[J].Am J Epidemiol,2006,164:921-935.
[16] Stoeltzing O,McCarty MF,Wey JS,et al.Role of hypoxia-inducible factorⅠalpha in gastric cancer cell growth,angiogenesis,and vessel maturation[J].J Natl Cancer Inst,2004,96(12):946-956.
[17] 齐新章,王晓君,朱世海,等.高原鼢鼠和高原鼠兔心脏对低氧环境的适应[J].生理学报,2008,60(3):348-354.



