韦 露,罗高斌,薄占东,周志广,阮中坚
(广西医科大学第一附属医院骨关节外科,南宁530021)
自体骨被认为是骨移植材料的“金标准”,因为它结合了骨移植材料所需特性:成骨、骨诱导和骨传导[1]。腓骨移植作为自体骨移植的重要组织来源,已广泛应用于治疗骨不连、关节融合、修复骨缺损[2-5]。腓骨通过上、下胫腓韧带及骨间膜与胫骨联结在一起形成一个完整的力学结构,参与支撑体质量,维持踝关节的正常功能。临床上腓骨作为移植骨源移植后,保留其原有骨膜,使腓骨具有再生能力,对于儿童尤其重要。但是再生的腓骨组织与正常腓骨组织在形态、功能、生物应力、组织结构上是否存在差异,国内外研究很少。本研究通过建立幼兔腓骨移植的动物模型,观察移植后再生的腓骨组织与健侧腓骨组织在组织形态、成骨能力及生物应力等方面是否存在差异,为临床上进行自体腓骨移植提供相关的理论支持。
1 材料与方法
1.1 材料
1.1.1 实验试剂和设备 碱性磷酸酶(ALP)染色试剂盒(南京建成生物研究所提供);乙二胺四乙酸(EDTA,成都化学试剂厂提供);骨科切片机;岛津AGX万能材料试验机。
1.1.2 实验动物 新西兰小白兔40只(广西医科大学动物实验中心提供),3月龄、体质量2.00~2.45kg、平均(2.2±0.28)kg,雌性未孕产。20只动物随机分组编号,以右侧腓骨为实验组,左侧为对照组。同时为了验证保留骨膜与否对腓骨1.5cm骨缺损模型愈合的作用,本实验设置不保留骨膜组,每组实验动物4只。
1.2 方法
1.2.1 动物模型
1.2.1.1 麻醉 小白兔仰卧位固定,经耳缘静脉注射3%戊巴比妥钠溶液,剂量1mL/kg。
1.2.1.2 切除方法 实验组:取每只幼兔右侧腓骨作为实验组,常规消毒,铺巾。自腓骨头向下沿外踝作纵行切口,切开皮肤、皮下组织和筋膜后,自比目鱼肌与腓骨长短肌之间进入。在腓骨中上将腓骨长短肌、比目鱼肌向前后侧分离,用骨膜剥离器自下向上剥离腓骨骨膜,使腓骨斜向起始肌纤维连同骨膜一起剥开。在腓骨中段量取约1.5cm长度[6],一般认为缺损值达到骨直径的1.5~2.0倍即可认为是缺损临界值[7]。腓骨近端及远端用尖嘴咬骨钳剪断(注意保护骨膜),取出骨块(图1)。仔细止血,依次缝合深筋膜、皮下组织及皮肤。对照组:取每只幼兔左侧腓骨,腓骨不切除,作为实验自身对照。不保留骨膜实验组:手术步骤基本同切除腓骨,在切取腓骨时不保留骨膜将腓骨及骨膜完整切除。
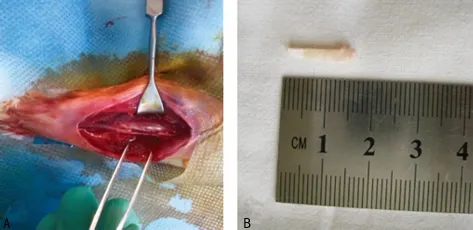
图1 术中保留骨膜切取腓骨
1.2.1.3 X线片监测腓骨再生的情况 分别于术后15、30、60d同时摄双侧小腿照片,观察再生腓骨的生长情况及形态变化,并进行影像学分析。
1.2.1.4 取材 实验过程中,4只兔子术后出现切口感染、患疥螨等并发症,治疗未果,死亡,未达到实验终点,予以剔除。其余兔子于术后60d用3%戊巴比妥钠(1mL/kg)静脉麻醉后,截取原位再生腓骨组织(约1.5cm),同时截取对侧相同部位的腓骨组织(约1.5cm),见图2。用生理盐水湿纱布将取下腓骨组织包裹,置于-20℃的冰箱中,以备实验使用。
1.2.2 生物应力测定 采用岛津万能材料试验机进行3点弯曲试验,将包埋好的小白兔腓骨标本固定在2个支撑点上,连接传感器的马鞍形压头于腓骨中点处施加压力。其中跨距为15mm,加载速度以1mm/min下压腓骨,试验以腓骨断裂为终点。从计算机软件上记录荷载-跨中桡度曲线数据:最大荷载、弹性荷载、最大挠度、弹性桡度、弹性模量。
1.2.3 骨组织形态染色 制作骨组织切片。(1)取材固定:取骨干骨皮质,用锯子取1.5cm×1.0cm×0.5cm骨组织固定于10%甲醛固定液内24h;(2)脱钙:将固定好的骨组织放入10%EDTA脱钙液,37℃恒温下脱钙48h,用细针能刺入骨头内无阻力表示脱钙完毕;(3)脱水:利用脱水机自动脱水;(4)包埋:骨组织按常规包埋入蜡;(5)切片:利用骨科切片机切取4μm的切片。
1.2.3.1 苏木素-伊红(HE)染色采用常规方法
1.2.3.2 ALP染色 应用ALP染色试剂盒按说明书进行染色,ALP着色呈灰黑色,光学显微镜下观察。

图2 再生的腓骨组织
1.3 统计学处理 采用SPSS16.0统计学软件进行数据统计学处理,计量资料用±s表示,组间比较采用t检验,检验水准α=0.05,以P<0.05为差异有统计学意义。
2 结 果
2.1 X射线监测结果 保留骨膜切取腓骨术后15d:移植区两端有新骨形成,骨皮质连续性中断,移植区有少许模糊影,骨痂影开始沿向由界面两端向间隙中央生长,局部骨痂连接,间隙内呈低密度影像;30d:新生骨长入移植区,骨皮质连续性基本恢复,骨端界面较清晰,新生骨小梁充满间隙;60d:取骨区形成完整的新骨,骨皮质完整连续,间隙内密度显着增加,难以辨认骨端界面,骨纹理呈极向性排列,见图3。不保留骨膜组术后15d:骨折两端出现明显骨痂生成;30d:骨痂从骨缺损两端向中央推进,由高渐低呈楔形或斜坡状,呈“推进形”骨痂;60 d:随着骨缺损进一步修复与骨缺痂封闭,骨痂表损相邻的胫骨侧可见部分新生骨痂,形成类似截面“碗状”骨缺损状态,两端新生骨面有大量骨痂成不规则状,见图4。
2.2 生物应力测定与对健侧腓骨比较,再生腓骨骨干的最大荷载、弹性荷载、最大挠度、弹性桡度、弹性模量均差异无统计学意义(P>0.05),见表1。
2.3 组织学观察 HE染色:实验组骨组织骨皮质板层骨结构完整,骨陷窝内见骨细胞,哈弗斯管结构清晰、通畅,板层骨沿哈佛氏管排列,成熟骨皮质结构已经完成,与对照组比较差异无统计学意义。ALP染色:实验组与对照组骨皮质内侧周边及骨陷窝内散在染色均呈灰黑色,ALP的活性较活跃,显示成骨细胞成骨能力强,ALP着色两者差异无统计学意义,见图5。
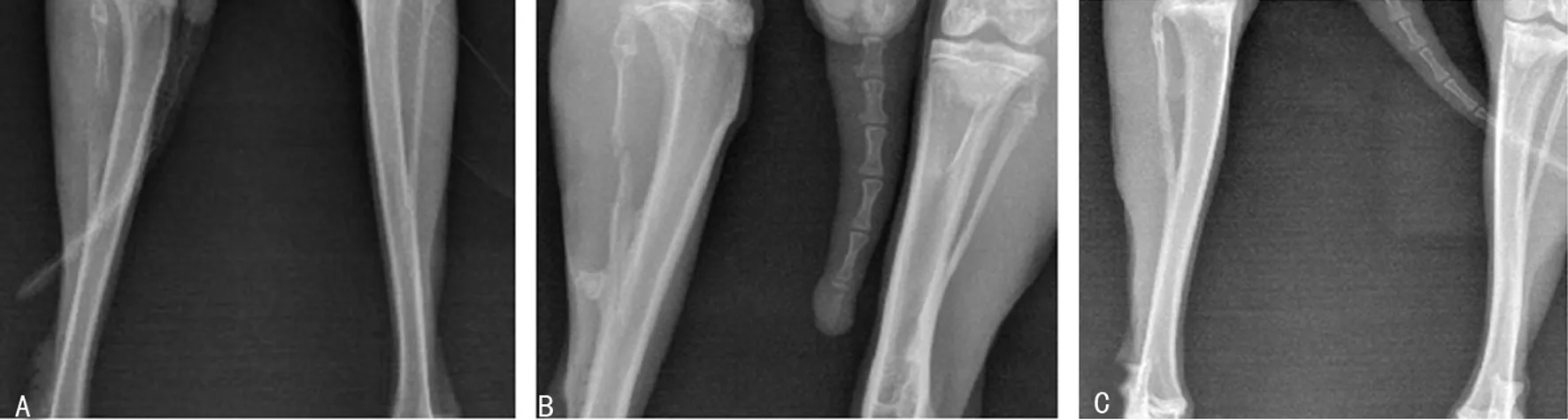
图3 保留骨膜术后15、30、60dX线片
表1 腓骨3点弯曲实验(±s)

表1 腓骨3点弯曲实验(±s)
组别 n 最大荷载(N) 弹性荷载(N) 最大挠度(mm) 弹性桡度(mm) 弹性模量(MPa)对照组 16 82.3±30.4 64.5±28.1 0.44±0.08 0.43±0.06 148.7±52.2实验组 16 80.5±24.5 59.7±20.8 0.41±0.07 0.41±0.09 146.4±48.4

图4 不保留骨膜术后15、30、60dX线片
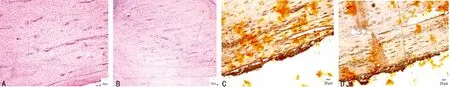
图5 各组组织学观察
3 讨 论
在骨再生及愈合过程中年龄具有重要的影响,幼兔处于生长期,其骨再生能力较成年及老年兔较强,因此本实验采用3月龄骨再生能力较强的幼兔进行实验。国内外关于骨缺损模型的长度存在一定的差异。有研究建立了骨缺损1.0、1.2、1.4、1.6和2.0cm组,结果桡骨中段缺损(包括骨膜)尺寸大于或等于1.4cm骨愈合低,模型更加可靠。Niemeyer等[8]截除桡骨远端1.5cm骨段(包括骨膜)造骨缺损模型,术后骨缺损区,无骨性连接,骨缺损范围0.8~1.2cm。而目前还没有文献报道腓骨骨缺损模型,在骨缺损模型建立中,腓骨和桡骨在解剖上都有胫骨和尺骨伴行,两者在骨缺损愈合过程相近,故本研究选择缺损1.5cm腓骨制作模型。本实验切取腓骨组织后,通过X线片监测,术后15d:移植区两端有新骨形成,骨皮质连续性中断,移植区有少许模糊影;术后30d:骨皮质连续性基本恢复;术后60d:骨皮质完整连续,取骨区形成完整的新骨。腓骨移植后移植区骨缺损的骨再生是1种特殊的过程,不仅是骨愈合的过程而且是骨再生的过程,其再生机制与骨折愈合相似,存在膜内成骨和软骨成骨两种方式[9],但其又有所特点以膜内成骨为主,软骨成骨为辅[10-11]。实验组不保留骨膜完整切除腓骨及周围骨膜后,术后X线片监测结果提示缺损区未见骨性连接,缺损两端可见大量骨痂形成。说明本实验建立的骨缺损模型是可行的,同时也验证了保留骨膜在骨缺损骨再生愈合中具有重要作用。
骨生物力学研究骨组织在外界作用下的力学特征和骨在受力后的生物学效应是反映骨强度的最敏感、最可靠的评价指标。本次试验中,采用3点弯曲法检测兔子腓骨的力学性能,此力学试验适用于长骨(皮质骨)力学性能的测定[12]。本实验中再生的腓骨与对侧腓骨比较,其生物力学参数差异无统计学意义,腓骨移植后缺损区再生的腓骨具有良好的刚度、韧性及弹性,可与胫骨及周围韧带重新形成一个完整的力学结构,共同参与下肢的负重与活动,维持踝关节稳定。ALP通常被认为是成熟的成骨细胞的标志之一,其活性的高低可反映成骨细胞的成熟状况。本文ALP染色结果显示再生的腓骨组织与正常腓骨组织的在成骨能力方面无明显的差异。HE染色提示两者亦无明显差异,在组织形态上说明再生腓骨组织具有正常的组织结构,从内在结构上维持腓骨的功能。
通过本次试验,发现再生的腓骨组织与正常的腓骨在生物应力、成骨能力、组织形态等方面并无明显差异。从而第1次从实验角度验证了保留骨膜后再生的腓骨组织与正常的腓骨组织具有相同的生物功能及形态特点,可起到原有腓骨的功能。
在小儿骨科的临床实践过程中发现靠近关节的肿瘤、病理性骨折、慢性骨髓炎时常会面临如何选取手术方式的困惑。由于靠近关节,而小儿骨骺发育尚未完全,直接放置内固定物会影响骨骼的发育、放置异体骨则产生骨不愈合或免疫排异等并发症[5,13]。选取自体腓骨移植髓内固定骨折、填充骨缺损作为一种较为理想的手术方式,已在临床上广泛应用。但是蔡林等[14]通过对儿童行腓骨切除术后的长期随访中发现儿童腓骨切除后对踝关节的结构有影响,腓骨的稳定性和完整性在防止踝关节外翻和胫骨远端骨骺楔形样改变起着重要作用。在临床实践中通过保留腓骨骨膜,可原位再生腓骨组织。因此,在临床行腓骨移植时,临床医生应注意保留骨膜的完整性以原位再生腓骨,将供区的影响降至最低。
[1]Bauer TW,Muschler GF.Bone graft materials.An overview of the basic science[J].Clin Orthop Relat Res,2000(371):10-27.
[2]Dhatt SS,Bhagwat KR,Kumar V,et al.Chondroblastoma in a metatarsal treated with autogenous fibular graft:a case report[J].J Foot Ankle Surg,2012,51(3):356-361.
[3]Lin KC,Tarng YW,Hsu CJ,et al.Free non-vascularized fibular strut bone graft for treatment of post-traumatic lower extremity large bone loss[J].Eur J Orthop Surg Traumatol,2014,24(4):599-605.
[4]Sen RK,Tripathy SK,Goyal T,et al.Osteosynthesis of femoral-neck nonunion with angle blade plate and autogenous fibular graft[J].Int Orthop,2012,36(4):827-832.
[5]de Long WG,Einhorn TA,Koval K,et al.Bone grafts and bone graft substitutes in orthopaedic trauma surgery.A critical analysis[J].J Bone Joint Surg Am,2007,89(3):649-658.
[6]赵明东,潘志宏,朱梁豫,等.建立桡骨缺损模型:骨缺损标准尺寸的确立[J].中国组织工程研究与临床康复,2011,15(2):213-218.
[7]Cook SD,Wolfe MW,Salkeld SL,et al.Effect of recombinant human osteogenic protein-1on healing of segmental defects in non-human primates[J].J Bone Joint Surg Am,1995,77(5):734-750.
[8]Niemeyer P,Szalay K,Luginbuhl R,et al.Transplantation of human mesenchymal stem cells in a non-autogenous setting for bone regeneration in a rabbit critical-size defect model[J].Acta Biomater,2010,6(3):900-908.
[9]Yu YY,Bahney C,Hu D,et al.Creating rigidly stabilized fractures for assessing intramembranous ossification,distraction osteogenesis,or healing of critical sized defects[J].J Vis Exp,2012,15(62):3552.
[10]艾田,张俊德,程添栋,等.伊里扎诺夫技术修复兔胫骨骨缺损成骨机制的研究[J].临床骨科杂志,2012,15(2):202-204.
[11]张文涛,卢世璧,张浩.骨缺损修复机制探讨[J].中国临床康复,2002,6(2):186-187.
[12]崔伟,刘成林.基础骨生物力学(二)动物骨生物力学指标的选择及计算方法[J].中国骨质疏松杂志,1998,4(1):93-95.
[13]Toy PC,White JR,Scarborough MT,et al.Distal femoral osteoarticular allografts:long-term survival,but frequent complications[J].Clin Orthop Relat Res,2010,468(11):2914-2923.
[14]蔡林,王华,汤华,等.儿童腓骨移植对供腿功能影响的长期随访[J].中华小儿外科杂志,2004,25(3):264-266.



