江 燕,曹译心,张翠薇,张 旭△
(1.泸州医学院附属中医院心脑病科,四川泸州 646000;2.泸州医学院组织学与胚胎学教研室,四川泸州 646000;3.泸州医学院附属医院病理科,四川泸州 646000)
论着·基础研究
IWR-1-endo对三阴性乳腺癌抑制作用的研究*
江 燕1,曹译心2,张翠薇3,张 旭3△
(1.泸州医学院附属中医院心脑病科,四川泸州 646000;2.泸州医学院组织学与胚胎学教研室,四川泸州 646000;3.泸州医学院附属医院病理科,四川泸州 646000)
目的探明新近发现的Wnt信号通路的小分子抑制剂IWR-1-endo是否会对三阴性乳腺癌细胞系MDA-MB-231以及该细胞系的裸鼠荷瘤模型的生长产生抑制作用及其机制。方法应用不同浓度的IWR-1-endo处理MDA-MB-231细胞并计算细胞增殖抑制率。建立裸鼠荷瘤模型并且每2天1次腹腔注射IWR-1-endo溶液0.1 mL/10 g,同时每4天1次测量瘤体长径和短径、计算肿瘤体积。4周后,处死小鼠、收集肿瘤组织、测量并计算体积抑瘤率和瘤重抑瘤率。将肿瘤组织制成石蜡切片,进行Ki-67染色及TUNEL染色,以计算增殖指数和凋亡指数。另应用western blot检测肿瘤细胞和组织中Axin 1、Axin 2、β-catenin和p-β-catenin蛋白的表达。结果IWR-1-endo可以明显抑制MDA-MB-231细胞的生长,其抑制作用呈浓度依赖型,IC50值为180 nmol/L。IWR-1-endo的体积抑瘤率为42.2%,瘤重抑瘤率为44.6%。与对照组比较,IWR-1-endo组凋亡指数上升,差异有统计学意义,而增殖指数差异无统计学意义。western blot检测结果显示细胞及组织中Axin 1和Axin 2表达量明显上升,β-catenin明显下降,而p-β-catenin上升。结论IWR-1-endo可以通过稳定化Axin而抑制Wnt信号通路,实现对三阴性乳腺癌细胞系及裸鼠荷瘤模型生长的抑制。
乳腺肿瘤;Wnt蛋白质类;IWR-1-endo
三阴性乳腺癌(triple-negative breast cancer,TNBC)是乳腺癌分子分型中的一个亚群,是临床抗乳腺癌治疗的难点。新近有研究已证实,Wnt信号通路参与了三阴性乳腺癌的迁徙、浸润和分化过程[1-2]。因此本研究团队考虑是否可以通过干预Wnt信号通路而实现抑制TNBC的目的。目前已经发现了一些可以抑制Wnt信号通路的药物,但这些药物均存在一定的不良反应[3],因此有必要探索新的Wnt信号通路的抑制剂。IWR-1-endo是新近合成的Wnt信号通路的小分子抑制剂,它可以通过稳定Axin降解复合物而抑制经典Wnt信号通路[4]。但是IWR-1-endo是否可以对TNBC中Wnt信号通路进行抑制进而干预肿瘤的生长,还不得而知;故本研究拟使用IWR-1-endo干预三阴性乳腺癌细胞系MDA-MB-231以及该细胞系的裸鼠荷瘤模型,观察干预效果,并检测相应的增殖指数和凋亡指数;以期了解IWR-1-endo是否对TNBC有抑制作用以并初步探索其机制。
1 材料与方法
1.1 试剂 IWR-1-endo购于Selleck公司;Axin 1、Axin 2和β-Tubulin抗体购于美国Sigma公司;β-Catenin和p-β-Catenin抗体购于美国Cell Signaling Technology公司;Ki-67抗体购于美国Sant Cruz公司。乳腺癌细胞系MDA-MB-231购于中国科学院上海生命科学研究院细胞资源中心。雌性BALB/c裸鼠[16只,5~6周龄,(20±2)g]购于重庆国家生物产业基地实验动物中心。Matrigel购于美国BD公司。
1.2 细胞生长抑制性检测及IC50测定 MDA-MB-231细胞培养于RPMI-1640培养基(加入5%的胎牛血清)。IWR-1-endo使用二甲亚砜(DMSO)作为稀释剂。细胞生长抑制性检测采用SRB法,简要步骤如下:(1)接种MDA-MB-231细胞于96孔板(2 500个细胞/孔)过夜;(2)加入IWR-1-endo(共设6个浓度梯度,终浓度分别为16、32、64、128、256和512 nmol/L)或DMSO(0.1%)。(3)72 h后使用10% (w/v)三氯乙酸固定,然后使用SRB染色,每组3个平行样。使用酶联免疫检测仪测定490 nm波长时的吸光度(A值),细胞增殖抑制率=[1-(实验组A值/对照组A值)]×100%。半数抑制浓度IC50使用Prism 5.0软件拟合。
1.3 裸鼠荷瘤模型建立及药物干预 将MDA-MB-231细胞悬液与Matrigel混合(体积比1∶4,细胞浓度1×107/L);所有裸鼠均于右肋侧皮下接种0.2 mL细胞加Matrigel混悬液。接种当日记为体内试验第0天。当接种瘤体体积达到150~200 mm3后,随机分为对照组和IWR-1-endo组(每组8只),各组之间瘤体体积差异均无统计学意义。参照之前预实验的结果,将IWR-1-endo溶于30%聚乙二醇(PEG400),终浓度为0.5 mg/mL。IWR-1-endo处理组腹腔注射IWR-1-endo溶液0.1 mL/10 g,每2天1次;对照组注射30%聚乙二醇0.1 mL/10 g,每2天1次;各组用药共4周。每4天1次以游标卡尺测量瘤体长径(L) 和短径(W),并计算肿瘤体积(V)=(L×W2)/2及体积抑瘤率(%)=(1-实验组瘤体平均体积/对照组瘤体平均体积)×100%;同时称量小鼠体质量。4周后,脱颈椎处死小鼠,立即收集肿瘤组织,称量瘤体质量,并计算瘤重抑瘤率(%)=(1-实验组瘤体平均质量/对照组瘤体平均质量)×100%;所取肿瘤组织一部分置于4%多聚甲醛固定液用于免疫组织化学等分析,其余组织立即置于液氮保存用于免疫印迹检测。
1.4 western blot检测相关蛋白表达 体外实验中,另设对照组和IWR-1-endo组。接种对数生长期细胞于培养皿,待细胞贴壁24 h后IWR-1-endo组加入IWR-1-endo(终浓度200 nmol /L),对照组只加入终浓度0.1%的DMSO;每组3个平行样。再培养48 h后,提取细胞总蛋白,用分光光度计进行蛋白定量。体外实验中,取处死后小鼠的肿瘤组织,提取组织总蛋白,用分光光度计进行蛋白定量。将上述提取得到的总蛋白于电泳仪上使用分离胶分离(根据所测的各组蛋白浓度调整上样量;电泳条件:75 V,75 min),转膜于PVDF膜上(转膜条件:35 V,60 min)。之后使用5%脱脂奶粉封闭1 h、加一抗室温孵育2 h,再用含0.1%Tween 20(TBS-T)洗3次(室温),之后于室温孵育二抗1 h,后用TBS-T洗3次。最后用ECL检测试剂盒发光显影,X片记录实验结果。Image-pro plus软件分析结果(以Tubulin光密度值作为内参),实验重复3次。
1.5 免疫组织化学染色 组织经4%多聚甲醛固定后,石蜡包埋,5 μm切片;切片经脱蜡至失水后放入抗原修复液中,入高压锅中加热至沸腾5 min;PBS洗后于3%过氧化氢溶液孵育15 min,除去内源性过氧化物酶;之后每张切片加50 μL正常羊血清37 ℃封闭5 min;再依次滴加一抗、二抗,DAB显色、苏木素复染。增殖指数计数:Ki-67阳性细胞着色部位为细胞核,染成棕黄色;每张切片随机选取5个400倍视野,计数该视野中阳性肿瘤细胞占所有肿瘤细胞数的比例,结果以百分数表示。
1.6 TUNEL染色 将石蜡切片常规脱蜡;将切片置于0.1 mmol/L柠檬酸缓冲液(pH 6.0)微波炉加热1 min;之后加入80 mL DD水冷却;将切片置于Tris-HCl浸泡30 min;用PBS冲洗切片2次后加50 μL TUNEL反应混合液于切片上(37 ℃孵育1 h);用PBS冲洗切片2次后加50 μL DAB底物,室温下反应1 min;用PBS冲洗切片2次后用苏木素复染。凋亡细胞的细胞核出现棕黄色或棕褐色颗粒。每张切片选择5个阳性染色最明显的高倍视野,计数凋亡细胞占肿瘤细胞总数的百分比(即细胞凋亡指数)。每组至少5个肿瘤组织的切片被用于评估凋亡指数。

2 结 果
2.1 细胞增殖抑制率 MDA-MB-231细胞活性的检测显示,IWR-1-endo可以明显抑制MDA-MB-231细胞的生长,其抑制作用呈浓度依赖型(图1)。使用Prism 5.0软件拟合标准曲线计算IC50值为180 nmol/L。因此,确定后续细胞实验中IWR-1-endo的干预浓度(终浓度)为200 nmol/L。
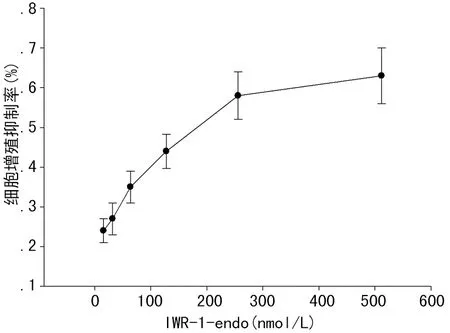
图1 IWR-1-endo对MDA-MB-231细胞增殖的抑制作用
2.2 western blot检测结果 体外实验中,相对于对照组,IWR-1-endo处理组的Axin 1和Axin 2表达量明显上升,β-catenin明显下降,而p-β-catenin上升 (图2)。在体内实验中,结果类似,相对于对照组,IWR-1-endo处理组的Axin 1和Axin 2表达量明显上升,β-catenin明显下降,而p-β-catenin上升 (图2)。

图2 在体外和体内IWR-1-endo对Axin 1,Axin 2,β-Catenin和 p-β-Catenin蛋白表达的影响
2.3 肿瘤体积测定 裸鼠荷瘤模型中对肿瘤体积的测量显示,随着时间增加,两组肿瘤体积均增加,但是对照组增加更快,IWR-1-endo组肿瘤体积增加被抑制,从第16天起,两组间的肿瘤体积差异具有统计学意义(P<0.01),见图3。IWR-1-endo的体积抑瘤率为42.2%。实验结束后对肿瘤质量的测量结果显示,IWR-1-endo组肿瘤轻于对照组,瘤重抑瘤率44.6%,差异具有统计学意义(P<0.05),见表1。

图3 肿瘤体积

A:对照组;B:IWR-1-endo组。
图4 Ki-67免疫组化染色(×400)

A:对照组;B:IWR-1-endo组。
图5 TUNEL染色(×400)
2.4 裸鼠荷瘤模型中肿瘤组织的增殖指数与凋亡指数 为了判断IWR-1-endo处理组肿瘤体积减小和增殖指数以及凋亡指数的关系,对肿瘤组织标本进行了Ki-67免疫组织化学染色(图4)和TUNEL染色(图5),并计数。与对照组比较,IWR-1-endo组的细胞增殖指数差异无统计学意义(表1),而细胞凋亡指数上升,差异有统计学意义(P<0.05)。

表1 对照组和IWR-1-endo组各项检测指标比较
3 讨 论
TNBC是乳腺癌分子分型中的一个亚型,该型乳腺癌雌激素受体(ER)、孕激素受体(PR)和人表皮生长因子受体2(Her-2)均呈阴性表达,该型约占所有乳腺癌的10%~20%。相对非TNBC,TNBC的临床预后更差[5]。TNBC的内脏转移和脑转移的发生概率更高。相对Her-2阳性组,TNBC组有更高的的复发风险和死亡率,TNBC复发时间更短,并且总生存率也更低[6]。TNBC的治疗是临床上的一个难点。常用的乳腺癌靶向治疗(激素疗法和抗Her-2治疗)对TNBC均不适用。因此,化疗仍是TNBC主要的治疗方法,目前蒽环霉素+紫杉烷方案是最适合TNBC的方案[7],但是该方案只会使一小部分TNBC患者受益,因为TNBC中只有很小一部分对化疗敏感[8],这提出了一个重要的临床挑战:这种通常预后不良的乳腺癌亚型急需新的有针对性的治疗方法。
经典的Wnt信号通路由β-catenin介导。β-catenin是Wnt信号通路的下游效应因子,β-catenin的降解受到由APC、Axin和GSK3组成的降解复合体控制。在缺乏Wnt的情况下,因为降解复合体的作用,使β-catenin被磷酸化继而被泛素酶β-TrCP泛素化而降解,因此胞质内的β-catenin保持在低水平。当Wnt配体存在的情况下,Wnt配体可以激活Wnt信号通路,进而抑制β-catenin降解复合体的活性,使β-catenin不能被磷酸化,也就保护了非磷酸化的β-catenin不被泛素酶所降解,这时β-catenin脱离降解复合体而转移进入细胞核内。在胞核内,β-catenin和转录因子LEF/TCF相互作用,引起和TCF相关的靶基因的表达(如c-Myc、cyclin D、Axin2和Nkd1)。Wnt信号通路在机体发育和维护内环境的稳定方面扮演重要的角色,然而新近发现Wnt信号通路异常在数种恶性肿瘤的发病中起重要作用。在人类肿瘤中APC的突变或截短和家族性腺瘤性息肉病有关,并且和多数结肠癌有关[9];APC的变化或者β-catenin的突变导致β-catenin的增加,上调了结肠癌中的β-catenin/TCF通路活性[10]。虽然在乳腺癌中,APC或β-catenin的突变很少,但是在动物实验中,通过过表达Wnt或稳定β-catenin而激活Wnt/β-catenin信号通路将导致乳腺肿瘤的发生[11-12]。还有研究发现,β-catenin活动的增强和乳腺癌患者拥有更差的预后有关[13]。因为Axin在Wnt信号通路中扮演限速作用[14],所以从理论上讲,通过将业已下降的Axin水平进行上调将有效抑制Wnt通路;该思路得到了Huang等[15]和Baozhi等[16]的研究结果的支持,他们发现几种小分子化合物可以在组织再生或肿瘤病变中稳定Axin而进促进β-catenin的降解,产生相应生物学变化。其中,IWR-1是一个很有效的小分子Wnt通路抑制剂。IWR-1有两种构型:IWR-1-endo和IWR-1-exo,其中IWR-1-endo的生物活性更高。IWR-1-endo的分子式为:C25H19N3O3,相对分子质量是409.44,结构式见图6。因为目前尚无将IWR-1-endo应用于乳腺癌的研究报道,又因为乳腺癌和很多结直肠癌不同,一般而言不存在APC或β-catenin的突变,主要是非磷酸化的β-catenin增加。所以,IWR-1-endo也许可以通过某种机制干预TNBC的Wnt信号通路,达到抑制肿瘤生长的目的。因此,本实验以TNBC为研究对象,在体外和体内两个层面研究经IWR-1-endo干预后的效应。

图6 IWR-1-endo结构式
本实验研究结果显示,使用IWR-1-endo体外处理MDA-MB-231细胞或体内干预MDA-MB-231细胞裸鼠荷瘤模型均可以使Axin的表达量上升(注:Axin家族有两个成员,Axin 1及Axin 2;相应基因分别定位于染色体16q13-3,17q24处。Axin 1和Axin 2在功能上是相同的),β-catenin下降,而磷酸化的β-catenin(p-β-catenin)上升。Axin的表达量上升,提示IWR-1-endo能稳定化Axin,使其含量上升。β-catenin下降,同时磷酸化的β-catenin上升,提示Axin被稳定化后,β-catenin降解复合体的稳定性也得到加强,增加了对β-catenin的磷酸化(进而使之被泛素化而降解)。上述实验结果说明了IWR-1-endo可以通过稳定化Axin而对Wnt信号通路的“核心”成员β-catenin发挥负性调节作用。为了研究IWR-1-endo对肿瘤组织的抑制是否与增加其凋亡有关,本研究进行了肿瘤组织凋亡指数检测,发现IWR-1-endo可以明显增加肿瘤细胞的凋亡,这可能是因为IWR-1-endo抑制了在三阴性乳腺癌中被过度激活的Wnt信号通路,进而导致该通路下游和细胞凋亡相关的靶基因的异常转录表达受到抑制而实现的。为了研究IWR-1-endo对肿瘤组织的抑制是否与减少其增殖有关,本研究进行了肿瘤组织增殖指数检测,发现IWR-1-endo并没有减少肿瘤组织的增殖指数,因此,IWR-1-endo似乎没有对肿瘤细胞的增殖构成影响。
综上所述,本实验证实了小分子化合物IWR-1-endo可以通过稳定化Axin而实现对Wnt信号通路的抑制,实现对TNBC细胞系及裸鼠荷瘤模型生长的抑制。这为临床探索治疗TNBC的新方法提供了新思路。但是IWR-1-endo可以实现上述目的的具体机制还有待更深入的研究。
[1]Geyer FC,Lacroix-Triki M,Savage K,et al.beta-Catenin pathway activation in breast cancer is associated with triplenegative phenotype but not with CTNNB1 mutation[J].Mod Pathol,2011,24(2):209-231.
[2]Khramtsov AI,Khramtsova GF,Tretiakova M,et al.Wnt/beta-catenin pathway activation is enriched in basal-like breast cancers and predicts poor outcome [J].Am J Pathol,2010,176(6):2911-2920.
[3]Curtin JC,Lorenzi MV.Drug discovery approaches to target Wnt signaling in cancer stem cells [J].Oncot Arget,2010,1(7):563-577.
[4]Lu J,Ma Z,Hsieh JC,et al.Structure-activity relationship studies of small-molecule inhibitors of Wnt response.Bioorg[J].Med Chem Lett,2009,19(14):3825-3827.
[5]Kennecke H,Yerushalmi R,Woods R,et al.Metastatic behavior of breast cancer subtypes [J].J Clin Oncol,2010,28(20):3271-3277.
[6]Kim JE,Ahn HJ,Ahn JH,et al.Impact of triple-negative breast cancer phenotype on prognosis in patients with stage I breast cancer[J].J Br Cancer,2012,15(2):197-202.
[7]Di Leo A,Desmedt C,Bartle J.Final results of a meta-analysis testing HER2 and topoisomerase Ⅱ alpha genes as predictors of incremental benefit from anthracyclines in breast cancer [J].J Clin Oncol,2010,28(72):519.
[8]Liedtke C,Mazouni C,Hess KR,et al.Response to neoadjuvant therapy and long-term survival in patients with triple-negative breast cancer[J].J Clin Oncol,2008,26(19):1275-1281.
[9]Kinzler KW,Vogelstein B.Lessons from hereditary colorectal cancer[J].Cell,1996,87(2):159-170.
[10]Morin PJ,Sparks AB,Korinek V,et al.Activation of beta-catenin-Tcf signaling in colon cancer by mutations in beta-catenin or APC[J].Science,1997,275(5307):1787-1790.
[11]Prosperi JR,Goss KHA.A Wnt-ow of opportunity:targeting the Wnt/betacatenin pathway in breast cancer[J].Curr Drug Targets,2010,11(9):1074-1088.
[12]Turashvili G,Bouchal J,Burkadze G,et al.Wnt signaling pathway in mammary gland development and carcinogenesis[J].Pathobiology,2006,73(5):213-223.
[13]Michaelson JS,Leder P.Beta-catenin is a downstream effector of Wnt mediated tumorigenesis in the mammary gland[J].Oncogene,2001,20(37):5093-5099.
[14]Lee E,Salic A,Kruger R,et al.The roles of APC and Axin derived from experimental and theoretical analysis of the Wnt pathway[J].PLoS Biol,2003,1(1):E10.
[15]Huang SM,Mishina YM,Liu S,et al.Tankyrase inhibition stabilizes axin and antagonizes Wnt signalling[J].Nature,2009,461(7264):614-620.
[16]Chen B,Dodge ME,Tang W,et al.Small moleculemediated disruption of Wnt-dependent signaling in tissue regeneration and cancer[J].Nat Chem Biol,2009,5(2):100-107.
Study on inhibitory effect of IWR-1-endo to triple negative breast cancer*
JiangYan1,CaoYixin2,ZhangCuiwei3,ZhangXu3△
(1.DepartmentofCardioencephalology,AffiliatedHospitalofTraditionalChineseMedicine,LuzhouMedicalCollege,Luzhou,Sichuan646000,China;2.TeachingandResearchingSectionofHistologyandEmbryology,LuzhouMedicalCollege,Luzhou,Sichuan646000,China;3.DepartmentofPathology,AffiliatedHospitalofLuzhouMedicalCollege,Luzhou,Sichuan646000,China)
ObjectiveTo investigate whether IWR-1-endo,a newly discovered small molecule inhibitor of Wnt signaling pathway,can suppress the proliferation of triple negative breast cancer cells MDA-MB-231 and nude mice tumor-bearing model and its relative potential mechanism.MethodsMDA-MB-231 cells were treated by different concentrations of IWR-1-endo,and the cellular proliferation inhibition rate was calculated.The nude mice tumor-bearing model was constructed by intraperitoneal injection of IWR-1-endo (0.1 mL/10 g,once per 2 d).The long and short diameters of tumor were measured once every 4 d,in order to calculate the tumor volume.Mice were sacrificed after 4 weeks to collect tumor tissue for measuring and calculating the suppression rate of volume and weight.The tumor tissue was made into the paraffin sections for conducting Ki-67 staining and TUNEL staining.The proliferative index and apoptotic index were calculated.The expression of Axin 1,Axin 2,β-catenin and p-β-catenin protein was detected by Western blot.ResultsIWR-1-endo could obviously inhibit the growth of MDA-MB-231 cells in a concentration-dependent manor (IC50 value was 180 nmol/ L).The tumor volume suppression rate of IWR-1-endo was 42.2% and its tumor weight suppression rate was 46.6%.Compared with the control group,the apoptotic index in the IWR-1-endo group was significantly increased,the difference was statistically significant,while the difference of proliferative index had no statistical significance.The Western blot results showed that the expression amount of Axin 1 and Axin 2 in the cells and tissues was significantly increased,the β-catenin expression was obviously decreased,while the β-catenin level was reduced and the p-β-catenin level was increased.ConclusionIWR-1-endo can inhibit the Wnt signal pathway by stabilizing Axin,and realize the inhibition on TNBC cell line and growth of nude mice tumor-bearing model.
breast neoplasms;wnt proteins;IWR-1-endo
10.3969/j.issn.1671-8348.2015.26.002
四川省卫生厅项目(80173);泸州医学院项目(2010108)。
:江燕(1985-),硕士,主治医师,主要从事心血管方面的研究。△
,E-mail:48839602@qq.com。
R737.9
A
1671-8348(2015)26-3605-04
2015-03-18
2015-07-16)



