陈海兰,高 宇,葛晓春,李丽慧,王英南,刘晓燕,李桂芳
(承德医学院附属医院内分泌科,河北承德 067000)
·经验交流·
2型糖尿病合并非酒精性脂肪肝围绝经期女性血浆ox-LDL的研究*
陈海兰,高 宇△,葛晓春,李丽慧,王英南,刘晓燕,李桂芳
(承德医学院附属医院内分泌科,河北承德 067000)
目的研究2型糖尿病合并非酒精性脂肪肝(T2DM+NAFLD)围绝经期女性血浆氧化低密度脂蛋白(ox-LDL)水平及相关因素分析。方法选择2013年9月至2014年2月住院的年龄45~60岁围绝经期女性,其中T2DM患者50例,T2DM+NAFLD患者41例,及来自同期体检中心围绝经期女性健康对照(NC)者40例,检测血ox-LDL水平及血糖、血脂、肝功能和肾功能等指标,并分析ox-LDL与各项指标的相关性。结果围绝经期T2DM+NAFLD患者ox-LDL、三酰甘油(TG)、低密度脂蛋白胆固醇(LDL-C)、体质量指数(BMI)、尿酸(UA)和丙氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST)、γ-谷氨酰转肽酶(γ-GT)明显高于T2DM患者及NC者,而高密度脂蛋白(HDL-C)水平明显较低(P<0.05)。多元逐步回归分析显示,TG、HDL-c、UA是ox-LDL水平的独立相关因素(P<0.05)。结论T2DM+NAFLD的围绝经期女性患者血浆ox-LDL升高,提示氧化应激可能是围绝经期T2DM+NAFLD的重要病理生理因素。
围绝经期;2型糖尿病;非酒精性脂肪肝病;氧化低密度脂蛋白
流行病学资料显示,有34%~74%的2型糖尿病患者合并非酒精性脂肪肝(T2DM+NAFLD)[1]。T2DM+NAFLD患者较单纯T2DM具有较高的心血管病死率及发生肝硬化风险[2]。研究显示,围绝经期女性45岁之后脂肪肝发生明显增加,具体机制不明[3]。氧化低密度脂蛋白(ox-LDL)通过诱导激活肝脏的Kupffer细胞而导致脂肪肝的形成[4]。本课题通过研究围绝经期女性T2DM+NALFD患者ox-LDL的水平,探讨其在T2DM围绝经期女性脂肪肝发生中的作用及相关影响因素。
1 资料与方法
1.1 一般资料 选取2013年9月至2014年2月在本院内分泌科住院的女性T2DM患者91例为研究对象,均符合1999年WHO糖尿病诊断标准。根据2010年《非酒精性脂肪性肝病诊疗指南》[5]进一步分为T2DM组50例,T2DM+NAFLD组41例。另选本院同期健康体检者40例作为健康对照(NC)组。排除标准:1型糖尿病、严重的DM急慢性并发症;急性感染期、肿瘤等患者;伴有病毒性、酒精性、自身免疫性、遗传性及药物性肝病;胆道梗阻性疾病。本研究方案经本院医学伦理委员会批准。所有患者均签署知情同意书。
1.2 研究方法 所有患者采血前1天均未高脂饮食及饮酒,所有血样均为患者禁食12 h后隔夜空腹血2份,一份在4 ℃ 3 000 r/min离心10 min,分离血清,于-80 ℃冰箱保存,待标本留齐后采用ELISA法成批检测ox-LDL(上海美轩生物科技公司)。一份在日立7600全自动生化分析仪上检测血脂:三酰甘油(TG)、总胆固醇(TC)、低密度脂蛋白(LDL-C)、高密度脂蛋白(HDL-C)、空腹血糖(FBG)、糖化血红蛋白(HbA1C)、丙氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST)、γ-谷氨酰转肽酶(γ-GGT)、血尿酸(UA)。记录体质量指数(BMI)。血压测定:坐位血压,均为2次间隔5 min的平均血压值,并且2次血压测定均在相同的情况下进行。所有患者均于本院彩超室经专人行腹部彩超检查(美国GE彩超仪)。
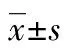
2 结 果
2.1 3组患者的临床及检验指标比较 3组年龄、收缩压(SBP)比较,差异无统计学意义(P>0.05)。NC、T2DM和T2DM+NAFLD组的TG、LDL-c、ALT、ox-LDL有逐渐升高趋势,HDL-c有下降趋势,差异有统计学意义(P<0.05)。与NC组相比,T2DM组具有较高的TG、LDL-c、DBP、HbA1C、FBG、ALT、ox-LDL水平及较低的HDL-c水平,差异有统计学意义(P<0.05);T2DM+NAFLD组具有较高的TG、LDL-c、DBP、BMI、HbA1C、FBG、ALT、AST、γ-GT、UA、ox-LDL水平及较低的HDL-c水平,差异有统计学意义(P<0.05);与T2DM组相比,T2DM+NAFLD组具有较高的TG、TC、LDL-c、BMI、AST、ALT、γ-GT、UA、ox-LDL水平及较低的HDL-c水平,差异有统计学意义(P<0.05)。见表1。
2.2 ox-LDL与相关指标的相关分析 血清ox-LDL与TG、BMI、AST、ALT、γ-GT、UA呈正相关(r=0.564,P<0.05;r=0.386,P<0.01;r=0.276,P=0.01;r=0.405,P<0.01;r=0.389,P<0.01;r=0.772,P<0.01),与HDL-C呈负相关(r=-0.404,P<0.01)。
表1 各组患者的临床资料及生化指标比较
2.3 ox-LDL与相关指标的多元逐步回归分析 以ox-LDL为因变量,以TG、TC、HDL-C、LDL-C、DBP、SBP、BMI、HbA1C、FBG、AST、ALT、γ-GT、UA为自变量,行多元逐步回归分析得出,TG、UA与ox-LDL呈独立正相关,HDL-c与ox-LDL呈独立负相关(P<0.05)。见表2。
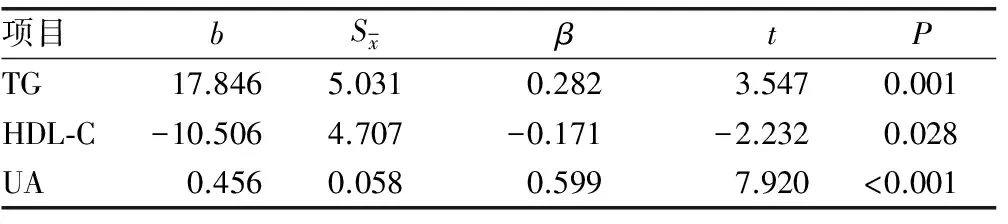
表2 ox-LDL与相关指标的多元逐步回归分析
3 讨 论
NAFLD是由非酒精或明确肝损伤因素引起的肝细胞脂肪变性为主要特征的临床病理综合征。ox-LDL是被氧化的LDL,证据表明ox-LDL参与高糖和肥胖相关的炎症过程,不仅在动脉粥样硬化和冠心病发生中起重要作用,而且参与脂肪肝形成[6-7]。本课题研究结果发现围绝经期T2DM及T2DM+NAFLD组较NC组具有显着升高的ox-LDL水平,与单纯T2DM组相比,T2DM+NAFLD组ox-LDL升高,差异有统计学意义(P<0.05),与以上文献结果相似。ox-LDL的体内代谢需借助清道夫受体,ox-LDL结合肝脏Kupffer细胞上的清道夫受体的同时刺激了大量氧自由基产生及诱导单核细胞进入肝脏,导致肝脏中脂质过氧化及炎性反应的发生,最终导致NAFLD的发生[6]。在Kashyap等[8]的研究证实循环中ox-LDL水平与肝组织炎性反应和胰岛素抵抗存在密切的相关性。在Bieghs等[7]的研究中通过减少非酒精性脂肪性肝炎大鼠体内ox-LDL水平,肝脏炎性反应显着降低,使肝脏Kupffer细胞变小且含有少量的胆固醇结晶,再次证实了ox-LDL参与NAFLD的病理学改变过程。女性非DM NAFLD患者ox-LDL随着年龄的增加而增加,Torres等[9]的研究显示,40~49岁及绝经后高发,提示了雌激素可能在NAFLD的病理过程中起一定的作用,并且给予雌激素替代治疗,绝经后女性ox-LDL升高。伴有T2DM的围绝经期NAFLD患者ox-LDL降低是否与雌激素减少有关,有待进一步研究。
胰岛素抵抗(insulin resistance,IR)是T2DM的主要特点,IR导致大量的脂肪组织分解产生大量的游离脂肪酸,最终导致体内出现高TG、LDL-C及低HDL-C血症。在本实验结果中,围绝经期女性T2DM+NAFLD及T2DM组较NC组具有较高的TG、LDL-C及较低HDL-C水平,符合T2DM的血脂紊乱特点。与T2DM组相比,T2DM+NAFLD组改变更显着,差异有统计学意义(P<0.05)。糖尿病患者普遍存在NAFLD,并且越来越多的证据表明与IR有关的血脂紊乱在NAFLD的发病机制中起始动、关键的作用[10]。高胰岛素血症和IR导致脂酶活性降低促进肝脏合成TG和极低密度脂蛋白(VLDL),当肝中合成TG的速度超过了将其组成VLDL并分泌入血的速度时,便出现肝中TG的堆积,形成脂肪肝。国外进一步研究发现,围绝经期及绝经后妇女雌二醇(E2)水平显着低于育龄期妇女,而E2与TC水平呈负相关,证实了绝经后妇女更易出现明显的血脂紊乱和IR,围绝经期T2DM及NAFLD的患者的血脂紊乱是否与雌激素有关,需深入研究。
脂肪肝患者常伴有氨基转移酶(AST、ALT、γ-GT等)水平升高,特别是伴有IR的肥胖或T2DM患者,有研究证实高转氨酶水平是由于肝脏脂肪堆积所致[11]。在本研究中,与T2DM及NC组相比,围绝经期T2DM+NAFLD组具有较高的BMI、AST、ALT、γ-GT水平,揭示体质量增加致肝内脂肪沉积,可能是围绝经期T2DM+NAFLD转氨酶升高的机制之一。目前,氨基转移酶水平被认为是肝内脂肪的间接观测指标,且研究证实AST、ALT、γ-GT水平的下降伴有肝内脂肪含量的降低[12]。国外研究[13]显示绝经后T2DM患者应用小剂量激素替代治疗(HRT)可以明显降低脂肪肝患者氨基转移酶水平(AST、ALT、r-GGT等)。小剂量HRT能否用于围绝经期T2DM合并NAFLD的治疗尚待进一步临床证实。
研究证实,在非肥胖绝经后女性中,随着UA水平的升高,脂肪肝的发生率也逐渐升高[14]。本研究结果中,围绝经期女性T2DM+NAFLD组较T2DM及NC组具有显着升高的UA水平,也提示了高UA对NALFD的发生起一定的作用。在Tang等[15]的研究中证实了高UA与IR存在正相关。IR降低UA盐从肾脏排泄,同时增强肾小管对UA盐的重吸收。但也有研究报道,T2DM患者血糖很高(血糖大于10 mmol/L)时血UA水平可能较低,因为通过渗透性利尿可以促进UA的排泄。通过多元逐步回归分析得出,TG、HDL-c、UA与ox-LDL独立相关。已证实,UA能有效的抑制NO的有效利用,增加氧自由基的产生,导致氧化产物的生成,且进一步加重胰腺β细胞的功能[16]。本试验研究结果表明围绝经期女性在高血糖的基础上,血脂异常(高TG、低HDL)、HUA可能与ox-LDL升高有关,促使NAFLD的发生。
总之,围绝经期女性T2DM患者体内ox-LDL水平显着升高,提示氧化应激可能是围绝经期T2DM NAFLD的重要病理生理因素。建议在降糖的基础上,早期积极的调脂、降UA治疗可能起到预防及降低围绝经期女性T2DM发生NAFLD的风险。
[1]Younossi ZM,Stepanova M,Afendy M,et al.Changes in the prevalence of the most common causes of chronic liver diseases in the United States from 1988 to 2008[J].Clin Gastroenterol Hepatol,2011,9(6):524-530.
[2] Masuoka HC,Chalasani N.Nonalcoholic fatty liver disease:an emerging threat to obese and diabetic individuals[J].Ann N Y Acad Sci,2013,1281:106-122.
[3]李葳,江倔,夏国光,等.脂肪肝高脂血症的年龄性别因素与胰岛素抵抗的关系探讨[J].中国全科医学杂志,2000,3(5):355-356.
[4]Walenbergh SM,Koek GH,Bieghs V,et al.Non-alcoholic steatohepatitis:the role of oxidized low-density lipoproteins[J].J Hepatol,2013,58(4):801-810.
[5]中华医学会肝病学分会脂肪肝和酒精性肝病学组.非酒精性脂肪性肝病诊疗指南(2010年修订版)[J].中华肝脏病杂志,2010,3:163-166.
[6]Gambino R,Musso G,Cassader M.Redox balance in the pathogenesis of nonalcoholic fatty liver disease:mechanisms and therapeutic opportunities[J].Antioxid Redox Signal,2011,15(5):1325-1365.
[7]Bieghs V,Van Gorp PJ,Walenbergh SM,et al.Specific immunization strategies against oxidized low-density lipoprotein:a novel way to reduce nonalcoholic steatohepatitis in mice[J].Hepatology,2012,56(3):894-903.
[8]Kashyap SR,Ioachimescu AG,Gornik HL,et al.Lipid-induced insulin resistance is associated with increased monocyte expression of scavenger receptor CD36 and internalization of oxidized LDL[J].Obesity(Silver Spring),2009,17(12):2142-2148.
[9]Torres DM,Williams CD,Harrison SA.Features,diagnosis,and treatment of nonalcoholic fatty liver disease[J].Clin Gastroenterol Hepatol,2012,10(8):837-858.
[10]Bugianesi E,Moscatiello S,Ciaravella MF,et al.Insulin resistance in nonalcoholic fatty liver disease[J].Curr Pharm Des,2010,16(17):1941-1951.
[11]Sattar N,Scherbakova O,Ford I,et al.Elevated alanine aminotransferase predicts new-onset type 2 diabetes independently of classical risk factors,metabolic syndrome,and C-reactive protein in the West of Scotland coronary prevention study[J].Diabetes,2004,53(11):2855-2860.
[12]Mckenzie J,Jaap AJ,Gallacher S,et al.Metabolic,inflammatory and haemostatic effects of a low-dose continuous combined HRT in women with type 2 diabetes:potentially safer with respect to vascular risk[J].Clin Endocrinol (Oxf),2003,59(6):682-689.
[13]Mckenzie J,Fisher BM,Jaap AJ,et al.Effects of HRT on liver enzyme levels in women with type 2 diabetes:a randomized placebo-controlled trial[J].Clin Endocrinol (Oxf),2006,65(1):40-44.
[14]Liu PJ,Ma F,Lou HP,et al.Relationship between serum uric acid levels and hepatic steatosis in non-obese postmenopausal women[J].Climacteric,2014,17(6):692-699.
[15]Tang W,Fu Q,Zhang Q,et al.The association between serum uric acid and residual β-Cell function in type 2 diabetes[J].J Diabetes Res,2014,2014:709691.
[16]Zhang Y,Yamamoto T,Hisatome I,et al.Uric acid induces oxidative stress and growth inhibition by activating adenosine monophosphate-activated protein kinase and extracellular signal-regulated kinase signal pathways in pancreatic β cells[J].Mol Cell Endocrinol,2013,375(1/2):89-96.
10.3969/j.issn.1671-8348.2015.27.023
河北省卫生厅科研基金项目(20130022)。
:陈海兰(1980-),在读硕士,主治医师,主要从事内分泌与代谢性疾病研究。△
,E-mail:yugao815@163.com。
R587;R575
B
1671-8348(2015)27-3816-03
2015-03-18
2015-06-16)



