尹运堂,龚 放△,余加林,王 燕
(1.重庆医科大学附属永川医院儿科 402160;2.重庆医科大学附属儿童医院新生儿诊治中心 400014)
新生儿败血症是影响早产儿和足月儿发病率和病死率的主要原因之一[1],起病过程隐匿,临床表现不典型[2],疾病进展快,因此早期诊断确诊有利于新生儿败血症的及时有效的治疗。血培养作为诊断的金标准[3],培养时间长、阳性率低等缺陷,而与诊断败血症的实验室诊断指标大多处于研究阶段[4]。本文根据目前临床现有的血常规、C-反应蛋白(C-reactive protein,CRP)和降钙素原(procalcitonin,PCT)等检查,探讨联合多项非特异性指标对新生儿败血症的诊断价值。
1 资料与方法
1.1 一般资料 查阅2013年1月至2014年5月重庆医科大学附属儿童医院新生儿诊疗中心的电子病历,入院时怀疑新生儿败血症共546例,剔除标本污染16例,入院前已使用抗菌药物、入院后未行血培养及数据不全117例,纳入剩余的413例。根据2003年《关于新生儿败血症诊疗方案》标准[3],对纳入的病例进行分组,确诊败血症组95例和临床诊断败血症组158例;非败血症组160例纳入要求是,血培养结果阴性,可伴有高危因素、非特异性临床表现或至多一项实验室指标异常,且出院时排除败血症诊断。
1.2 方法 患儿使用抗菌药物之前,无菌操作抽取静脉血约1mL,全自动血液培养仪、全自动细菌鉴定仪行血培养;入院12h内行血常规检查;I/T 采用显微镜人工分类;CRP 采用金标定量检测法;PCT 采用双抗夹心免疫荧光法。各项指标的界值参考文献[3]。
1.3 统计学处理 采用SPSS20.0统计软件进行分析,计量资料以±s表示,两组间比较采用t检验,3组之间比较采用LSD单因素方差分析,计数资料以率表示,比较采用χ2检验,P<0.05为差异有统计学意义。以血培养结果为金标准绘制ROC曲线,并计算曲线下面积(AUC)。
2 结 果
2.1 一般资料 413例新生儿中男女性别比为1.72∶1.00(261/152),平均胎龄(37.24±2.87)周,平均出生体质量(2 961±674.32)g,平均住院时间(10.83±8.69)d,平均日龄(5.67±6.76)d。≤3d者225例,WBC<5×109/L 有17例;>3天者188例,WBC<5×109/L 有15例。败血症组与非败血症组比较,性别比、胎龄、出生体质量差异无统计学意义(P>0.05),而日龄、住院时间差异有统计学意义(P<0.05),见表1。血培养阳性检出率为23.0%,其中凝固酶阴性葡萄球菌31例,肺炎克雷伯菌肺炎亚种18例,大肠埃希菌16例,B组溶血性链球菌7例,肠屎球菌4例,近平滑假丝酵母菌6例,假丝酵母菌3例,金黄色葡菌2例,见图1。
2.2 各组非特异性指标比较 见表2。
2.3 PCT、CRP、WBC、PLT、I/T 5项指标的AUC 比较 以血培养为金标准绘制5 项指标的ROC 曲线,计算AUC 及95%CI。与参考线下面积0.5相比,AUC 差异均有统计学意义(P<0.05),其中PCT 的最大。见图2、表3。

图1 血培养阳性结果分布图

表1 各组临床资料比较
表2 各组非特异性指标比较(±s)

表2 各组非特异性指标比较(±s)
*:P<0.05,与非败血症组比较。
组别 WBC(×109/L)PLT(×109/L)HB(g/L)HCT(%) I/T L(%) M(%) CRP(mg/L)PCT(ng/mL)确诊组 23.9±12.9* 224.4±139.5* 149.3±24.5 44.3±8.4 0.117±0.127* 26.3±12.5 4.1±2.0 15.8±12.9* 7.34±7.55*临床诊断组 21.4±12.8* 198.8±137.2* 147.0±29.5 43.6±9.7 0.148±0.142* 26.8±13.1 3.9±1.8 11.8±7.1* 7.50±7.17*非败血症组 12.4±3.9 293.9±103.7 147.4±25.5 43.9±7.4 0.077±0.016 35.0±15.9 4.4±2.3 8.4±1.1 0.40±0.46 F 47.251 23.829 0.218 0.223 17.272 17.355 1.773 21.672 75.222 P 0.000 0.000 0.804 0.800 0.000 0.000 0.171 0.00 0 0.000
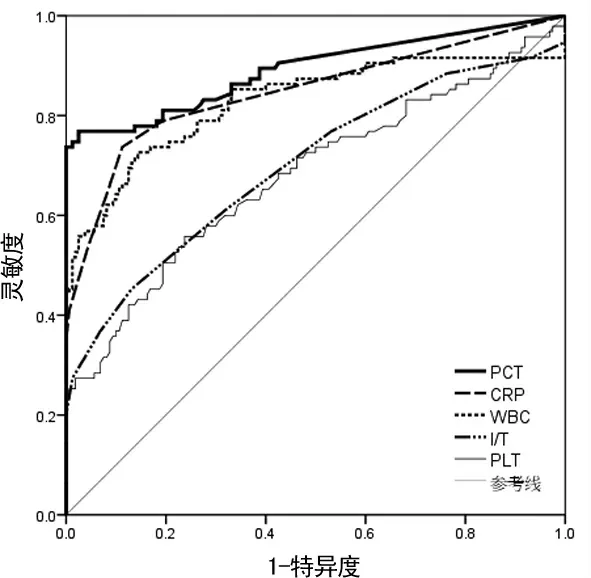
图2 5项指标对新生儿败血症诊断的ROC曲线图
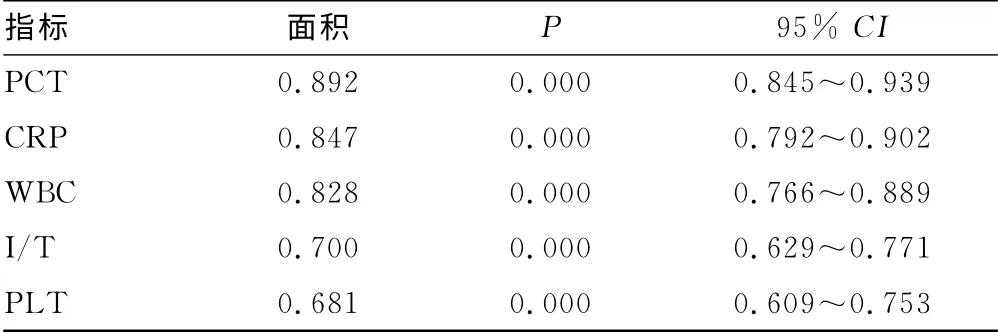
表3 5项指标对新生儿败血症诊断的AUC
2.4 PCT、CRP、WBC、PLT、I/T 5项指标诊断新生儿败血症的阳性率比较 5项指标在确诊组与非败血症组的符合诊断界值的阳性率,差异均有统计学意义(P<0.05),见表4。
2.5 PCT、CRP、WBC、PLT、I/T 5项指标的诊断试验评价 分析各项指标单独诊断新生儿败血症的灵敏度、特异度、阳性预测值、阴性预测值及约登指数,见表5。
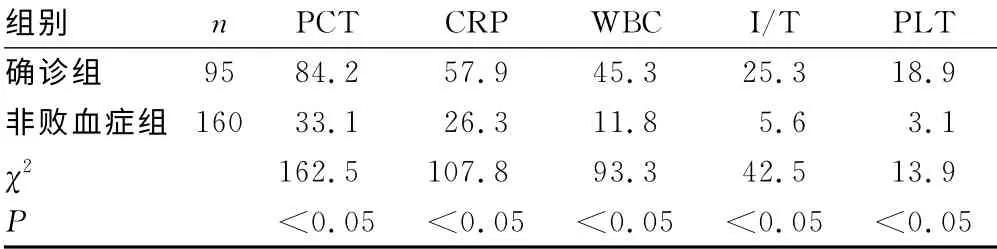
表4 5项指标在确诊组与非败血症组 阳性率比较(%)
2.6 二元Logistic回归分析 将5项指标PCT、CRP、WBC、PLT、I/T 作为参数,进行多参数的二元Logistic回归分析,得到回归拟合结果,可见回归方程中PLT、I/T 两个参数的系数为零的可能性很大(P>0.05),认为其诊断效率不高,剔除后对剩下3 个参数进行回归分析。由表7可建立回归方程:ln进行指数变换得:
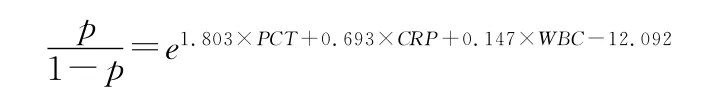
回归预测值的AUC 大于PCT 的AUC,差异有统计学意义(P<0.05),联合3个变量的AUC 为0.974,其诊断的灵敏度和特异度分别为94.7%和87.5%。见表6、7,图3。
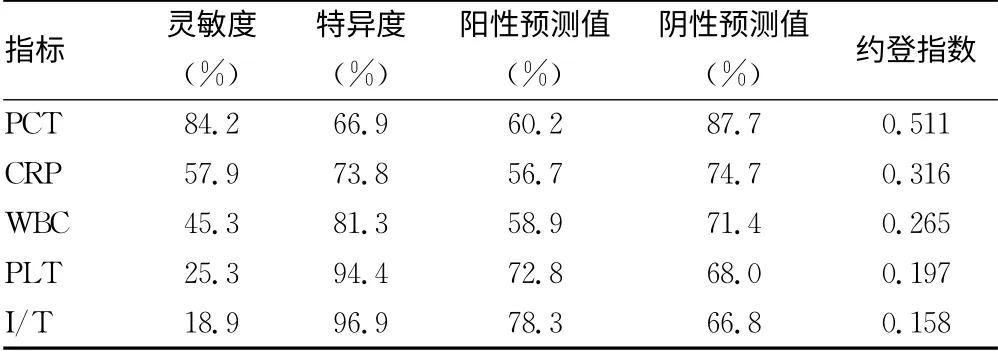
表5 5项指标对新生儿败血症的诊断试验评价

表6 5项指标参数的二元Logistic回归结果
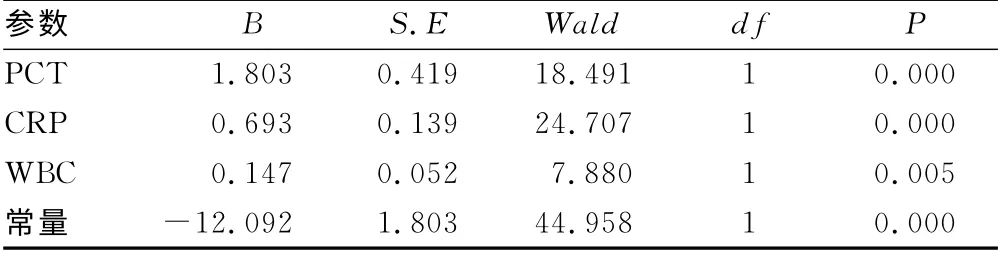
表7 3项指标参数的二元Logistic回归结果

图3 PCT 及3项指标参数Logistic回归后的ROC曲线
3 讨 论
作为诊断新生儿败血症的“金标准”,血培养存在一些不足之处,(1)培养时间较长;(2)阳性率不高,本研究血培养阳性检出率为23.0%,与肖甜甜等[5]观察到的血培养阳性率25.7%均较低;(3)存在假阴性[6]、假阳性[7]检验误差;(4)新生儿采血困难,导致标本含量达不到培养要求。因此,临床上需要结合其他实验室检查指标来弥补“金标准”的缺陷。
血常规是临床上的常规检查之一。50%败血症新生儿血常规可有至少1项指标异常[8]。根据新生儿败血症实验室检查诊断界值[3],确诊组与非败血症组中,WBC、I/T、PLT、CRP、PCT 5 项指标的阳性率差异均有统计学意义(P<0.05),表明与败血症密切相关。通过诊断试验评价,WBC、I/T、PLT、CRP单独作为诊断新生儿败血症的灵敏度均偏低(<60%),说明该4项指标有一定的局限性,主要表现为:(1)有研究[9]指出WBC单项指标可能不适合诊断新生儿败血症,因为近一半的败血症患儿WBC 计数在正常范围,而WBC 异常并不都是由败血症引起。(2)与WBC相比,I/T 的临床诊断价值较好。以I/T>0.2 作为诊断界值,其灵敏度为60% ~80%[10],与本研究灵敏度18.9%相差较大,这与检验人员专业素质及主观因素密切相关,故误差较大。(3)Mavrommatis等[11]指出35%~59%新生儿败血症患儿PLT 减少。有文献报道新生儿重症监护病房中发生PLT 减少的发生率为22%,原因可能为血症、呼吸窘迫综合征、窒息等[12],非感染性疾病也会出现PLT 减少。(4)细菌感染后12~24h检测CRP出现升高,2~3d可达峰值,如果感染得到有效控制会迅速下降。但是,CRP升高也常见于急性损伤、炎性反应等非感染因素,健康新生儿出生后也可出现暂时性、生理性升高。对疑似败血症患儿应密切随访,新生儿出生48h后CRP持续性升高才提示细菌感染[13]。
PCT 诊断败血症的AUC 为0.892,灵敏度为84.2%,而特异度较低,若单独使用PCT 诊断新生儿败血症,其漏诊率低,但误诊率高。若分别单独使用WBC、I/T、PLT 作为诊断指标,其漏诊率高,但此4项指标特异度均较好,提示其误诊率相对低。可见PCT 诊断价值恰好与血常规互补,故可以探讨联合多项指标的诊断价值。本研究采用多参数二元Logistic回归分析,获得预测概率或联合预测因子后得到的AUC 明显增加,其灵敏度和特异度分别为为94.7%和87.5%。通过联合PCT、CRP、WBC进行Logistic回归分析,弥补了单项指标灵敏度低的缺点,增加了非特异性指标的诊断准确性,同时提高了灵敏度和特异度。
为了寻找有效、可靠、准确的诊断方法,国内外开展了大量关于新生儿败血症实验室检查指标研究,然而更理想的指标应用于临床还需较长时间。本研究通过诊断指标评价及二元Logistic回归分析表明,WBC、I/T、PLT、CRP、PCT 仍可作为早期诊断新生儿败血症的实验室检查,由于各指标异常的出现时间不同、动态变化及灵敏度和特异度的差异,联合PCT、CRP、WBC可以充分利用诊断价值,较好的规避了各自的不足之处,互相补充,提高了诊断的灵敏度和特异度,有助于新生儿败血症的早期诊断。
[1] Camacho-Gonzalez A,Spearman PW,Stoll BJ.Neonatal infectious diseases:evaluation of neonatal sepsis[J].Pediatr Clin North Am,2013,60(4):367-389.
[2] Gerdes JS.Diagnosis and management of bacterial infections in the neonate[J].Pediatr Clin North Am,2004,51(11):939-959.
[3] 中华医学会儿科学分会新生儿学组.新生儿败血症诊疗方案[J].中华儿科杂志,2003,12(1):19-21.
[4] Prucha M,Bellingan G,Zazula R.Sepsis biomarkers[J].Clin Chim Acta,2015,440(2):97-103.
[5] 肖甜甜,王欣宁,余加林.新生儿败血症非特异性指标的诊断价值评价[J].儿科药学杂志,2010,16(3):9-12.
[6] Fischer JE,Seifarth FG,Baenziger O,et al.Hindsight judgement on amboguous episodes of suspected infection in critically ill children[J].Eur J Pediatr,2003,16(20):840-843.
[7] Sabui T,Panero A,Osborn JF,et al.Diagnosis of neonatal sepsis:a clinical and laboratory challenge[J].Clin Chemi,2004,50(2):211-215.
[8] Manzoni P,Mostert M,Galleao P,et al.Is thrombocytopenia suggestive of organism-specific response in neonatal sepsis[J].Pediatr Int,2009,52(2):206-210.
[9] Berger C,Uehlinger J,Gllelfi D,et al.Comparison of C-reactive protein and white blood cell count with differential in neonates at risk for septicaemia[J].Eur J Pediatr,1995,154(2):138-144.
[10] Griffin MP,Morman JR.Toward the early diagnosis of neonatal sepsis and sepsis-like illness using novel heart rate analysis[J].Pediatrics,2001,107(1):97-104.
[11] Mavrommatis AC,Theodofidis T,Orfanidou A,et al.Coagulation system and platelets are fully activated in un-complicated sepsis[J].Chil Care Med,2000,28(6):451-457.
[12] Aird WC.The hematologic system as a marker of organ dysfunction in sepsis[J].Mayo Clin Proc,2003,78(6):869-881.
[13] 余加林.新生儿败血症的诊断和治疗[J].实用儿科临床杂 志,2005,20(2):100-102.



