江丽霞,朱亚飞,胡 蓉,何 华,陈晓红,李 峰
(赣南医学院第一附属医院检验科,江西赣州 341000)
论着·临床研究
赣州人群血清HE4参考区间的探讨及其临床诊断效能的评价*
江丽霞,朱亚飞,胡 蓉,何 华,陈晓红,李 峰
(赣南医学院第一附属医院检验科,江西赣州 341000)
目的 探讨赣州人群血清人附睾上皮分泌蛋白4(HE4)的参考区间,分析该参考区间在卵巢癌中的临床诊断效能。方法选取2013年1月至2014年12月期间在该院各项体检指标均正常的728例表面健康女性作为参考人群组,并选择同期住院治疗的80例卵巢恶性肿瘤患者、80例卵巢良性肿瘤患者作为病例研究组,采用罗氏电化学发光法测定研究对象血清HE4水平,分析参考人群中血清HE4水平的分布情况,计算血清HE4的参考区间,评价该参考区间在卵巢癌中的临床诊断效能。结果728例女性参考人群血清HE4平均水平为(52.04±10.83)pmol/L,40岁以上各年龄组与40岁以下各年龄组间比较,差异有统计学意义(P=0.000),而40岁以上各年龄组间及40岁以下各年龄组间比较,差异无统计学意义(P>0.05);血清HE4水平参考区间为小于40岁时,<70.42 pmol/L,≥40岁时,<82.16 pmol/L,均明显低于罗氏公司试剂说明书中推荐的小于140 pmol/L的参考区间,但其在卵巢癌中的临床诊断灵敏度、阴性预测值、Youden′s指数均有明显提高(P<0.05),而临床诊断特异度、阳性预测值、准确度无明显变化(P>0.05)。结论赣州人群中血清HE4的参考区间明显低于罗氏试剂说明书推荐的参考区间,利用该研究所得的参考区间,明显提高了血清HE4在卵巢癌中的临床诊断效能。
卵巢肿瘤;血清;人附睾蛋白4;参考区间;临床诊断
卵巢癌发病隐匿,75%的卵巢癌患者发现时已属晚期,预后差,5年生存率不到30%,早期诊断卵巢癌是提高患者生存率的关键因素之一。目前,临床公认的上皮性卵巢癌血清学最佳标志物为糖类抗原125(CA125),在诊断预后中有重要意义,但CA125存在假阳性高、诊断早期卵巢癌的敏感性和特异性低的局限,限制了其作为卵巢癌标志物的临床应用[1],血清人附睾上皮分泌蛋白4(HE4)是一种较新的卵巢癌肿瘤标志物,特异性明显高于CA125,是较公认的筛查和早期诊断、鉴别诊断卵巢癌的有力工具[2-3]。但由于受种族、地域、检测方法等影响,使血清HE4至今未有明确的参考区间。
1 资料与方法
1.1 一般资料 选自2013年1月至2014年12月于赣南医学院第一附属医院进行全面体检的表面健康女性作为血清HE4水平参考区间研究的参考人群,根据体格检查、实验室检查(包括血液生化指标、肿瘤标志物、血细胞分析、尿液分析、粪便常规)、胸部平片检查、腹部超声检查及妇科内诊等检查,确定所选对象为无内科疾病以及妇科良恶性疾病的表面健康人群。纳入研究的728例女性,年龄20~80岁,平均43.82岁。以每10岁为一个年龄段,进行年龄分组,其中,20~29岁组138例,30~39岁组168例,40~49岁组170例,50~59岁组134例,≥60岁组118例。病例研究组选自同期在本院妇科住院手术治疗并经病理检查确诊的160例卵巢肿瘤患者,其中,卵巢恶性肿瘤患者80例,年龄29~70岁,平均48.5岁;卵巢良性肿瘤患者80例,年龄23~70岁,平均47.5岁,包括卵巢子宫内膜异位囊肿30例,卵巢畸胎瘤30例,黏液性和浆液性囊腺瘤20例。所有研究对象均取得其知情同意。
1.2 方法 所有研究对象均于清晨空腹静脉采血3 mL,其中,病例组采血前均未经化疗、放疗、手术等治疗。采血后及时分离血清,电化学发光法检测血清HE4水平,检测仪器为德国罗氏公司生产的全自动电化学发光仪,仪器型号为Cobas E601,试剂、校准品和质控品均为罗氏公司原装配套产品。
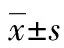
2 结 果
2.1 血清HE4水平在女性参考人群中不同年龄段的分布情况分析 经K-S正态性检验,728例女性参考人群血清HE4水平呈正态分布,Dixon检验未发现明显离群值,728例女性HE4平均水平为(52.04±10.83)pmol/L,随着年龄段的增加,各年龄段血清HE4的水平也随之升高,差异有统计学意义(F=20.80,P=0.000);40岁以上各年龄组与40岁以下各年龄组间比较,差异有统计学意义(P=0.000);40岁以上各年龄组间及40岁以下各年龄组间比较,差异无统计学意义(P>0.05),见表1。
表1 女性血清HE4水平在不同年龄段中的分布情况比较
2.2 血清HE4水平参考区间分析 根据血清HE4水平在女性参考人群中不同年龄段的分布情况分析,提示40~49岁是血清HE4水平在不同年龄段的重要分界点,而且40岁以上各年龄组之间及40岁以下各年龄组之间血清HE4水平比较,差异无统计学意义(P>0.05)。故以40岁为年龄分界点对参考人群重新分组,分为小于40岁组和大于或等于40岁组,其中,小于40岁组306例,血清HE4平均水平为(46.57±9.26)pmol/L;≥40岁组422例,血清HE4平均水平为(56.01±10.15)pmol/L,40岁以上人群血清HE4水平明显高于40岁以下人群,两组血清HE4水平比较差异有统计学意义(F=82.53,P=0.000)。由于血清HE4水平升高有临床意义,同时便于和罗氏公司试剂说明书推荐的参考区间进行比较,故取其单侧98%的置信区间上限作为血清HE4的参考区间,得女性血清HE4水平参考区间为:<40岁时,HE4<70.42 pmol/L;≥40岁时,HE4<82.16 pmol/L,均明显低于罗氏公司试剂说明书中推荐的小于140 pmol/L的参考区间。
2.3 血清HE4水平参考区间在卵巢恶性肿瘤中的临床诊断效能分析 根据本研究所得的参考区间,在80例病理检查确诊的卵巢恶性肿瘤中有68例HE4阳性,80例卵巢良性肿瘤中75例HE4阴性。而根据罗氏公司试剂说明书推荐的参考区间,在80例病理检查确诊的卵巢恶性肿瘤中仅有52例HE4阳性,80例卵巢良性肿瘤中79例HE4阴性。相对于罗氏公司试剂说明书推荐的参考区间,使用本研究所得的参考区间明显提高了血清HE4在卵巢恶性肿瘤中的临床诊断灵敏度、阴性预测值和Youden′s指数,差异有统计学意义(P<0.05);而临床诊断特异度、阳性预测值、准确度无明显变化,差异无统计学意义(P>0.05),见表2~3。

表2 卵巢肿瘤患者中血清HE4的阳性情况(n)
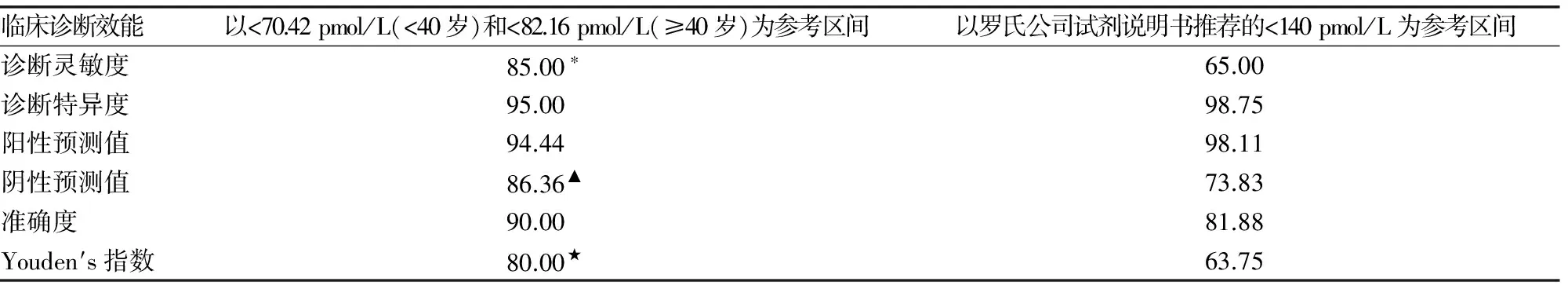
表3 不同血清HE4参考区间在卵巢癌中的临床诊断效能比较(%)
3 讨 论
HE4又名WFDC2,最早是由Kirchhoff等于1991年在人附睾远端上皮细胞中成功分离得到,其基因定位于染色体20q12~13.1上,全长约12 kb,编码的蛋白质HE4是一酸性、小分子的分泌蛋白,被认为是附睾特有的、与精子成熟有关的蛋白质。随后的研究表明,除了附睾组织之外,许多组织表面都有HE4的表达。Galgano等[4]通过免疫组织化学及基因芯片技术检测结果显示,在健康成年女性生殖道腺上皮、乳腺、附睾、输精管、呼吸道上皮、远端肾小管、结肠黏膜及唾液腺均存在HE4表达,并且在气管和唾液腺HE4表达的水平相对较高,同时HE4在93%卵巢浆液性癌、100%卵巢子宫内膜样癌及50%卵巢透明细胞癌表达,而在正常卵巢组织中几乎不表达,提示HE4在卵巢癌诊断中具有重要意义,是诊断卵巢癌的重要血清学标记物。血清高水平HE4表达和卵巢癌的转移、临床FIGO高分期[5]、预后不良直接相关,也预示着卵巢癌减灭手术[6]和化疗[7]的效果好坏。
但是,由于实验设计不同、检测方法各异,加上缺乏大样本的临床研究等原因,使得尚未建立适合中国人群的HE4参考区间,导致HE4用于早期诊断卵巢癌的阳性率差异很大[8-9],影响了HE4在临床诊断中的应用。研究表明,HE4的参考区间受种族[10-11]、地区[12-13]、年龄[9,14]、肾脏功能[15]、绝经状态[16]等多种因素的影响。一项来自于美国的研究显示,美国1 147例健康女性个体中94.4%的个体的HE4测试值位于或低于150 pmol/L,因此,推荐HE4试剂盒的参考区间为0~150 pmol/L,但说明书同时也强调,每个实验室要自己建立参考区间,研究同时证实了不同种族和人群间结果相差较大。最近韩国[1]通过对亚洲2 182例健康人血清HE4水平的研究,发现97.5%的健康人HE4上限为33.2 pmol/L,这和欧美人群相差较大。胡晓舟等[12]首次对北京地区224例健康女性进行了HE4参考值范围的调查,发现年龄、良性疾病的构成比是影响HE4参考值的因素,结果显示小于或等于40岁时,HE4<59.6 pmol/L;大于40岁时,HE4<62.4 pmol/L。而蔡斌等[13]检测了上海地区913例健康体检女性的HE4水平,建议血清HE4水平参考区间为<60岁时,<59.81 pmol/L;≥60岁时,<80.47pmol/L,这一结果与北京地区的差异较大。以上有关亚洲及国内不同人群的研究和欧美人群的结果相差较大,都提示地域和人群可能是血清HE4阈值差异的原因,需要建立特定人群的参考区间。国外报道年龄是影响血清HE4浓度的重要因素[7,14],国内于2014年年底完成的一项有关HE4多中心的研究也表明,中国表观健康女性HE4水平随年龄增长呈现递增趋势,年龄是影响HE4临界值的重要因素。本研究也进一步证实了这一点,随着年龄段的增加,血清HE4水平也随之升高,尤其是40~49岁这一年龄段增幅较大,和40岁以下各年龄段比较,差异有统计学意义(P=0.000),和40岁以上各年龄段比较,差异无统计学意义(P>0.05),提示40~49岁是一个重要的分界点,40岁以上人群血清HE4平均水平明显高于40岁以下人群,差异有统计学意义(P=0.000),和胡晓舟等[12]的研究结果一致,故本研究以40岁为年龄分界点,分别计算其参考区间。由于血清HE4水平升高有临床意义,同时便于和罗氏公司试剂说明书推荐的参考区间进行比较,故取其单侧98%的置信区间上限作为血清HE4的参考区间,所得的血清HE4水平参考区间为小于40岁时,HE4<70.42 pmol/L,大于或等于40岁时,HE4<82.16 pmol/L,均明显低于罗氏公司试剂说明书推荐的参考区间,和文献报道也有较明显的不同,可能和赣州人群主要为客家人群有关。
检测方法是影响血清HE4参考区间异质性的另一个重要因素,目前检测方法主要以酶联免疫法和电化学发光法为主。酶联免疫法以瑞典康乃格的试剂盒为代表,上述美国的研究、国内的研究所建立的参考区间均是基于此种方法而得来[10,12-13]。电化学发光法以德国罗氏公司在2010年推出的电化学发光法商品化试剂盒为代表,该试剂盒推荐使用的参考区间为小于140 pmol/L,该参考区间来源于西班牙和德国两家临床中心对896例女性样本的测定结果,98%的明显健康妇女落在此区间内。然而,若以罗氏公司试剂说明书推荐的140 pmol/L为cut-off值,则血清HE4对卵巢癌的诊断灵敏度仅为65%,甚至不及CA125的阳性率,这和国内外报道的HE4对卵巢癌的诊断效能优于CA125明显不一致[2-3]。作者通过对病理检查确诊的80例卵巢良性肿瘤和80例卵巢恶性肿瘤患者进行了血清HE4参考区间的临床诊断效能评价,相对于罗氏试剂说明书推荐的参考区间,使用本研究所得的参考区间可以明显提高血清HE4在卵巢恶性肿瘤中的临床诊断灵敏度、阴性预测值和Youden′s指数,差异有统计学意义(P<0.05),而临床诊断特异度、阳性预测值、准确度无明显变化,说明了罗氏公司所推荐的参考区间明显不适用于赣州人群,需建立适合赣州人群的血清HE4参考区间,以提高血清HE4的临床诊断效能,为卵巢癌的诊断提供更有效的实验诊断依据。
[1]朱亚飞,高国兰,黄清水,等.血清人附睾分泌蛋白4(HE4)对人卵巢癌诊断价值的Meta分析[J].中国肿瘤临床,2011,38(24):1559-1564.
[2]Li F,Tie R,Chang K,et al.Does risk for ovarian malignancy algorithm excel human epididymis protein 4 and CA125 in predicting epithelial ovarian cancer:a meta-analysis[J].BMC Cancer,2012,12(2):258.
[3]Yu S,Yang HJ,Xie SQ,et al.Diagnostic value of HE4 for ovarian cancer:a meta-analysis[J].Clin Chem Lab Med,2012,50(8):1439-1446.
[4]Galgano MT,Hampton GM,Frierson HF.Comprehensive analysis of HE4 expression in normal and malignant human tissues[J].Mod Pathol,2006,19(6):847-853.
[5]Speeckaert MM,Speeckaert R,Delanghe JR.Human epididymis protein 4 in cancer diagnostics:a promising and reliable tumor marker[J].Adv Clin Chem,2013,59(1):1-21.
[6]Sandri MT,Bottari F,Franchi D,et al.Comparison of HE4,CA125 and ROMA algorithm in women with a pelvic mass:correlation with pathological outcome[J].Gynecol Oncol,2013,128(2):233-238.
[7]Trudel D,Têtu B,Grégoire J,et al.Human epididymis protein 4(HE4) and ovarian cancer prognosis[J].Gynecol Oncol,2012,127(3):511-515.
[8]缪亚梅,金梅.血清人附睾分泌蛋白4检测在卵巢癌诊断中的临床应用[J].中国肿瘤,2013,22(10):838-840.
[9]朱振宁,魏娜,严妮子.HE4联合CA125在卵巢癌早期诊断中的应用价值[J].现代肿瘤医学,2014,22(3):623-624.
[10]李小平,魏丽惠.对卵巢恶性肿瘤标志物的再认识[J].中国妇产科临床杂志,2011,12(4):241-243.
[11]Park Y,Kim Y,Lee EY,et al.Reference ranges for HE4 and CA125 in a large Asian population by automated assays and diagnostic performances for ovarian cancer[J].Int J Cancer,2012,130(5):1136-1144.
[12]胡晓舟,张捷.健康人群血清HE4水平参考区间的初步探讨[J].中华检验医学杂志,2009,32(12):1376-1378.
[13]蔡斌,刘雪莲,杨懿霞,等.913例健康体检女性血清HE4水平分布的初步观察[J].实用妇产科杂志,2012,28(12):1045-1049.
[14]Bolstad N,Oijordsbakken M,Nustad K,et al.Human epididymis protein 4 reference limits and natural variation in a Nordic reference population[J].Tumour Biol,2012,33(1):141-148.
[15]Jacob F,Meier M,Caduff R,et al.No benefit from combining HE4 and CA125 as ovarian tumor markers in a clinical setting[J].Gynecol Oncol,2011,121(3):487-491.
[16]Holcomb K,Vucetic Z,Miller MC,et al.Human epididymis protein 4 offers superior specificity in the differentiation of benign and malignant adnexal masses in premenopausal women[J].Am J Obstet Gynecol,2011,205(4):358.e1-358.e6.
Study of reference interval of serum HE4 in Ganzhou population and evaluation of its clinical diagnostic efficiency*
JiangLixia,ZhuYafei,HuRong,HeHua,ChenXiaohong,LiFeng
(DepartmentofClinicalLabortary,FirstAffiliatedHospitalofGannanMedicalCollege,Ganzhou,Jiangxi341000,China)
Objective To investigate the reference interval of HE4 in Ganzhou population and to evaluate its clinical efficiency in people with ovarian cancer.Methods728 healthy females with all normal physical indexes of the comprehensive examination in hospital from 2013 January to 2014 December were collected,which regarded as control group.Moreover,80 hospitalized patients with malignant ovarian tumor and 80 patients with benign ovarian tumor were selected as the experimental group.Serum levels of HE4 were measured by Roche electrochemical luminescence and the distribution of serum HE4 level of the reference population was analyzed.Reference interval of serum HE4 was calculated and the efficacy of its clinical diagnosis in ovarian cancer was evaluated.ResultsThe average serum level of HE4 in 728 females was (52.04±10.83) pmol/L.There existed statistical difference in serum HE4 level between the group age above 40 and the group age under 40 (P=0.000),but no significant difference in each age group between above 40-year-old and under 40-year-old (P>0.05);The serum level of HE4 reference interval was <70.42 when the patients were less than 40 years old;and was <82.16 pmol/L when the patients were more than 40 years old,both were significantly lower than the the reference interval recommended by Roche reagent (<140 pmol/L).But it increased significantly in clinical diagnostic sensitivity,negative predictive value and Youden′s index in ovarian cancer (P<0.05),while the clinical diagnostic specificity,positive predictive value and accuracy had no obvious changes(P>0.05).ConclusionThe reference interval of the serum HE4 in Ganzhou population is significantly lower than Roche's reference interval.It significantly increases the diagnostic effectiveness of serum HE4 in patients with ovarian cancer by using the reference interval in this study.
ovarian neoplasms;serum;human epididymis protein 4;reference interval;diagnosis
10.3969/j.issn.1671-8348.2015.34.016
江西省卫生厅基金资助项目(20141113);赣南医学院重点课题(ZD201301)。
:江丽霞(1974-),主任技师,硕士,主要从事临床妇科肿瘤研究。
R446.1
A
1671-8348(2015)34-4799-03
2015-05-08
2015-07-15)



