杜尚珂,石 瑛,岳 宁,张琳琳,于海洋,贾莉婷,张 展
(郑州大学第三附属医院检验科 450052)
缺氧调控JAR细胞Stat3表达及细胞凋亡的研究*
杜尚珂,石瑛,岳宁,张琳琳,于海洋,贾莉婷,张展△
(郑州大学第三附属医院检验科450052)
[摘要]目的探讨缺氧对JAR细胞信号转导子和转录激活子3(Stat3)和磷酸化Stat3(p-Stat3)蛋白表达及细胞凋亡的影响。方法在缺氧条件下培养JAR细胞,通过蛋白免疫印迹法(Western blot)检测Stat3和p-Stat3在缺氧前后蛋白表达的差异,采用流式细胞术检测细胞凋亡水平。结果缺氧培养JAR细胞48 h后,细胞形态发生异常改变,Stat3和p-Stat3蛋白表达水平均明显降低(P<0.05),细胞凋亡水平明显增加(P<0.05)。结论缺氧使JAR细胞Stat3和p-Stat3蛋白表达水平降低,凋亡增加。
[关键词]细胞信号转导子和转录激活子3;缺氧;滋养细胞;凋亡
滋养细胞是母胎界面进行物质交换的主要场所,早期胚胎发育及胎盘形成是在相对缺氧环境中进行[1]。自妊娠11周起,滋养细胞浸润能力增加,缺氧状态得到改善,若持续低氧会阻碍正常妊娠进行,许多妊娠期疾病与滋养细胞缺氧有关[2-3],如子痫前期(preeclampsia,PE)和胎儿生长受限(fetal growth restriction,FGR)。信号转导子和转录激活子(signal transducer and activator of transcriptions,Stats)是介导细胞内信号转导的转录因子,包括6个亚型(Stat1~Stat6),其中Stat3研究最为广泛。Stat3被激活时C-端的酪氨酸残基(TryY705)和丝氨酸残基(Ser727)位点发生磷酸化,形成磷酸化Stat3(p-Stat3)。p-Stat3调控机体细胞多项生理功能的基因转录,如增殖、侵袭、迁移及凋亡。在某些病理状态下发生异常表达,如肿瘤和子痫前期。目前,尚未有研究报道缺氧能否改变滋养细胞Stat3的表达情况,本研究通过低氧培养JAR细胞,检测缺氧后Stat3和p-Stat3在JAR细胞中的表达及细胞凋亡水平,探讨滋养细胞缺氧与缺氧性妊娠期疾病之间的关系。
1材料与方法
1.1材料人绒毛膜癌细胞JAR细胞系(美国ATCC公司)。试剂与仪器:高糖完全培养基(美国Geneview公司),二氯化钴(CoCl2天津致远化工),RNA提取试剂(美国Invitrogen公司),逆转录试剂盒(鼎国公司),蛋白浓度测定BCA 试剂盒(康为公司),Stat3和p-Stat3兔抗人抗体(美国CST公司),Annexin V-FITC凋亡检测试剂盒(碧云天公司)。
1.2方法
1.2.1细胞培养及实验分组培养JAR细胞至对数生长期,以1×105cell/L细胞密度接种于6孔培养板至细胞融合至80%时,更换无血清培养基处理细胞24 h,进行配对分组:正常组和缺氧处理组(加入CoCl2使其终浓度为300 μmol/L),培养48 h后进行各项检测。
1.2.2实时荧光定量PCR(RT-PCR)检测Trizol提取细胞总RNA,紫外吸收法进行RNA定量检测,各组RNA的吸光度(A)260/280均在1.8~2.0。cDNA逆转录按照逆转录试剂盒说明书操作。每组设置3个复孔,进行RT-PCR扩增。扩增反应条件为95 ℃预变性10 min,95 ℃ 15 s、60 ℃ 1 min进行40个扩增循环,72 ℃延伸10 min,采用2-△△CT方法计算Stat3 mRNA的相对表达量。引物由上海捷瑞生物有限公司合成,β-actin为内参,引物序列,见表1。
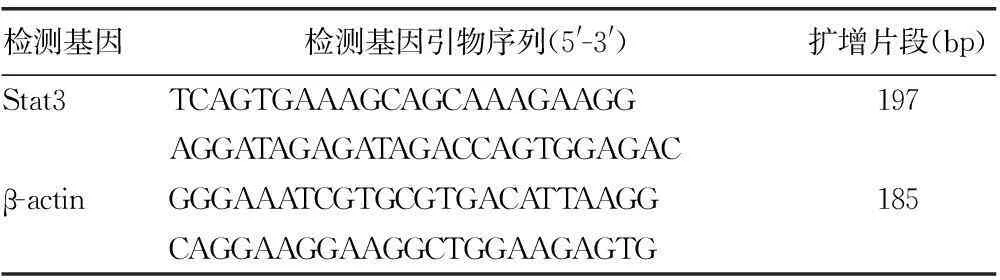
表1 RT-PCR扩增的引物序列及扩增片段的大小
1.2.3蛋白免疫印迹法(Western blot)检测6孔板内细胞100 μL蛋白裂解液(加入1∶100的PMSF和磷酸酶抑制剂)。BCA法测总蛋白浓度。十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE),TBST清洗膜后,加Stat3和p-Stat3一抗抗体,4 ℃摇床孵育过夜。加入二抗(1∶4 000)。用ODYSSEY Clx检测与成像系统进行扫描,分析条带的灰度值。以目的蛋白条带与内参灰度值之比作为结果。
1.2.4流式细胞术检测消化细胞制成细胞悬液,磷酸盐缓冲液(PBS)洗涤3次,400目筛子过滤,凋亡检测严格按照Annexin V-FITC凋亡试剂盒说明书进行操作,应用FACSCALLBUR流式细胞仪(美国BD公司)测定细胞荧光LYSISⅡ软件分析。
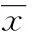
2结果
2.1正常和缺氧培养下JAR细胞形态观测JAR细胞缺氧培养48 h后,缺氧处理组细胞肉眼可见细胞凋亡增加,部分细胞形态发生改变,细胞由圆形或椭圆形变成纤维样或棘形样细胞,细胞胞质中出现黑色粗颗粒,见图1。

A:正常组;B:缺氧处理组。
图1缺氧处理JAR细胞形态图(×100)
2.2RT-PCR检测结果RT-PCR实验显示,JAR细胞经缺氧处理缺氧处理48 h后, Stat3 mRNA的相对表达水平为1.699±0.243,与正常组相比明显升高,差异有统计学意义(t=-2.871,P<0.05),见图2。

*:P<0.05,与正常组比较。
图2缺氧培养JAR细胞48 h后Stat3 mRNA的表达水平
2.3Western blot检测结果Western blot检测显示,JAR细胞经缺氧处理48 h后,与正常组比较,Stat3和p-Stat3蛋白表达均明显降低,差异均有统计学意义(t=-11.260、-42.784,P<0.05),见图3。
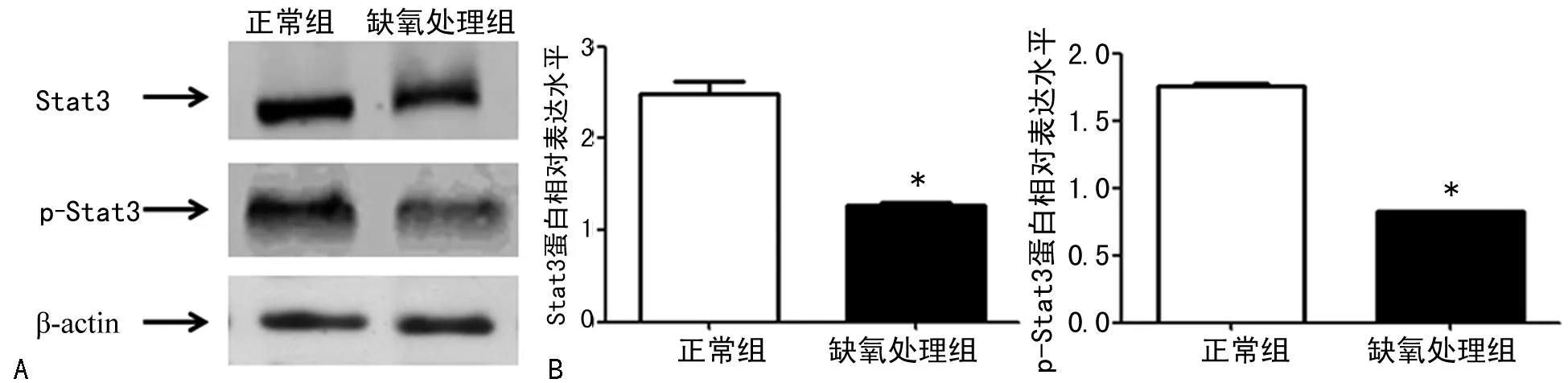
A:Stat3和p-Stat3蛋白相对表达结果;B:Stat3蛋白相对表达水平;C:p-Stat3蛋白相对表达水平。*:P<0.05 ,与正常组比较。
图3缺氧培养JAR细胞48 h后Stat3和p-Stat3蛋白的表达结果
2.4流式细胞术检测结果通过流式细胞术检测凋亡实验结果可见,缺氧处理组的细胞凋亡率为(4.02±1.24)%,明显高于对照组(17.83±2.04)%,差异有统计学意义(t=6.692,P<0.05),见图4。
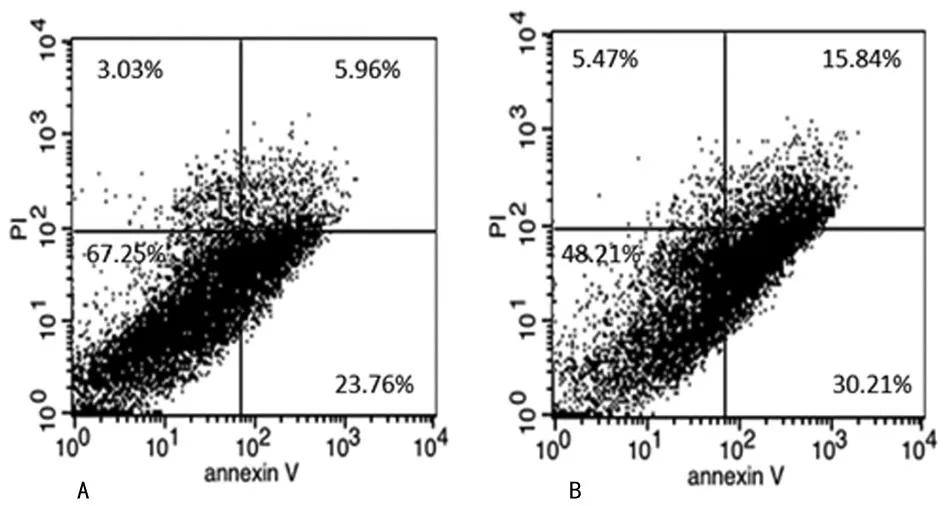
A:正常组;B:缺氧处理组。
图4缺氧培养JAR细胞48 h后细胞凋亡水平
3讨论
氧气对滋养细胞增殖、分化和凋亡至关重要[4]。子痫前期胎盘滋养细胞及体外缺氧培养滋养细胞细胞凋亡均增加[5]。本研究采用CoCl2化学方法建立JAR细胞缺氧模型,JAR细胞为人绒毛膜癌的转化细胞,系滋养细胞来源,可提供滋养细胞功能方面研究;适当浓度的CoCl2能在正常氧分压下与Fe2+竞争性结合氧分子,从而达到细胞缺氧的目的。不同细胞系[6]造成细胞缺氧环境所需CoCl2的浓度不同,当CoCl2终浓度为300 μmol/L时,JAR细胞内HIF-1α表达水平显着升高,细胞生长抑制显着且无明显细胞毒性作用。多项研究以此类细胞系作为滋养细胞的缺氧模型[7]。
本研究缺氧处理JAR细胞48 h后检测Stat3的mRNA水平,以及Stat3和p-Stat3的蛋白表达水平,得出缺氧后Stat3 mRNA水平的变化与蛋白质水平变化不一致,Stat3的mRNA水平代表其基因转录时状态,但由于基因转录后存在更为复杂的翻译调控作用,因此mRNA水平并不能准确代表其蛋白质的表达水平,两者表达之间不完全成一致性;此外,基因在不同组织、细胞和时间中所受的各种调控不同也使两者之间不相关或负相关。缺氧环境下JAR细胞p-Stat3蛋白表达降低,且细胞发生明显凋亡。有研究发现恶性外周神经鞘瘤细胞中Stat3可通过HIF-1α信号通路对细胞发挥作用[8],在缺血大鼠的肾脏和缺氧肾癌细胞中p-Stat3可通过阻碍HIF-1α蛋白降解或增加缺氧环境中HIF-1α的合成来促进细胞内HIF-1α水平升高,由此推测在缺氧JAR细胞中p-Stat3可能参与低氧调控的信号通路,进而参与细胞凋亡的发生。
细胞凋亡是细胞发生程序性死亡,在维持正常细胞生理功能中发挥重要作用,主要包括两条重要通路:膜受体凋亡通路和线粒体凋亡通路。Stat3作为细胞内重要的转录因子[9],可调控多种凋亡蛋白(p53、Bax)和抗凋亡蛋白
的基因转录,发挥抑制细胞凋亡、促进细胞生存的作用。缺氧处理JAR细胞后,随着p-Stat3蛋白表达降低,可使其下游抗凋亡因子表达下降,从而导致细胞凋亡增加。有研究得出重度子痫前期胎盘滋养细胞中Stat3和p-Stat3的蛋白表达水平下降[10],滋养细胞凋亡增加,与本课题研究结果一致。
综上所述,本研究结果表明缺氧可使p-Stat3蛋白表达降低,细胞凋亡增加。Stat3作为细胞内参与基因转录的蛋白,可协同其他信号通路共同发挥作用,深入探索缺氧和Stat3的相互关系可对缺氧性妊娠期疾病的病因、发病机制及预测、治疗提供新思路。
参考文献
[1]Kleppa MJ,Erlenwein SV,Darashchonak N,et al.Hypoxia and the anticoagulants dalteparin and acetylsalicylic acid affect human placental amino acid transport[J].PLoS One,2014,9(6):e99217.
[2]Zhou J,Xiao D,Hu Y,et al.Gestational hypoxia induces preeclampsia-like symptoms via heightened endothelin-1 signaling in pregnant rats[J].Hypertension,2013,62(3):599-607.
[3]Akhilesh M,Mahalingam V,Nalliah S,et al.Participation of hypoxia-inducible factor-1α in the pathogenesis of preeclampsia-related placental ischemia and its potential as a marker for preeclampsia[J].Biomarkers Genomic Med,2014,6(3):121-125.
[4]Can M,Guven B,Bektas S,et al.Oxidative stress and apoptosis in preeclampsia[J].Tissue Cell,2014,46(6):477-481.
[5]Longtine MS,Chen B,Odibo AO,et al.Villous trophoblast apoptosis is elevated and restricted to cytotrophoblasts in pregnancies complicated by preeclampsia,IUGR,or preeclampsia with IUGR[J].Placenta,2012,33(5):352-359.
[6]Hong KH,Yoo SA,Kang SS,et al.Hypoxia induces expression of connective tissue growth factor in scleroderma skin fibroblasts[J].Clin Exp Immunol,2006,146(2):362-370.
[7]夏俊霞,乔福元,吉琼梅,等.低氧对BeWo细胞骨桥蛋白表达的影响[J].华中科技大学学报(医学版),2014,43(1):48-52.
[8]Rad E,Dodd K,Thomas L,et al.STAT3 and HIF1α signaling drives oncogenic cellular phenotypes in malignant peripheral nerve sheath tumors[J].Mol Cancer Res,2015,13(7):1149-1160.
[9]Siveen KS,Sikka S,Surana R,et al.Targeting the STAT3 signaling pathway in cancer:role of synthetic and natural inhibitors[J].Biochim Biophys Acta,2014,1845(2):136-154.
[10]Zhang Z,Yang X,Zhang L,et al.Decreased expression and activation of Stat3 in severe preeclampsia[J].J Mol Histol,2015,46(2):205-219.
The effects of hypoxia on the expression of Stat3 and the cell apoptosis*
Du Shangke,Shi Ying,Yue Ning,Zhang Linlin,Yu Haiyang,Jia Liting,Zhang Zhan△
(DepartmentofClinicalLaboratory,theThirdAffiliatedHospitalofZhengzhouUniversity,Zhengzhou,Henan450052)
[Abstract]ObjectiveTo investigate the effects of hypoxia on the expression of Stat3 and p-Stat3,and assessed the apoptosis ability of JAR cells in vitro.MethodsJAR cells were cultured under hypoxic conditions.Western blot were used to determine the protein expression of Stat3 and p-Stat3.Cellular apoptosis was monitored by flow cytometry analysis.ResultsAbnormal morphology changes in trophoblast cells under low oxygen conditions.After 48 h hypoxic treatment,the protein of Stat3 and p-Stat3 were significantly decreased(P<0.05);however,the level of apoptosis was significantly increased(P<0.05).ConclusionStat3 and p-Stat3 protein levels were decreased under hypoxia circumstance,while the cell apoptosis ability was increased in JAR cells.
[Key words]signal transducer and activator of transcriptions 3;hypoxia;trophoblast;apoptosis
doi:·论着·10.3969/j.issn.1671-8348.2016.17.003
*基金项目:河南省科技创新人才计划项目(124200510005)。
作者简介:杜尚珂(1989-),初级检验技师,硕士,主要从事生殖免疫研究工作。△通讯作者,Tel:18790802060;E-mail:zhangzhanzdsfy@126.com。
[中图分类号]R446
[文献标识码]A
[文章编号]1671-8348(2016)17-2312-02
(收稿日期:2015-11-23修回日期:2016-03-09)



