肖凤娟,杨 元,许学杰,李作孝△
(1.四川绵阳四○四医院神经内科 621000;2.西南医科大学附属医院神经内科,四川泸州 646000)
多西环素对EAE大鼠Th1/Th2细胞平衡及相关细胞因子的影响
肖凤娟1,杨 元2,许学杰1,李作孝2△
(1.四川绵阳四○四医院神经内科 621000;2.西南医科大学附属医院神经内科,四川泸州 646000)
目的 探讨多西环素对实验性变态反应性脑脊髓炎(EAE)大鼠模型Th1/Th2细胞平衡的影响。方法 将40只雌性Wistar大鼠分为EAE对照组及低、中、高剂量多西环素组,每组10只。观察大鼠发病情况及发病高峰期外周血单个核细胞(PBMC)分泌白细胞介素(IL)-4、干扰素-γ(IFN-γ)水平,测定高峰期脑组织IL-1β、IL-10、肿瘤坏死因子α(TNF-α)水平及脑脊液和血清清蛋白水平,计算脑脊液与血清清蛋白比值(QA值)。结果 各剂量多西环素组大鼠临床症状较EAE对照组均减轻。各剂量多西环素组大鼠发病高峰期外周血单个核细胞(PBMC)分泌IFN-γ水平和IFN-γ/IL-4比值均较EAE对照组降低,分泌IL-4水平均较EAE对照组升高(P<0.01);高剂量多西环素组IL-4水平较中剂量多西环素组增高差异无统计学意义(P>0.05),其余各剂量多西环素组间差异有统计学意义(P<0.01)。各剂量多西环素组大鼠发病高峰期脑组织IL-1β、TNF-α水平及QA值较EAE对照组降低,IL-10水平较EAE对照组升高(P<0.05)。随多西环素剂量增加,各剂量多西环素组IL-1β、TNF-α水平及QA值越低,IL-10水平越高,且各组间差异有统计学意义(P<0.05)。结论 多西环素可明显减轻EAE大鼠临床症状,其机制可能与多西环素降低大鼠Th1细胞因子水平,升高Th2细胞因子水平,纠正Th1/Th2细胞平衡,从而保护血脑屏障有关。
实验性变态反应性脑脊髓炎;多西环素;Th1细胞;Th2细胞;QA值;大鼠,Wistar
多发性硬化(multiple sclerosis,MS)是一种常见的中枢神经系统(CNS)多灶性、炎性、脱髓鞘性疾病,其发病兼有神经变性和免疫异常两方面[1],但目前其具体的病因和发病机制仍不完全清楚,迄今也无肯定的有效治愈方法。而通过致敏抗原诱导敏感实验动物发生的由T细胞介导的迟发型超敏反应型自身免疫疾病-实验性变态反应性脑脊髓炎(experimental autoimmune encephalomyelitis,EAE),是目前国际上公认的研究MS的理想动物模型[2]。传统观点认为细胞免疫Thl/Th2平衡失调与MS和EAE发病密切相关,Thl细胞为炎症促进细胞,分泌的白细胞介素(IL)-1 、IL-2、IL-6、肿瘤坏死因子-α (TNF-α)、干扰素-γ(IFN-γ)等细胞因子,能诱导巨噬细胞活化,激活T细胞反应,增强抗原-提呈作用;Th2细胞是炎症抑制细胞,分泌的IL-4、IL-10等具有抗炎作用,可下调Th1型免疫应答反应并抑制其细胞因子产生[3]。Thl细胞免疫应答增强和Th2细胞免疫应答减弱是MS发病重要机制[4]。同时在此免疫功能失衡的状态下,血脑屏障(blood brain barrier,BBB)的免疫屏障功能受到破坏,异常激活的T型免疫细胞及其细胞因子、血液中的蛋白等大分子成分则会通过受损的BBB进入CNS,进而成为脑脊液成分。因此,有学者认为,脑脊液蛋白含量可以较理想地反映BBB的状态,血清清蛋白水平比值(QA值)与BBB通透性受损程度呈正相关[5]。
多西环素(doxycycline)作为半合成四环素类抗生素,不仅具有抗菌活性,在一定程度上也能抑制基质金属蛋白酶(matrix metalloproteinases,MMPs)、中性粒细胞弹力蛋白酶、一氧化氮合成酶,同时还具有生物利用度高、高脂溶性、易透过BBB、安全性高等优点。本实验旨在探究多西环素对EAE大鼠体内Th1/Th2细胞平衡的影响。
1 材料与方法
1.1 材料
1.1.1 实验动物 雌性Wistar大鼠40只(四川大学华西实验动物中心),6~8周龄,体质量(200±20)g;豚鼠6只(四川大学华西实验动物中心),体质量(400±20)g。实验前Wistar大鼠在西南医科大学附属医院中心实验室常规饲养1周。
1.1.2 实验药品及试剂 多西环素针剂购自海口康力元制药有限公司;卡介苗(BCG)购自BD公司;不完全福氏佐剂(IFA)购自Sigma公司;IL-4、IL-10、IFN-γ酶联免疫吸附试验(ELISA)试剂盒购自晶美生物工程有限公司。
1.2 方法
1.2.1 EAE模型的制作 将Wistar大鼠分为4组:EAE对照组及低、中、高剂量多西环素组,每组10只。将BCG加入IFA制成含5 mg/mL BCG浓度的完全福氏佐剂。在大鼠四足掌胶质垫皮下注射完全福氏佐剂,每只0.5 mL。
1.2.2 模型干预 从造模前3天开始每天分别给予低、中、高剂量多西环素组多西环素5、10、20 mg·kg-1·d-1腹腔注射;EAE对照组予以相同剂量生理盐水,连续10 d。
1.2.3 动物模型评价 每天定时对实验大鼠进行神经功能障碍评分。评分标准:0分,未发病;1分,后肢轻度无力(尾巴无力);2分,中度后肢无力或轻度共济失调;3分,中至重度后肢无力;4分,严重后肢无力;5分,中度以下四肢无力的截瘫;6分,四肢全瘫或严重共济失调或者死亡[6-7]。
1.2.4 实验终止 将大鼠在连续3 d症状评分无加重、四肢瘫痪或者大鼠死亡的发病高峰期处死,取大鼠脑脊液(CSF)、外周血和脾脏。
1.2.5 大鼠血清IL-4、IFN-γ水平测定 实验终止时,每只Wistar大鼠经眶静脉丛取血8~9 mL,用肝素抗凝后以2 000 r/min离心30 min,留取1/2血清保存于-20 ℃冰箱,按IL-4、IFN-γ ELISA试剂盒说明书检测。
1.2.6 脑组织IL-1β、IL-10、TNF-α水平的测定 实验终止时,取300~400 mg脑组织立即放入1 mL生理盐水研磨成匀浆,在4 ℃以3 000 r/min离心15 min,留取上清液保存于-20 ℃,15 d内按IL-10 ELISA试剂盒说明书检测IL-10水平,通过放射免疫法测定脑组织IL-1β、TNF-α水平。
1.2.7 CSF和QA值检测 实验终止时,将剩余1/2血清与脑脊液送至医院检验科检测清蛋白水平,并计算脑脊液与血清清蛋白比值即QA值。
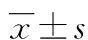
2 结 果
2.1EAE对照组及各剂量多西环素组发病情况EAE对照组大鼠多在免疫后10d左右开始逐渐出现病情,如活动量减少、反应时间延长,继而出现单侧或双侧前后肢体无力、共济失调、瘫痪甚至死亡。各剂量多西环素组实验大鼠症状均较EAE组减轻,表现为潜伏期延长,进展期缩短,神经功能障碍评分减低。各剂量多西环素组并无大鼠死亡。
2.2 各组大鼠发病高峰期PBMC分泌INF-γ、IL-4水平及IFN-γ/IL-4比值 各剂量多西环素组大鼠发病高峰期PBMC分泌IFN-γ水平和IFN-γ/IL-4比值均较EAE对照组降低,分泌IL-4水平均较EAE对照组升高(P<0.01);高剂量多西环素组IL-4水平较中剂量多西环素组差异无统计学意义(P>0.05),其余各剂量多西环素组间差异有统计学意义(P<0.01),见表1。
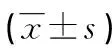
表1 各组发病高峰期PBMC分泌INF-γ、IL-4水平及IFN-γ/IL-4比值
a:P<0.01,与EAE对照组比较;b:P<0.01,与低剂量多西环素组比较;c:P<0.01,与中剂量多西环素组比较。
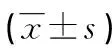
表2 各组大鼠发病高峰期脑组织IL-1β、IL-10、TNF-α水平
a:P<0.01,b:P<0.05,与EAE对照组比较;c:P<0.01,与低剂量多西环素组比较;d:P<0.01,与中剂量多西环素组比较。
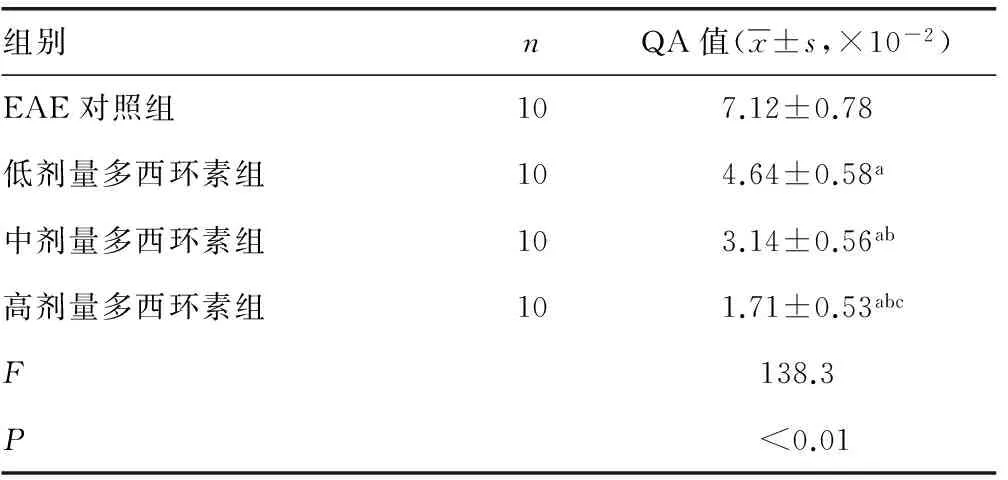
表3 各组大鼠发病高峰期QA值变化
a:P<0.01,与EAE对照组比较;b:P<0.01,与低剂量多西环素组比较;c:P<0.01,与中剂量多西环素组比较。
2.3 各组大鼠发病高峰期脑组织IL-1β、IL-10、TNF-α水平比较 各剂量多西环素组大鼠发病高峰期脑组织IL-1β、TNF-α水平较EAE对照组降低,IL-10水平较EAE对照组升高(P<0.05)。随多西环素剂量增加,各剂量多西环素组IL-1β、TNF-α水平越低,IL-10水平越高,各多西环素组组间差异有统计学意义(P<0.05),见表2。
2.4 各组大鼠发病高峰期QA值比较 各剂量多西环素组大鼠发病高峰期QA值较EAE对照组明显降低(P<0.01),随多西环素剂量增加,各剂量多西环素组大鼠脑组织QA值水平越低,各多西环素组间差异有统计学意义(P<0.05),见表3。
3 讨 论
已有的研究发现,MS是在易感基因和环境因素共同作用下诱发的异常自身免疫应答在CNS的表现,包括血脑屏障破坏,髓鞘蛋白破坏,T细胞过度激活,少突胶质细胞修复减弱等[8-9]。大量研究证实,EAE是细胞免疫和体液免疫共同参与的复杂免疫病理过程,是由因IFN-γ介导的Th1型免疫反应过强,导致Thl/Th2免疫平衡失调[10]。Th1型免疫反应增强的同时伴随Th1型细胞因子激活,后者能明显上调BBB内皮黏附分子的表达,诱导激活的T细胞粘连、入侵BBB,且活化的免疫成分能通过激活MMPs,降解构成BBB的层黏蛋白、血管内皮基底膜等,进一步破坏BBB[11-12]。有研究显示,QA值作为评估BBB功能受损的指标,在EAE病程早期已开始升高,且随着病程的进展、临床症状的逐渐加重,QA值升高越明显,提示QA值与BBB受损程度有关[13]。
Th1细胞因子(IL-1、TNF-α、IFN-γ)是一类炎性细胞因子,其中的IL-1目前认为是参与最初免疫反应的,在其增强机体免疫防御功能的同时也启动了炎症反应和组织损伤,并在神经免疫轴中起关键作用,循环中的IL-1活性大多来源于IL-1β。IL-1β能通过诱导MMP-9表达间接破坏BBB、介导髓鞘降解、诱导少突胶质细胞凋亡[14]。Cantagrel等[15]研究发现,通过降低IL-1基因表达或敲除IL-1基因可减轻EAE病情的严重性,提示体内IL-1水平与疾病的严重程度相关。TNF-α可促进星形胶质细胞分化、诱导少突胶质细胞凋亡、抑制髓鞘形成;TNF-α也可诱导内皮细胞分泌黏附分子,增加BBB通透性;同时TNF-α可协同INF-γ诱导抗原提呈细胞的MHC-Ⅱ抗原表达,并能诱导IL-1活化、促进IFN-γ产生[16-17]。Sun等[18]实验发现,将TNF-α注入实验大鼠大脑半球可加重EAE大鼠病情。IFN-γ在Th0细胞分化时,可促进其向Th1细胞分化,弱化Th2细胞分化,打破Th0细胞的分化平衡。在EAE活动期,IFN-γ可通过强化抗原-提呈作用、激活T细胞、增强淋巴毒素释放破坏髓鞘[19]。在MS发病中,IFN-γ可诱导巨噬细胞产生IL-1,并与IL-1协同作用于星形细胞分泌TNF-α[20]。
Th2细胞因子(IL-4、IL-10)是炎症抑制因子,IL-4可诱导Th0细胞向Th2细胞分化增强,并促进B细胞增殖、分化、分泌抗体,诱导免疫耐受;同时也能抑制Th1细胞分化并下调其功能[21]。Bai等[22]研究发现,通过鼻黏膜途径给予髓磷脂碱性蛋白(MBP)诱导EAE大鼠免疫耐受,促进Th2细胞分泌IL-4,能缓解EAE大鼠症状、预防复发。IL-10能抑制抗原提呈作用和抗原特异性T细胞的作用,协同刺激因子,增强Th2细胞的免疫调节功能,抑制Th1细胞分泌IL-6、TNF-α[23]。Sonobe等[24]发现,在EAE大鼠发病时脾脏CD4+、CD8+T细胞IL-10mRNA表达下降,在疾病恢复期IL-10mRNA表达开始上调,认为调节性T细胞发挥免疫调节功能是来源于IL-10。
Minagar等[25]研究显示,多西环素可抑制IFN-γ、IL-1等炎性因子的表达,其机制可能是通过阻断细胞因子转录后过程实现的。Su等[26]在研究小鼠全身过敏反应时发现,多西环素可通过抑制P13K/Akt/eNOS/VE-钙黏蛋白通路下调TNF-α、IFN-γ等炎性因子的分泌水平、促进抑炎因子IL-4产生。而IFN-γ等炎性因子在EAE发病中分泌增强,不仅能抑制Th2细胞分化,下调Th2型抑炎因子水平,还可通过激活MMPs加重BBB的损伤和CNS的炎性变态反应。因而,多西环素通过抑制IFN-γ等炎性因子的活化,上调IL-4等抑炎因子水平,可间接抑制MMPs的激活,从而减轻BBB的破坏。本实验显示:在EAE的发病中,多西环素可抑制Th1型细胞因子分泌,促进Th2型细胞因子分泌,纠正Th1/Th2细胞平衡紊乱,保护BBB,从而对EAE的发病起防治作用。
Th1/Th2细胞免疫失衡在EAE发病中起重要作用,而多西环素可通过抑制Th1型细胞因子产生,促进Th2型细胞因子分泌,纠正Th1/Th2免疫平衡紊乱,从而减轻BBB的受损,其可能是EAE与MS治疗的一种有效途径。本实验研究为多西环素在以后神经病学临床应用提供一定的理论依据。
[1]GoldSM,VoskuhlRR.Estrogenandtestosteronetherapiesinmultiplesclerosis[J].ProgBrainRes,2009,175(9):239-251.
[2]MancardiG,HartBA,CapelloE,etal.RestrictedimmuneresponsesleadtoCNSdemyelinationandaxonaldamage[J].JNeuroimmunol,2000,107(2):178-183.
[3]JagessarSA,HeijmansN,BlezerEL,etal.UnravellingtheT-cell-mediatedautoimmuneattackonCNSmyelininanewPrimateEAEmodelinducedwithMOG34-56peptideinincompleteadjuvant[J].EurJImmunol,2012,42(1):217-227.
[4]CantornaMT,WoodwardWD,HayesCE,etal.1,25-dihydroxyvitaminD3isapositiveregulatorforthetwoanti-encephalitogeniccytokinesTGF-beta1andIL-4[J].JImmunol,1998,160(11):5314-5319.
[5]VirgintinoD,RobertsonD,BenagianoV,etal.Immunogoldcytochemis-tryoftheblood-brainbarrierglucosetransporterGLUT1andendogenousalbumininthedevelopinghumanbrain[J].BrainResDevBrainRes,2000,123(1):95.
[6]BaetenK,AdriaensensP,HendriksJ,etal.Trackingofmyelin-reactiveTcellsinexperimentalautoimmuneencephalomyelitis(EAE)animalsusingsmallparticlesofIronoxideandMRI[J].NMRBiomed,2010,23(6):601-609.
[7]CorrêaJO,AarestrupBJ,AarestrupFM.EffectofThalidomideandpentoxifyllineonexperimentalautoimmuneencephalomyelitis(EAE)[J].ExpNeurol,2010,226(1):15-23.
[8]SternEB.Amind“surroundedbyamoat”:afirst-personaccountofcognitiveimpairmentinmultiplesclerosis[J].CognBehavNeurol,2011,24(4):217-226.
[9]PietrolongoE,GiordanoA,KleinefeldM,etal.Decision-makinginmultiplesclerosisconsultationsinItaly:thirdobserverandpatientassessments[J].PLoSOne,2013,8(4):e60721.
[10]LinkerRA,LühderF,KallenKJ,etal.IL-6transsignallingmodulatestheearlyeffectorphaseofEAEandtargetstheblood-brainbarrier[J].JNeuroimmunol,2008,205(1/2):64-72.
[11]ShiryaevSA,SavinovAY,CieplakP,etal.Matrixmetalloproteinaseproteolysisofthemyelinbasicproteinisoformsisasourceofimmunogenicpeptidesinautoimmunemultiplesclerosis[J].PLoSOne,2009,3(4):e4952.
[12]FainardiE,CastellazziM,BelliniT,etal.Cerebrospinalfluidandserumlevelsandintrathecalproductionofactivematrixmetalloproteinase-9 (MMP-9)asmarkersofdiseaseactivityinpatientswithmultiplesclerosis[J].MultScler,2007,13(5):687-690.
[13]PratA,BiemackiK,LavoiJF,etal.Migrationofmultiplesclerosislymphocytesthroughbrainendothelium[J].ArchNeurol,2002(59):391-397.
[14]TomiokaR,MatsuiM.Biomarkersformultiplesclerosis[J].InternMed,2014,53(5):361-365.
[15]CantagrelA,NavauxF,NourhashemiF,etal.Interleukin-1β,interleukin-1receptorantagonist,interleukin-24,andinterleukin-10genepolymorphisms[J].ArthritisRheum,1999,42(6):1093-1100.
[16]孙雅菲,高娟,檀国军,等.阿托伐他汀对实验性变态反应性脑脊髓炎大鼠TNF-α和iNOS表达的影响[J].中国神经精神疾病杂志,2007,33(9):533-536.
[17]李婛,曾丽,邹东华.外源性雄激素对EAE大鼠血中CD4+CD25+T细胞的影响[J].中国神经精神疾病杂志,2008,34(2):115-117.
[18]SunD,NewmanTA,PerryVH,etal.Cytokine-inducedenhancementofautoimmuneinflammationinthebrainandspinalcord:implicationsformultiplesclerosis[J].NeuropatholApplNeurobiol,2004,30(4):374-384.
[19]IvanovH,MckenzieBS,ZhouL,etal.TheorphannuclearreceptorRORgammatdirectsthedifferentiationprogramofproinflammatoryIL-17+Thelpercells[J].Cell,2006(126):1121-1133.
[20]ChungIY,NorrisJG,BenvenisteEN.Differentialtumornecrosisfactoralphaexpressionbyastrocytesfromexperimentalallergicencephalomyelitis-susceptibleand-resistantratstrains[J].JExpMed,1991,173(4):801-811.
[21]KeatingP,O′sullivanD,TierneyJB,etal.ProtectionfromEAEbyIL-4Ralpha(-/-)macrophagesdependsuponTregulatorycellinvolvement[J].ImmunolCellBiol,2009,87(7):534-545.
[22]BaiXF,ShiFD,XiaoBG,etal.NasaladministrationofmyelinbasicproteinpreventsrelapsingexperimentalautoimmuneencephalomyelitisinDAratsbyactivatingregulatorycellsexpressingIL-4andTGF-betamRNA[J].JNeuroimmunol,1997,80(1/2):65-75.
[23]MesZ,StemJN,ReddyJ,etal.Modifiedaminoacidcopolymerssuppressmyelinbasicprotein85-99-inducedencephalomyelitisinhumanizedmicethroughdifferenteffectsonTcells[J].PNAS,2004,101(32):11749-11754.
[24]SonobeY,JinS,WangJ,etal.ChronologicalchangesofCD4+andCD8+Tcellsubsetsintheexperimentalautoimmuneencephalomyelitis,amousemodelofmultiplesclerosis[J].TohokuJExpMed,2007,213(4):329-339.
[25]MinagarA,AlexanderJS,SchwendimannRN,etal.Combinationtherapywithinterferonbeta-1aanddoxycyclineinmultiplesclerosis:anopen-labeltrial[J].ArchNeurol,2008,65(2):199-204.
[26]SuW,WanQ,HanL,etal.Doxycyclineexertsmultipleanti-allergyeffectstoattenuatemurineallergicconjunctivitisandsystemicanaphylaxis[J].BiochemPharmacol,2014,91(3):359-368.
Effect of doxycycline on Th1/Th2 cell balance and related cytokines in experimental allergic encephalomyelitis rats
XiaoFengjuan1,YangYuan2,XuXuejie1,LiZuoxiao2△
(1.DepartmentofNeurology,Mianyang404Hospital,Mianyang,Sichuan621000,China;2.DepartmentofNeurology,AffiliatedHospital,SouthwestMedicalUniversity,Luzhou,Sichuan646000,China)
Objective To investigate the effect of doxycycline on the Th1/Th2 cell balance in experimental allergic encephalomyelitis(EAE) rats.Methods Forty female Wistar rats were randomly divided into the EAE control group,low,medium and high does DOX treatment groups,10 cases in each group.The onset situation in rats was observed.The IL-4 and IFN-γ levels secreted by peripheral blood mononuclear cells (PBMC) at the peak stage were detected.The levels of IL-1β,IL-10,TNF-α in brain tissue,and the albumin content in cerebrospinal fluid and serum were detected.The QA value was calculated.Results In each DOX group,the clinical symptoms of rats were alleviated compared with the EAE control group.In each DOX group,the PBMC secreting IFN-γ level and IFN-γ/IL-4 ratio in the onset peak stage were lower than those in the EAE control group,while the IL-4 level was higher than that in the EAE control group(P<0.01).Compared with the medium-dose DOX group,the increase of IL-4 level in the high-dose DO group was unapparent(P>0.05),but the difference between other DOX groups had statistical significance(P<0.01).The IL-1β and TNF-α levels of brain tissue and QA value during onset peak stage in various doses DOX groups were decreased compared with the EAE control group,while the IL-10 level was increased compared with the EAE control group(P<0.05).With the DOX dose increasing,the levels of IL-1β,TNF-α and QA value in various doses DOX groups became lower,the IL-10 level became higher,there was statistically significant difference among various doses DOX groups (P <0.05 ).Conclusion DOX can obviously alleviate the clinical symptoms of EAE rats,its mechanism may be related with that DOX could decrease the level of Th1 cytokine and increase the level of Th2 cytokine,correct the Th1/Th2 cell balance,thus protect the blood brain barrier(BBB).
experimental allergic encephalomyelitis;doxycycline;Th1 cell;Th2 cell;QA;rats,Wistar
肖凤娟(1989-),硕士,主要从事神经免疫方面研究。△
E-mail:363373429qq.com。
��·基础研究
10.3969/j.issn.1671-8348.2017.01.008
R
A
1671-8348(2017)01-0044-04
2016-07-18
2016-08-18)



