苏艳军,刘 彬,刁 畅,张建明,钱 军,程若川
(昆明医科大学第一附属医院甲状腺外科 650032)
论着·基础研究
甲状腺术中甲状旁腺体外保存后自体移植对其功能影响的研究*
苏艳军,刘 彬,刁 畅,张建明,钱 军,程若川△
(昆明医科大学第一附属医院甲状腺外科 650032)
目的 研究甲状腺术中甲状旁腺自体移植过程中体外临时保存对其细胞活性和移植后功能的影响,以提高甲状旁腺自体移植的成活率。方法 (1)以实验家兔为研究对象,分为A、B、C 3组,每组8只。取出双侧下甲状旁腺,A组立即后续处理;B、C组分别置于4 ℃、室温(22~24 ℃)生理盐水中30 min。左侧甲状旁腺统一行HE染色,观察细胞形态;右侧甲状旁腺统一行透射电子显微镜检查,观察细胞超微结构变化。(2)实验家兔分为D、E、F 3组,每组8只,行双侧甲状腺全切除术后,取出双下甲状旁腺,D组立即移植(双侧颈前肌内,下同);E、F组分别置于4 ℃、室温(22~24 ℃)生理盐水中30 min后移植;3组动物于术前1 d,术后1、3、5、7 d抽血监测血钙、血PTH水平,并于第7天处死动物,切取移植的甲状旁腺组织行HE染色,高倍镜下观察甲状旁腺组织面积及病理损害。结果 正常甲状旁腺以主细胞为主,电镜下主细胞核圆、居中;4 ℃保存后甲状旁腺细胞形态未见明显变化,主细胞线粒体轻度肿胀;室温保存后甲状旁腺细胞稍肿胀,部分空泡变性,电镜下细胞核形态不规则,线粒体极度肿胀变形、嵴断裂、减少。动物双下甲状旁腺移植术后,血钙、血PTH均明显下降,之后逐渐上升;术后7 d两组间差异均有统计学意义(P<0.05);术后7 d D组:正常甲状旁腺细胞密集分布于颈前肌肉组织中;E组部分空泡变性;F组:只有部分健存甲状旁腺细胞散在分布于肌肉中。结论 离体甲状旁腺应保存在4 ℃生理盐水中,并尽可能在30 min内完成自体移植。
甲状旁腺;移植,自体;动物实验;保存
随着世界范围内甲状腺癌发病率的不断上升(韩国第1[1],我国第4[2]),甲状腺全切除及中央区淋巴结清扫已成为甲状腺癌主流的手术方式[3-4],术中喉返神经的常规显露和精细化被膜解剖及喉返神经监测仪的应用使得喉返神经的损伤率逐渐下降[5-8],而中央区淋巴结清扫后,甲状旁腺功能减退症就成为了最常见的并发症之一[9]。甲状旁腺的原位保留是目前公认的防止术后甲状旁腺功能减退的最佳方法,但对于A3型(完全位于甲状腺组织内)甲状旁腺及严重缺血、游离的甲状旁腺,自体移植是最后的弥补方法[10]。1975年Wells等[11]第1次报道甲状旁腺自体移植后,关于这方面的研究较多,文献报道甲状旁腺自体移植的成功率为55%~100%[12],差异较大,其原因可能为甲状旁腺移植数目的不同,甲状旁腺离体后体外保存对其活性的影响,还有移植方法的不同等。多个研究证实在甲状腺术中常规移植1~2颗甲状旁腺,几乎可以避免严重的永久性甲状旁腺功能低下[13]。甲状旁腺体外临时保存是自体移植过程中的一个重要环节,目前相关报道较少,值得深入研究以提高移植成活率。
1 材料与方法
1.1 材料 实验家兔48只(购于昆明医科大学动物实验中心),雌雄不限,每只2 500~3 000 g,每笼1只单独饲养于标准环境,自由进食。
1.2 方法 实验家兔分为A、B、C、D、E、F 6组,每组8只。3%戊巴比妥钠(购于昆明医科大学动物实验中心)1.0 mL/kg沿耳缘静脉缓慢注射麻醉,生效后,动物仰卧位固定,颈部备皮,碘伏消毒,于环状软骨下至胸骨切迹上2 cm做纵向切口,依次切开皮肤、皮下组织、颈白线,暴露气管,于环状软骨下甲状腺周围、气管食管沟及颈鞘内探查、显露甲状旁腺,见图1。
手术切取A、B、C 3组实验动物双下甲状旁腺。A组(对照组):甲状旁腺立即后续处理;B组(冷缺血组):甲状旁腺放置于4 ℃生理盐水中30 min;C组(热缺血组):甲状旁腺放置于室温(22~24 ℃)生理盐水中30 min。左侧甲状旁腺统一行HE染色,观察细胞形态;右侧甲状旁腺统一行透射电子显微镜检查,观察甲状旁腺细胞内细胞核、线粒体等超微结构变化。
D、E、F 3组,行双侧甲状腺全切除术后,切取双下甲状旁腺,D组甲状旁腺立即用精细剪将腺体剪成体积约1 mm3的碎粒,在颈前肌钝性分离形成“口袋”,将甲状旁腺移植其内,并用不可吸收线缝合做标记;E组甲状旁腺放置于4 ℃生理盐水中30 min后处理同D组;F组甲状旁腺放置于室温(22~24 ℃)生理盐水中30 min后处理同D组。D、E、F 3组动物于术前1 d,术后1、3、5、7 d抽血监测血钙(微板比色法)、血PTH[酶联免疫吸附试验(ELISA)]水平,并于第7天处死动物切取移植的甲状旁腺组织行HE染色,高倍镜下观察甲状旁腺组织面积及病理损害。

2 结 果
2.1 A组、B组、C组HE染色及镜检情况 (1)A组:HE染色,甲状旁腺以主细胞为主,伴少许嗜酸细胞,细胞巢周围有脂肪组织浸润(图2A);透射电子显微镜检查,可见细胞核圆、居中,超微结构未见明显改变(图2B)。(2)B组:HE染色,甲状旁腺细胞形态无明显改变,少量空泡变性(1%~5%)(图2C);透射电子显微镜检查,甲状旁腺细胞核圆、居中,线粒体肿胀、嵴断裂、灶性空化,可见分泌颗粒(图2D)。(3)C组:HE染色,甲状旁腺细胞部分空泡变性(5%~10%),局部腺泡间纤维组织增生(5%~10%)(图2E);行透射电子显微镜检查,甲状旁腺细胞核形态不规则、细胞质内可见大量空泡样结构(图2F),线粒体极度肿胀、嵴断裂、减少,可见分泌颗粒(图2G)。
2.2 D、E、F 3组血钙的变化 D、E、F 3组血钙术后均低于术前水平,差异有统计学意义(P<0.05),以术后1 d最低,并呈缓慢恢复趋势;3组间不同时间点血钙在术前1 d、术后1、3、5 d差异均无统计学意义(P>0.05),但术后7 d两组间差异均有统计学意义(P<0.05),见表1。
A:甲状腺(白色箭头),甲状旁腺(黑色箭头);B:精细剪将甲状旁腺腺体剪成体积约1 mm3的碎粒;C:将腺体移植于颈前肌“口袋”内(黑色箭头);D:用4-0不可吸收线缝合并标志移植处(黑色箭头)。
图1 甲状腺自体移植方法 表1 3组血钙变化情况
#:P<0.05,与术前比较;@:P<0.05,与D组同时间点比较;*:P<0.05,与E组同时间点比较。
2.3 D、E、F 3组血PTH的变化 D、E、F 3组血PTH术后均低于术前水平,差异有统计学意义(P<0.05),以术后1 d最低,并呈缓慢恢复趋势;3组间不同时间点血PTH在术前1 d、术后1、3、5 d血钙差异均无统计学意义(P>0.05),术后7 d D、E两组间差异均无统计学意义(P>0.05),而F组与D、E两组差异均有统计学意义(P<0.05),见表2。
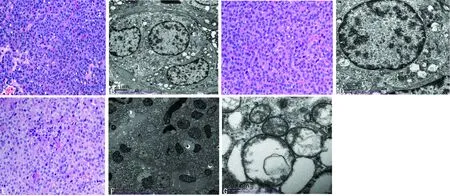
A:甲状旁腺以主细胞为主,伴少许嗜酸细胞,细胞巢周围有脂肪细胞浸润(HE,×400);B:甲状旁腺主细胞核圆、居中(电镜,×5 000);C:甲状旁腺细胞形态无明显改变,少量空泡变性(HE,×400);D:线粒体稍肿胀、核断裂(电镜,×10 000);E:甲状旁腺部分空泡变性,局部腺泡间纤维组织增生(HE,×400);F:甲状旁腺细胞核不规则变形,包浆内可见大量空泡样结构(电镜,×1 500);G:线粒体极度肿胀、嵴断裂、减少(电镜,×50 000)。
图2 甲状腺体外保存后并病理改变 表2 3组血PTH变化情况
#:P<0.05,与术前比较;@:P<0.05,与D组同时间点比较;*:P<0.05,与E组同时间点比较。

A:D组;B:E组;C:F组。
图3 甲状腺自体移植后病理改变
2.4 D、E、F 3组术后7 d时甲状旁腺病理结果 D组自体移植的甲状旁腺组织大量存活下来,密集分布于颈前肌肉中,细胞形态无明显改变(图3A);E组甲状旁腺细胞同样存活较多,但部分空泡变性(图3B);F组甲状旁腺细胞呈散在分布于肌肉中,部分细胞坏死,健存细胞密度明显低于D、E组(图3C)。3 讨 论
在尿毒症晚期继发性甲状旁腺功能亢进患者手术方式之一就是甲状旁腺全切除,为预防术后持续性甲状旁腺功能低下,通常将部分甲状旁腺组织冰冻保存,需要时再进行移植,常用的保存介质为RPMI1640培养基,也有报道术中将甲状旁腺组织临时保存在DMEM中来维持其活性,胎儿甲状旁腺在液氮中保存90 d后异体移植仍能存活[14-16]。由于甲状腺术中甲状旁腺体外保存时间相对较短,通常为术中快速冰冻所需时间,将其保存在培养基中操作过程复杂且耗时较长,因此不适合术中即刻、短暂的保存,生理盐水廉价、方便、易取,目前临床最常用,所以本实验仍然选择生理盐水作为保存介质。
另一因素就是保存温度,甲状旁腺在离体后理论上就形成了“热缺血”损伤,借鉴其他器官移植研究,为了减少“热缺血”损伤,通常将待移植器官保存在0~4 ℃灌注液中,因此本研究将离体甲状旁腺保存在4 ℃生理盐水中,30 min后,甲状旁腺细胞形态未见明显改变,电镜下也只有少量线粒体肿胀、嵴断裂;而在室温保存30 min后,甲状旁腺细胞开始肿胀、空泡变性增多,电镜下细胞核变形、不规则,线粒体极度肿胀、减少。再者为体外临时保存的时间,有研究在甲状旁腺延时自体移植中证明保存时间是移植成功率的关键因素,同样本实验也观察到甲状旁腺组织在体外保存30 min后开始出现空泡变性,细胞核变形,细胞内线粒体肿胀、嵴断裂等细胞失活表现的改变。
甲状旁腺作为内分泌腺体,其作用就是分泌PTH,从而调节机体钙、磷代谢,进行自体移植后体内循环的血PTH、血钙能间接地反映移植后功能恢复情况,而切除后的病理检查更是直接、客观地反映出细胞存活与否。从D、E、F 3组实验结果:甲状旁腺自体移植均存活,实验动物血钙、血PTH均在逐渐的上升恢复,术后第7天时,D组恢复最快,E组次之,F组最慢;病理结果:D、E组甲状旁腺细胞均大量存活,而F组甲状旁腺细胞部分健存于肌肉组织中。可以看出:不同的体外保存方式对甲状旁腺自体移植后的存活情况是有影响的。
甲状腺手术中甲状旁腺的自体移植是避免术后永久性甲状旁腺功能减退的重要方法,术中甲状旁腺体外临时保存是移植过程中的重要环节,从实验可以看出体外保存时间、温度都是影响其活性的重要因素,那么在临床工作中应该尽量减少其在体外保存时间。因此,笔者建议对术中可疑甲状旁腺组织务必及时送检,同时联系病理科做到优先处理,在等待结果的过程中应保存在4 ℃生理盐水中,并尽量在30 min内进行移植,最大程度地维持其细胞活性,对于术中明确是甲状旁腺组织的可以不再经病理确认,立即移植以提高自体移植的成活率。
[1]Jung KW,Won YJ,Kong HJ,et al.Cancer statistics in Korea:incidence,mortality,survival,and prevalence in 2012[J].Cancer Res Treat,2015,47(2):127-141.
[2]刘玉琴,张书全,陈万青,等.中国2003-2007 年甲状腺癌发病死亡现状及流行趋势分析[J].中华流行病学杂志,2012,33(10):1044-1048.
[3]Yoshida A.Guidelines for the management of thyroid tumors[J].Nihon Geka Gakkai Zasshi,2012,113(6):507-511.
[4]孙荣昊,李超,樊晋川,等.中央区淋巴清扫术对初治分化型甲状腺癌临床价值的Meta分析[J].中华耳鼻咽喉头颈外科杂志,2014,49(2):157-164.
[5]张海添,陆云飞,廖清华,等.甲状腺手术中显露喉返神经价值的Meta分析[J].中华普通外科杂志,2005,20(4):204-206.
[6]孙辉,刘晓莉,连丽新,等.喉返神经术中监测的原理与应用[J].中国医学文摘(耳鼻咽喉科学),2012,27(3):137-140.
[7]孙辉.甲状腺及甲状旁腺手术中神经电生理监测临床指南(中国版)[J].中国实用外科杂志,2013,8(6):470-474.
[8]Dionigi G,Barczynski M,Chiang FY,et al.Why monitor the recurrent laryngeal nerve in thyroid surgery?[J].J Endocrinol Invest,2010,33(11):819-822.
[9]Giordano D,Valcavi R,Thompson GB,et al.Complications of central neck dissection in patients with papillary thyroid carcinoma:results of a study on 1087 patients and review of the literature[J].Thyroid,2012,22(9):911-917.
[10]朱精强.甲状腺手术中甲状旁腺保护专家共识[J].中国实用外科杂志,2015,35(7):731-736.
[11] Wells SA,Gunnells JC,Shelburne JD.Transplantation of the parathyroid 91ands in man:clinical indications and results[J].Surg,1975(78):34-44.
[12]Reeve T,Thompson NW.Complications of thyroid surgery:how to avoid them,how to manage them,and observations on their possible effect on the whole patient[J].World J Surg,2000,24(8):971-975.
[13]Testini M,Rosato L,Avenia N,et al.The impact of single parathyroid gland autotransplantation during thyroid surgery on postoperative hypoparathyroidism:a multicenter study[J].Transplant Proc,2007,39(1):225-230.
[14]De Menezes Montenegro FL,Custódio MR,Arap SS,et al.Successful implant of long-term cryopreserved parathyroid glands after total parathyroidectomy[J].Head Neck,2007,29(3):296-300.
[15]Barreira CE,Cernea CR,Brandão LG,et al.Effects of time on ultrastructural integrity of parathyroid tissue before cryopreservation[J].World J Surg,2011,35(11):2440-2444.
[16]刘仁斌.经裸鼠中间过渡胎儿甲状旁腺同种移植[D].广州:中山医科大学,1992.
Study on the effect of temporary in vitro preservation of parathyroid on auto-transplantation during thyroid surgery*
SuYanjun,LiuBin,DiaoChang,ZhangJianming,QianJun,ChengRuochuan△
(DepartmentofThyroidSurgery,theFirstAffiliatedHospitalofKunmingMedicalUniversity,Kunming,Yunnan650032,China)
Objective To study the effect of temporary in vitro preservation of parathyroid on the activity of cells in the process of parathyroid auto-transplantation and function of postoperative in order to improve the survival rate of transplantation.Methods (1)Experimental rabbits for the study were randomly divided into three groups:group A,group B,group C,with 8 rabbits in each group.Then we remove the bilateral inferior parathyroid,in group A,the parathyroid glands were immediately formaldehyde-fixed;in group B and group C,the parathyroid glands were placed in normal saline in 4 ℃ and in room temperature (22-24 ℃) for 30 minutes respectively and then fixed;HE staining was performed on the left parathyroid glands to observe the morphology of the cells;Electron microscopic examination of the right parathyroid glands were performed to observe the ultrastructural changes of the cells.(2)Experimental rabbits were randomly divided into three groups:group D group E and group F,with 8 rabbits in each group,after total thyroidectomy,the double inferior parathyroid glands were took out,in group D,the parathyroid glands were immediately transplanted in bilateral anterior cervical muscles;in group E and group F,the parathyroid glands were placed in normal saline 4 ℃ and in room temperature (22-24 ℃) for 30 minutes respectively and then transplanted.All animals were monitored of serum calcium and PTH on preoperative 1 d and postoperative 1 d,3 d,5 d,7 d;the parathyroid was took out for HE staining to observed survival of parathyroid tissue and pathology damage when 7d after operation.Results (1)The normal parathyroid gland is mainly dominated by the chief cells,the nucleus of the chief cell was round and centered under electron microscope;there were no significant change in the morphology of parathyroid cells,and the mitochondria of the cells were slightly swollen under 4 ℃;but the parathyroid gland cells were slightly swollen and partially vacuole degeneration,the morphology of the nucleus was irregular,and the mitochondria were extremely swollen and deformed,and the ridge was broken under room temperature.(2)three groups of rabbits after transplantation of parathyroid,serum calcium and PTH decreased significantly,and increased gradually,there was significant difference on the 7th day after the operaion between the two groups (P<0.05);(3)in group D,the normal parathyroid cells densely distributed in the anterior cervical muscle tissue;in group E,A large number of parathyroid cells survived in muscle tissue,with some vacuolated;in group F,only part of healthy parathyroid cells scattered in the muscle.Conclusion Parathyroid should be preserved in 4 ℃ normal saline during the operation,and the transplant should be completed in 30 minutes as far as possible.
parathyroid glands;transplantation,autologous;animal experiment;in vitro preservation
10.3969/j.issn.1671-8348.2017.08.008
云南省卫生科技计划项目(2016NS056)。 作者简介:苏艳军(1980-),讲师,博士,主要从事甲状腺、甲状旁腺的基础与临床研究。△
,E-mail:cruochuan@foxmail.com。
R653
A
1671-8348(2017)08-1032-04
2016-10-18
2016-12-10)



