王 春,魏含清,裴轶劲
(广东医科大学基础医学院生理学教研室/干细胞与再生医学研究所,广东东莞 523808)
·论 着· doi:10.3969/j.issn.1671-8348.2017.19.003
低氧培养对小鼠胚胎成纤维细胞生长和线粒体分布及功能的影响
王 春,魏含清,裴轶劲△
(广东医科大学基础医学院生理学教研室/干细胞与再生医学研究所,广东东莞 523808)
目的 研究低氧培养条件对小鼠胚胎成纤维细胞(MEFs)的生长和线粒体分布及功能的影响。方法 将MEFs分为20%氧浓度的常氧培养组和5%氧浓度的低氧培养组连续培养,每24小时采用台盼蓝染色对MEFs活细胞计数;Mito-Tracker Green对细胞线粒体染色并在激光共聚焦显微镜下观察;腺苷三磷酸(ATP)试剂盒检测ATP合成。结果 对数生长期低氧培养组活细胞数高于常氧培养组,差异有统计学意义(P<0.05);并且低氧培养组细胞内线粒体核周分布型比例高于常氧培养组,差异有统计学意义(P<0.05);同时两组细胞内ATP水平比较,差异有统计学意义(P<0.05)。结论 低氧培养条件影响线粒体在MEFs细胞内的分布和能量的合成,对细胞生长的促进作用高于常氧培养。
低氧;小鼠胚胎成纤维细胞;线粒体分布;腺苷三磷酸
氧是细胞必要的生存条件,是细胞增殖、分化、凋亡等生理功能调节的重要的因素。大多数细胞体外培养是将细胞置于与空气中氧浓度近似的常氧条件下进行[1]。体外细胞培养系统往往是模拟体内环境建立起来的,但大多数培养系统都采取与空气中的氧浓度一致的培养条件。但在正常的生理状况下体内细胞组织所处的微环境与体外环境是有区别的,因此逐渐有研究尝试降低氧浓度对细胞进行培养并且已证明不同的氧浓度对细胞状态的影响[2-7]。线粒体是存在于真核细胞中的细胞器,是维持生命活动的能力工厂,是除细胞核外唯一具有遗传效应的细胞器,其主要功能是合成腺苷三磷酸(ATP)。目前已有研究表明线粒体的特征与卵母细胞的成熟[8-9]、干细胞的“干性”维持[10]及分化[11-12]有非常密切的联系。线粒体形态、膜电位、能量代谢等参数在卵母细胞成熟前后,以及干细胞分化前后有非常明显的变化[10,13]。
小鼠胚胎成纤维细胞(mouse embryonic fibroblasts,MEFs)应用广泛,在胚胎干细胞和诱导性多能干细胞的培养中,经过丝裂霉素或γ射线处理终止生长后作为支撑干细胞生长的滋养层使用[14-16]。滋养层的质量好坏关乎着干细胞的生长,如何建立稳定高效的MEFs培养体系仍在不断地尝试中。MEFs的常规培养是在常氧条件下,对MEFs在低氧培养条件下的生长状况及线粒体的研究较少。本实验在低氧条件下培养MEFs,观察其生长、线粒体分布及功能等指标的变化,有助于进一步阐明低氧条件下线粒体分布与能量代谢的关系,为优化培养条件提供相关证据,并为MEFs培养体系的优化及后续干细胞的研究提供实验依据。
1 材料与方法
1.1 材料 DMEM培养基、杜氏磷酸盐缓冲液(DPBS)、0.25%Trypsin-乙二胺四乙酸(EDTA)、胎牛血清(FBS)均购于美国Gibco公司;ATP Colorimetric/Fluorometric Assay Kit试剂盒购于美国Sigma公司;Mito-Tracker Green试剂盒购于中国碧云天公司。
1.2 方法
1.2.1 MEFs的分离培养与分组 取怀孕13.5~14.5 d昆明孕鼠,脱颈处死,在无菌条件下将鼠胚从孕鼠体内分离,去除头、尾、四肢及内脏后剪碎并用胰蛋白酶消化收集细胞悬液,1 500 r/min离心5~10 min后去上清液,用含10%FBS的DMEM培养基重悬细胞,铺入培养瓶中,放入37 ℃、5%CO2恒温培养箱中培养。每2~3天换液1次,细胞生长至对数生长期传代,传代比例为1∶3至1∶6。MEFs以相同的密度传代接种至培养皿中,分为常氧培养组(37 ℃、5%CO2、20%O2)和低氧培养组(37 ℃、5%CO2、5%O2),连续培养1个生长周期,每天相差显微镜下观察。
1.2.2 MEFs生长曲线的绘制 采用台盼蓝染色法,按1.76×104/cm2的密度传代接种至培养皿中,连续培养;每24小时取各组3个皿计数,实验重复3次。0.05%胰蛋白酶消化细胞,制备成细胞悬液,台盼蓝染色后血球计数板计数。然后以时间为横坐标,活细胞数为纵坐标绘制MEFs生长曲线。
1.2.3 MEFs线粒体分布类型鉴定 每隔24小时各组取3个皿用Mito-Tracker Green染色[10-11]。根据说明书按照1∶5 000的比例将1 mmol/L Mito-Tracker Green储存液与MEFs完全培养基混合配制成Mito-Tracker Green染色工作液,37 ℃孵育45 min,去除Mito-Tracker Green染色工作液加入37 ℃预温的新鲜MEFs完全培养基,在荧光显微镜或激光共聚焦显微镜下488 nm处观察。在低倍视野中选取3个不同的视野,观察视野中细胞内线粒体的分布类型并计算各类型的百分比。鉴定时,染色效果不佳、细胞部分结构不在视野内、细胞结构不完整,以及细胞重叠导致无法辨别线粒体分布类型的细胞不在鉴定的范围之内。实验重复3次。
1.2.4 细胞内ATP水平检测 用ATP Colorimetric/Fluorometric Assay Kit对细胞内ATP水平进行测定,根据试剂盒说明制作ATP标准曲线。每隔24小时收集各组细胞,用100 μL ATP Assary Buffer裂解1×106个细胞,去除蛋白后加入相应体积ATP反应液,混合均匀避光孵育30 min,多功能酶标仪检测570 nm处吸光度(A)值,根据ATP标准曲线计算每1×106细胞中的ATP水平。实验重复3次。
2 结 果
2.1 常氧和低氧条件对MEFs生长的影响 MEFs在传代后第2天开始进入对数生长期,活细胞量急剧增加;第5天活细胞数达到最高峰,之后细胞进入衰老期,MEFs活细胞数开始减少;第8天后,活细胞数趋于稳定。同时,在低氧环境下MEFs的活细胞量始终高于常氧培养的细胞,并在MEFs对数生长期细胞增殖速度相对常氧培养逐渐增大(图1)。传代后第1~3天及第6~7天低氧培养组的MEFs活细胞数与常氧培养组的MEFs活细胞数比较,差异无统计学意义(P>0.05);传代后第4~5天和第8~10天低氧培养组的MEFs活细胞数与常氧培养组的MEFs活细胞数比较,差异有统计学意义(P<0.05),见表1。
2.2 常氧、低氧培养生长周期中线粒体分布类型变化 在整个生长周期中,无论是常氧还是低氧培养,MEFs细胞内线粒体形态多为杆状,线粒体分布类型多样。根据线粒体在细胞内分布状况将其主要分为:(1)线粒体核周分布型,该类型细胞中线粒体集中分布于细胞核周围,越往细胞膜方向线粒体的荧光强度逐渐减弱甚至消失(图2A、2D);(2)线粒体均匀分布型,该类型细胞中线粒体均匀分布于细胞质中,细胞质中线粒体的荧光强度无明显变化(图2B、2E);(3)线粒体聚集分布型,该类型细胞中线粒体聚集于细胞质某些部位,线粒体荧光强度比其他部位明显增强,并且细胞内线粒体荧光强度变化无明显规律(图2C、2F)。
表1 MEFs在常氧和低氧培养下的细胞数比较
-:无数据
细胞传代贴壁后,细胞内线粒体分布类型开始以核周分布为主,随着细胞培养时间延长,线粒体均匀分布类型所占比例逐渐上升;线粒体聚集分布类型在细胞内的比例一直相对较小,但也随细胞培养时间延长而增加。贴壁第1天常氧培养组细胞线粒体核周分布型占74.4%,在低氧培养组细胞中占72.5%;第4天开始常氧培养组细胞线粒体核周分布型所占比例低于50.0%,第5天开始低氧培养组细胞线粒体核周分布型所占比例低于50.0%,相反线粒体均匀分布型比例超过50.0%(表2)。经统计学分析,常氧和低氧培养组MEFs在第4~5天线粒体核周分布型、均匀分布型比例比较,差异有统计学意义(P<0.05);同一天低氧培养组细胞线粒体核周分布型所占比例高于常氧培养组细胞,低氧培养组细胞线粒体均匀分布型所占比例则要低于常氧培养条件(图3)。
2.3 常氧、低氧培养对MEFs生长周期中ATP水平的改变 常氧和低氧培养组MEFs中ATP水平贴壁第1天开始往下降,至第5天降为最低,然后急剧上升,至第7天达到最高,第8天再下降;MEFs传代贴壁生长第1天,常氧培养组细胞ATP水平高于低氧培养组,自第2天起,低氧培养组细胞ATP水平高于常氧培养组(图4A、B);常氧和低氧培养组MEFs细胞内ATP水平在传代后第1~3天和第9天比较,差异无统计学意义(P>0.05);MEFs在第4~8天对数生长期和第10天衰老期,常氧和低氧培养组细胞内ATP水平比较,差异有统计学意义(P<0.05或P<0.01),见表3。
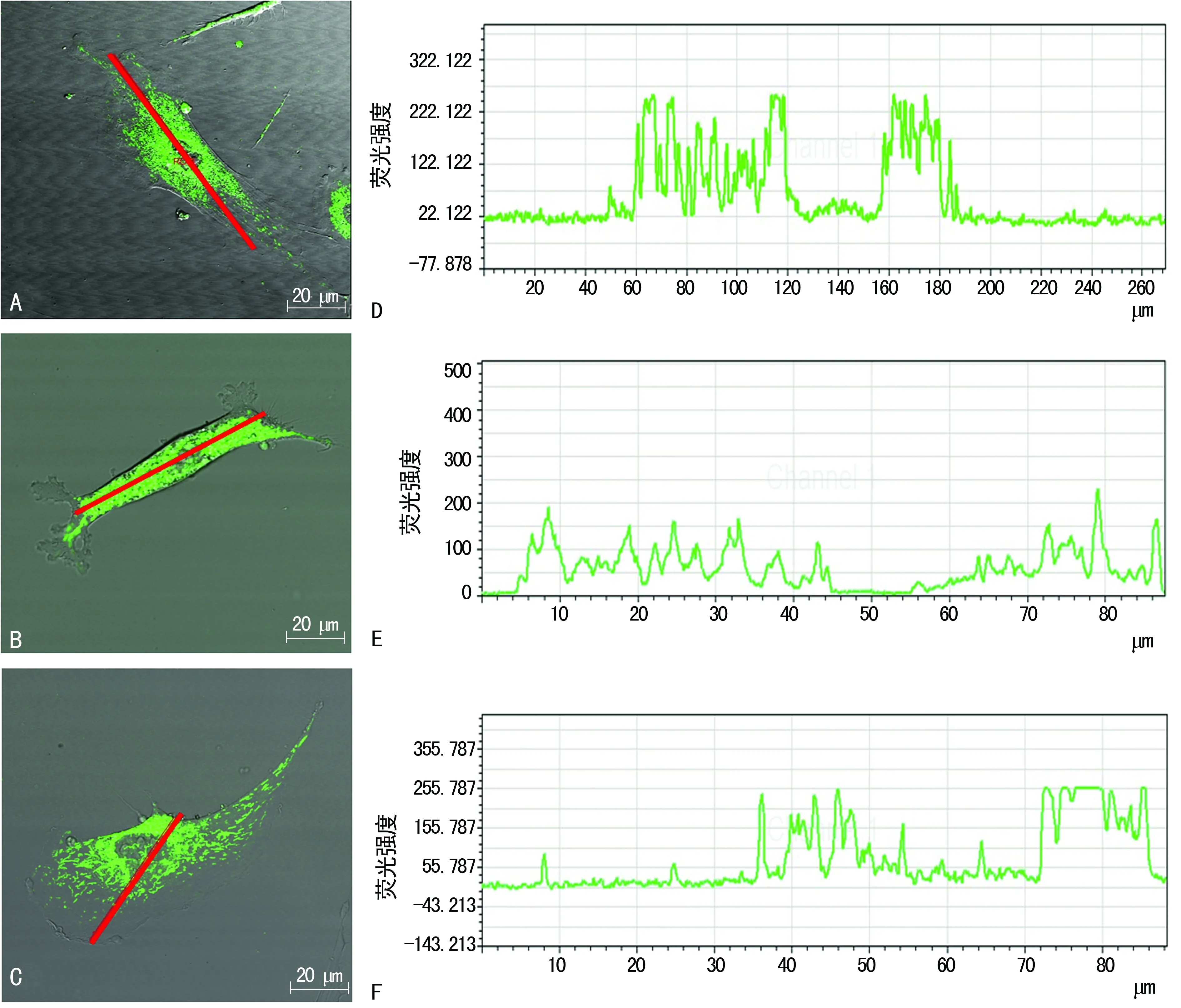
A:线粒体核周分布型;B:线粒体均匀分布型;C:线粒体聚集分布型;D:核周分布型线粒体荧光强度;E:均匀分布型线粒体荧光强度;F:聚集分布型线粒体荧光强度;标尺为20 μm,红色线条为荧光强度检测位置
图2 MEFs细胞线粒体分布类型
*:P<0.05,与同一天低氧培养组比较
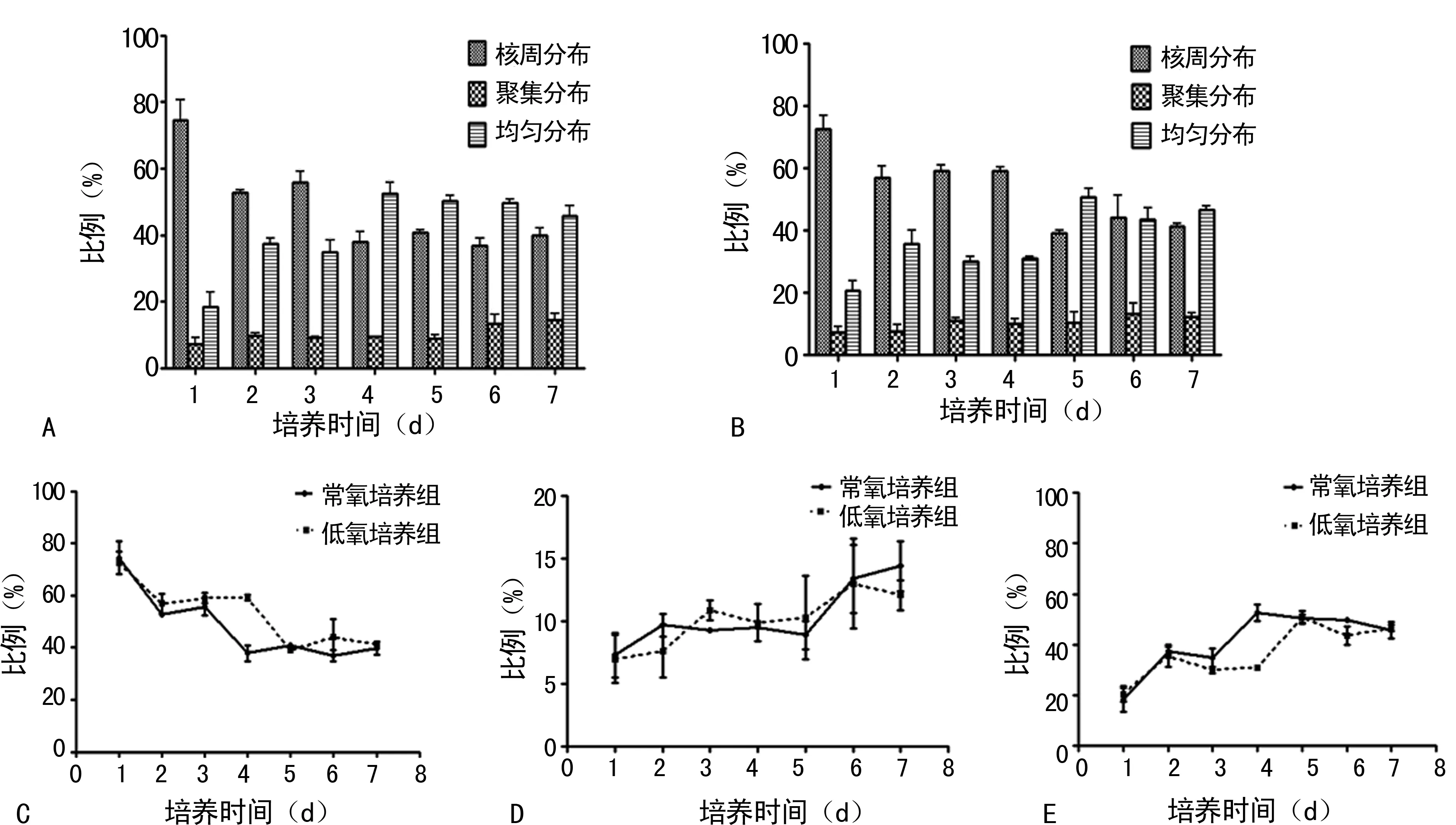
A:常氧培养组细胞线粒体分布类型变化;B:低氧培养组细胞线粒体分布类型变化;C:线粒体核周分布类型变化;D:线粒体均匀分布类型变化;E:线粒体聚集分布类型变化
图3 随培养时间延长在常氧和低氧培养下的MEFs线粒体分布类型变化
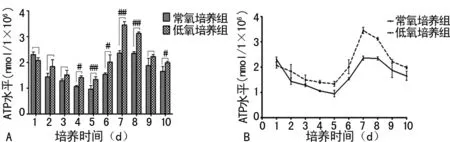
A:常氧和低氧培养的MEFs在不同时间ATP水平柱状图;B:常氧和低氧培养的MEFs在不同时间ATP水平折线图;#:P<0.05,差异有统计学意义;##:P<0.01,差异有统计学意义
图4 常氧和低氧培养随时间MEFs细胞内ATP水平变化
3 讨 论
氧气在细胞生命活动中是必不可少的因素,目前细胞体外培养体系大部分提供的氧气浓度与空气中的氧浓度一致,但在正常的生理状况下体内细胞组织所处的微环境与体外环境是有区别的,例如:动脉血中氧浓度为12%,成年人组织中平均氧浓度为3%~5%[17-18]。因此关于不同氧浓度对细胞影响的研究也取得了一定的成果,这包括干细胞[2-3]、成体细胞[4]等。在对成体干细胞体外培养时发现,包括神经干细胞、间充质干细胞、造血干细胞等,在低氧环境中细胞增殖、存活率、集落生成、分化能力有明显的提升[5-7]。
线粒体是细胞质中广泛分布的细胞器。有研究指出,在卵母细胞成熟过程中线粒体的功能成熟是细胞质成熟的一个重要指标,其分布和代谢活性是细胞质成熟的重要标志,并且在成熟的细胞质中具有线粒体重分布的能力[8];并指出影响线粒体分布很重要的一个因素就是卵母细胞的成熟和胚胎的发育[19],线粒体在未成熟的细胞中以周边分布为主,而成熟的细胞则以均匀分布为主。也有研究者提出,线粒体的特征可作为干细胞性能维持的“干性”指标,在干细胞增殖分化的过程中,线粒体有着较明显的变化,线粒体形态、定位等特性是评定多能性干细胞是否具备多能性的标志[10]。有研究显示,在小鼠胚胎干细胞向心肌细胞分化的研究过程中发现,分化后细胞的线粒体膜电位、活性氧(ROS)水平及线粒体钙含量等参数要低于分化前的细胞,证实了小鼠胚胎干细胞分化后线粒体功能下降[13]。同时还有研究表明,线粒体动力学和分布的正常运行对细胞生存是至关重要的,尤其是神经细胞[20]。
线粒体是细胞进行生命活动的主要能量来源,细胞通过线粒体的氧化磷酸化生成ATP供能,在低氧环境中线粒体氧化磷酸化过程受到抑制影响ATP的生成。但是有研究证明,在缓慢持续的低氧环境中线粒体的功能会得到恢复。本研究结果显示,MEFs在转入低氧环境中后,ATP水平出现了下降的现象,随时间的增加,ATP水平逐渐上升。这也说明线粒体功能在低氧初期受到了一定的影响,后期功能恢复正常。
MEFs传代贴壁,处于分裂增殖旺盛期时,细胞核相对细胞质活跃,线粒体需要围绕细胞核为细胞的分裂增殖提供大量的能量,线粒体主要分布在细胞核周围;绝大多数细胞呈现出典型的线粒体核周分布类型。MEFs经过对数生长期的生长与增殖,细胞数量增多,细胞密度增大,在一定程度上抑制了细胞的分裂,在此期间,细胞产生的能量更多的是为了维持细胞的形态和各项功能的正常,所以细胞质相对细胞核较为活跃,大多数线粒体表现为均匀分布型,为维持细胞的正常生理功能提供能量。相对常氧培养环境,低氧环境对细胞分裂增殖的促进作用更为明显,线粒体核周分布状态持续时间更长,在细胞分裂增殖期间,线粒体生成的ATP水平更高,这有利于细胞的分裂、增殖。本研究结果中,低氧培养条件下MEFs在经过细胞的分裂增殖后活细胞数量多于常氧培养也证实了这一说法。
综上所述,低氧培养条件对MEFs生长和线粒体分布及功能具有较大的影响。但对于低氧培养条件影响MEFs线粒体功能的相关机制还需要更进一步的研究。
[1]Weidmann C,Pomerleau J,Trudel-Vandal L,et al.Differential responses of choroidal melanocytes and uveal melanoma cells to low oxygen conditions[J].Mol Vis,2017,12(23):103-115.
[2]Zhao T,Zhang CP,Liu ZH,et al.Hypoxia-driven proliferation of embryonic neural stem/progenitor cells - role of hypoxia-inducible transcription factor-1 alpha[J].FEBS J,2008,275(8):1824-1834.
[3]Estrada JC,Albo C,Benguria A,et al.Culture of human mesenchymal stem cells at low oxygen tension improves growth and genetic stability by activating glycolysis[J].Cell Death Differ,2012,19(5):743-755.
[4]Dai T,Zheng H,Fu GS.Hypoxia confers protection against apoptosis via the PI3K/Akt pathway in endothelial progenitor cells[J].Acta Pharmacol Sin,2008,29(12):1425-1431.
[5]Morrison SJ,Csete M,Groves AK,et al.Culture in reduced levels of Oxygen promotes clonogenic sympathoadrenal differentiation by isolated neural crest stem cells[J].J Neurosci,2000,20(19):7370-7376.
[6]Deschepper M,Oudina K,David B,et al.Survival and function of mesenchymal stem cells (MSCs) depend on glucose to overcome exposure to long-term,severe and continuous hypoxia[J].J Cell Mol Med,2011,15(7):1505-1514.
[7]Roy S,Tripathy M,Mathur N,et al.Hypoxia improves expansion potential of human cord blood-derived hematopoietic stem cells and marrow repopulation efficiency[J].Eur J Haematol,2012,88(5):396-405.
[8]刘姗,李媛,高选,等.人卵母细胞体外成熟前后线粒体分布的变化[J].解剖学报,2007,38(5):593-596.
[9]Takahashi Y,Hashimoto S,Yamochi T,et al.Dynamic changes in mitochondrial distribution in human oocytes during meiotic maturation[J].J Assist Reprod Genet,2016,33(7):929-938.
[10]Lonergan T,Brenner C,Bavister B.Differentiation-related changes in mitochondrial properties as indicators of stem cell competence[J].J Cell Physiol,2006,208(1):149-153.
[11]Xu XL,Duan SL,Yi F,et al.Mitochondrial regulation in pluripotent stem cells[J].Cell Metab,2013,18(3):325-332.
[12]Prowse AB,Chong F,Elliott DA,et al.Analysis of mitochondrial function and localisation during human embryonic stem cell differentiation in vitro[J].PLoS One,2012,7(12):e52214.
[13]Heo HJ,Kim HK,Youm JB,et al.Mitochondrial pyruvate dehydrogenase phosphatase 1 regulates the early differentiation of cardiomyocytes from mouse embryonic stem cells[J].Exp Mol Med,2016,48(8):e254.
[14]Jasmin,Peters VM,Spray DC,et al.Effect of mesenchymal stem cells and mouse embryonic fibroblasts on the development of preimplantation mouse embryos[J].In Vitro Cell Dev Biol Anim,2016,52(4):497-506.
[15]Yang H,Qiu Y,Zeng X,et al.Effect of a feeder layer composed of mouse embryonic and human foreskin fibroblasts on the proliferation of human embryonic stem cells[J].Exp Ther Med,2016,11(6):2321-2328.
[16]Takahashi Y,Hashimoto S,Yamochi T,et al.Dynamic changes in mitochondrial distribution in human oocytes during meiotic maturation[J].J Assist Reprod Genet,2016,33(7):929-938.
[17]Hardman JG,AL-Otaibi HM.Prediction of arterial Oxygen tension:validation of a novel formula[J].AM J Respir Crit Care Med,2010,182(3):435-436.
[18]Silver I,Erecińska M.Oxygen and ion concentrations in normoxic and hypoxic brain cells[J].Adv Exp Med Biol,1998,454:7-16.
[19]Dos Santos F,Andrade PZ,Boura JS,et al.Ex vivo expansion of human mesenchymal stem cells:a more effective cell proliferation kinetics and metabolism under hypoxia[J].J Cell Physiol,2010,223(1):27-35.
[20]Walczak J,Szczepanowska J.Dysfunction of mitochondrial dynamic and distribution in Amyotrophic Lateral Sclerosis[J].Postepy Biochem,2015,61(2):183-190.
Effects of hypoxia on the growth,mitochondria distribution and function of mouse embryonic fibroblast*
WangChun,WeiHanqing,PeiYijin△
(PhysiologyTeachingandResearchSection,InstituteofStemCellandRegenerativeMedicine/DepartmentofBasicMedicalSciences,GuangdongMedicalCollege,Dongguan,Guangdong523808,China)
Objective To explore the effects of hypoxia on the growth,mitochondria distribution and function of mouse embryonic fibroblasts(MEFs).Methods MEFs were sub-cultured in the hypoxia group containing 5% oxygen and normal oxygen group containing 20% oxygen,every 24 hours,living MEFs were counted by using trypan blue staining.Mito-Tracker Green was used to stain mitochondria,then cells were observed by using laser confocal microscope.The ATP kit was used to detect ATP synthesis.Results During the logarithmic phase,the numbers of living cells in the hypoxia group were higher than those in the normal oxygen group,the differences were statistically significant (P<0.05).The percentages of perinuclear mitochondrial in the hypoxia group were higher than those in the normal oxygen group,the differences were statistically significant (P<0.05).Meanwhile,the significant difference was found in the ATP level between the two groups (P<0.05).Conclusion The distribution of mitochondria in MEFs and energy synthesis are influenced by the hypoxic culture condition,which could be better for promoting cell growth compared with normal oxygen culture condition.
hypoxia;mouse embryonic fibroblasts;mitochondrial distribution;adenosine triphosphate
国家自然科学基金项目(81173136);广东省科技计划项目(2013B022000003);广东省基础与应用基础研究专项(广东省自然科学基金)(2015A030313524);广东省东莞市国际科技合作(含港澳台)项目(2015508102004)。 作者简介:王春(1990-),在读硕士,主要从事干细胞与发育毒性方面的研究。△
,E-mail:pyj@gdmu.edu.cn。
R394.1;R329.2+5
A
1671-8348(2017)19-2599-05
2017-02-03
2017-04-08)



