杨光磊,胡岩芳,赵 珊,葛国庆,胡延伟,霍彩娟,彭林涛
(1.邢台市人民医院普外科,河北邢台 054031;2.邢台市人民医院神经内科,河北邢台 054031;3.河北医科大学第二医院肿瘤内科,石家庄 050000)
2016年度重庆市出版专项资金资助项目
低氧条件下HIF-1α及P-gp在结肠癌组织及多种细胞系中的表达
杨光磊1,胡岩芳2,赵 珊3,葛国庆1,胡延伟1,霍彩娟1,彭林涛1
(1.邢台市人民医院普外科,河北邢台 054031;2.邢台市人民医院神经内科,河北邢台 054031;3.河北医科大学第二医院肿瘤内科,石家庄 050000)
目的 探讨肿瘤低氧环境对低氧诱导因子1α(HIF-1α)及P-糖蛋白(P-gp)表达的影响及二者的相关性。方法 选取2013年6月至2015年6月邢台市人民医院58例结肠癌患者手术切除后标本,采用免疫组织化学法检测HIF-1α与P-gp在结肠癌组织中的表达情况,分析其与患者临床病理特征的关系;采用细胞爬片法检测常氧与低氧条件下HIF-1α与P-gp在结肠癌细胞株中的表达情况,并分析HIF-1α与P-gp表达的相关性。结果 58例患者结肠癌组织标本HIF-1α蛋白阳性表达率为58.62%,P-gp阳性表达率为46.55%;HIF-1α与P-gp阳性表达率在Dukes分期C+D期者均明显高于A+B期者,且有淋巴结转移者高于无淋巴结转移者,差异均有统计学意义(P<0.05);HIF-1α与P-gp的表达呈正相关(r=0.574,P<0.01)。同一细胞株中,低氧下HIF-1α及P-gp表达水平均高于常氧,差异均有统计学意义(P<0.01);而相同氧环境下不同结肠癌细胞株间HIF-1α及P-gp表达水平比较,差异均无统计学意义(P>0.05)。结论 HIF-1α与P-gp在结肠癌组织中存在过表达和共表达现象,在不同Dukes分期和是否伴随淋巴结转移等因素中二者阳性表达率存在明显差异,且HIF-1α与P-gp表达呈明显正相关;低氧可诱导结肠癌细胞中HIF-1α与P-gp蛋白表达水平的升高。
低氧诱导因子1α;P糖蛋白;结肠肿瘤
结肠癌是常见的临床恶性肿瘤之一,主要治疗手段有手术治疗、化学治疗及放射治疗等[1]。P-糖蛋白(P-glycoprotein,P-gp)是发现最早、研究最多的药物流出蛋白,其在癌细胞中的作用类似于排出泵,通过把癌细胞中化学治疗药物外排而降低药效[2-3]。P-gp对不同大小多种分子产生作用,其大多为疏水分子,部分存在于细胞膜上。在传统的恶性肿瘤治疗中,P-gp既能和药物结合,又能和腺苷三磷酸(ATP)相结合,过表达的P-gp蛋白会使肿瘤细胞产生对多种化学治疗药物的耐药现象,导致药物的效应减弱甚至消失。有资料报道,复发和难治的白血病P-gp会增加。结肠癌中肿瘤细胞的缺氧现象非常常见,在肿瘤细胞缺氧的条件下,体内氧调节的关键基因低氧诱导因子1(hypoxia-inducible factor 1,HIF-1)起重要作用。HIF-1在人和哺乳动物细胞内普遍存在,在常养下也会有表达,但合成的HIF-1蛋白很快就会被降解,只有在缺氧条件下HIF-1才能够稳定表达。HIF-1α与肿瘤的生长、浸润、转移等关系密切,且缺氧还可导致肿瘤细胞化疗疗效减低[4-5]。HIF-1α亚基在翻译后就会被降解,因此,在正常氧饱和下不能检测到亚基的表达,但在缺氧情况下,亚基的降解会被抑制。目前,关于HIF-1α与P-gp相互作用参与结肠癌发生及治疗过程的研究较少。故本研究通过免疫组织化学技术观察结肠癌组织标本中HIF-1α与P-gp的表达和分布情况,研究HIF-1α与P-gp在结肠癌组织及细胞系中的表达及相关性,进而探讨肿瘤低氧环境对HIF-1α及P-gp表达的影响及二者表达的变化关系,以期发现其在结肠癌发生中的作用。
1 资料与方法
1.1 一般资料 选取2013年6月至2015年6月邢台市人民医院58例结肠癌患者手术切除后标本,其中男30例,女28例;年龄25~80岁,平均(54.23±1.27)岁;左半结肠30例,右半结肠28例;Dukes分期:A期12例,B期19例,C期18例,D期9例;分化程度:高分化9例,中分化26例,低分化23例;其中19例伴随淋巴结转移。所有患者均确诊为结肠癌,术前均未接受放化疗等治疗。HCT-116、HT-29、LoVo、SW480均为本室保存人结肠癌传代细胞系。本研究通过该院伦理委员会审批。
1.2 方法
1.2.1 HIF-1α与P-gp在结肠癌组织中的表达检测 免疫组织化学法[6-7]:组织标本滴加3%过氧化氢,在37 ℃下孵育15 min,滴加1∶100比例稀释的一抗,4 ℃下孵育过夜;然后滴加二氨基联苯胺(DAB)显色液,以阳性显色充分而背景无杂色干扰为标准,显微镜下观察显色。结果判定:每张切片在高倍镜(×400)下随机选5个观测点,每个观测点计数200个细胞,计算显色棕黄色颗粒的阳性细胞百分率,阳性细胞百分率大于或等于1%判为阳性片,阳性细胞数百分率小于1%判为阴性片。
1.2.2 HIF-1α与P-gp在结肠癌细胞株中的表达检测 细胞爬片法[8-9]:取生长状态良好的细胞,进行常规培养,1 d后对照组继续在常氧下培养,实验组更换新鲜培养基后进行低氧处理;滴加3%过氧化氢,在37 ℃下孵育15 min,滴加1∶100比例稀释的一抗,4 ℃下孵育过夜;然后滴加DAB显色液。结果经图像分析软件Image-Pro Plus鉴定,得到蛋白阳性信号平均吸光度(A)值用来比较表达差异。
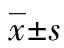
2 结 果
2.1 结肠癌组织中HIF-1α与P-gp表达的免疫组织化学结果 HIF-1α蛋白主要在结肠癌细胞细胞质及细胞核中表达,见图1。P-gp主要在结肠癌细胞细胞质及细胞膜中表达,见图2。58份标本中,HIF-1α蛋白阳性表达率为58.62%(34/58),P-gp为46.55%(27/58),二者阳性表达率在Dukes分期C+D期者均明显高于A+B期者,差异均有统计学意义(P<0.05);有淋巴结转移者HIF-1α、P-gp阳性表达率高于无淋巴结转移者,差异均有统计学意义(P<0.05);二者表达均不受患者年龄、性别、肿瘤分化程度及肿瘤位置的影响(P>0.05),见表1。
2.3 HIF-1α与P-gp在结肠癌细胞株中表达的免疫细胞化学染色结果 HIF-1α与P-gp在结肠癌HCT-116、HT-29、LoVo、SW480等4种细胞株中均有表达。常氧下二者表达都很弱,低氧处理后二者表达明显增强;同一细胞株中,低氧下HIF-1α及P-gp表达水平均高于常氧,差异均有统计学意义(P<0.01);而相同氧环境下不同结肠癌细胞株间HIF-1α及P-gp表达水平比较,差异均无统计学意义(P>0.05)。
2.2 结肠癌组织中HIF-1α与P-gp表达的相关性 HIF-1α与P-gp表达呈正相关(r=0.574,P<0.01),见表2。

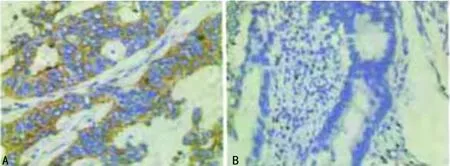
A:细胞质;B:细胞核
图1 HIF-1α蛋白在结肠癌细胞细胞质及细胞核中的表达
A:细胞质;B:细胞核
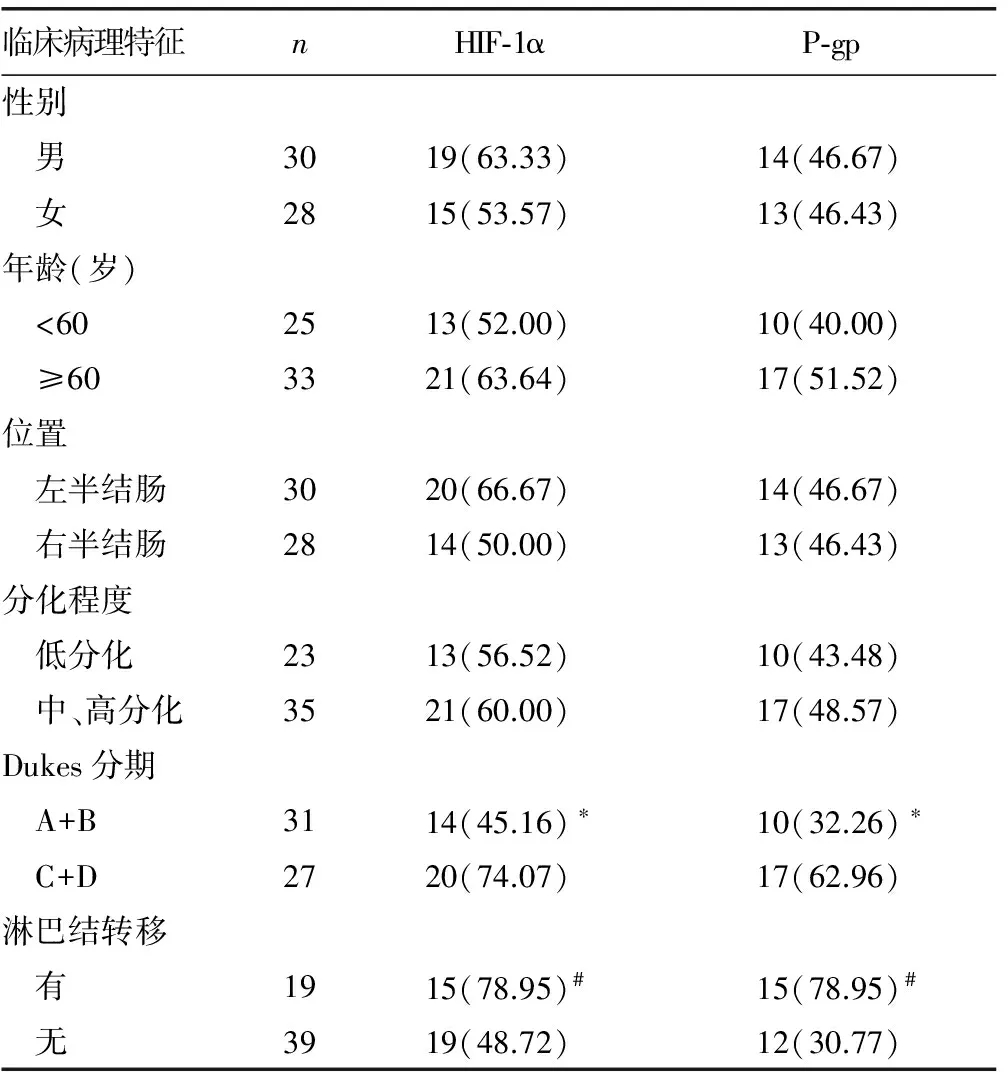
图2 P-gp在结肠癌细胞细胞质及细胞膜中的表达
*:P<0.05,与Dukes分期C+D期比较;#:P<0.05,与无淋巴结转移比较
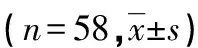
表3 常氧及低氧条件下HIF-1α与P-gp在结肠癌细胞中的表达
*:P<0.01,与常氧下相同结肠癌细胞比较
3 讨 论
结肠癌的发病主要和高脂肪、低膳食纤维饮食相关,其慢性炎症会使肠癌的发生率比一般人群高。而缺氧的结肠癌,会使肿瘤细胞发生改变,不仅自身存活率增加,还会对其他药物产生耐药性,影响结肠癌的治疗效果。HIF-1在1992年被发现广泛存在于哺乳动物和人体细胞中,由HIF-1α和HIF-1β两个亚单元构成[10]。HIF-1β主要存在于细胞核和细胞质中,而HIF-1α仅在缺氧条件下出现在细胞核中,常氧下则迅速降解,因此HIF-1α成为细胞缺氧情况下调控基因表达的主要转录因子之一[11-12]。目前来看,相当多的HIF-1α抑制药物效果比较弱,只能抑制肿瘤暂时的生长。据报道,用一种小分子抑制剂把前列腺癌细胞中的HIF-1α表达阻止后,它对细胞毒性药物的化疗效果提高[13]。因此,研究HIF-1α对肿瘤细胞的生长、浸润、转移和治疗的意义重大。P-gp蛋白是一个比较常见的保护细胞免受外来有害分子入侵的分子泵,是一种跨膜糖蛋白,具有能量依赖性“药泵”功能,又能和其他药物有效结合,通过把癌细胞中化学治疗药物外排而降低药效[13-14]。本课题通过研究HIF-1α与P-gp在结肠癌组织及细胞系中的表达及相关性,探讨肿瘤低氧环境对HIF-1α及P-gp表达的影响及二者表达的变化关系,以期发现其在结肠癌发生中的作用。
本研究结果显示,HIF-1α蛋白主要在结肠癌细胞细胞质及细胞核中表达,P-gp亦主要在结肠癌细胞细胞质及细胞膜中表达。在58例患者结肠癌组织标本中,HIF-1α蛋白阳性表达率为58.62%,P-gp为46.55%,二者阳性表达率在Dukes分期C+D期者均明显高于A+B期者(P<0.05);有淋巴结转移者HIF-1α、P-gp阳性表达率高于无淋巴结转移者(P<0.05)。表明可能由于P-gp的高表达,引起肿瘤化学治疗疗效降低,可导致肿瘤具有较强的浸润与转移能力[15]。因此,在临床监测结肠癌进展及转移时,可以把HIF-1α与P-gp的表达情况作为的一个重要指标[16]。
为进一步明确HIF-1α与P-gp在结肠癌中所起到的作用,本研究通过免疫细胞化学染色在常氧及低氧培养条件下检测4种结肠癌细胞株中HIF-1α与P-gp的表达情况,探讨肿瘤低氧环境对HIF-1α及P-gp表达的影响及二者表达的变化关系。结果显示:HIF-1α与P-gp在结肠癌HCT-116、HT-29、LoVo、SW480细胞株中均有表达。常氧下二者表达都很弱,低氧处理后二者表达均明显增强。同一细胞株中,低氧下HIF-1α及P-gp表达水平均高于常氧(P<0.01);而相同氧环境下,不同结肠癌细胞株间HIF-1α及P-gp表达水平无明显差异(P>0.05)。说明低氧可以诱导结肠癌细胞株HIF-1α与P-gp的表达水平上升[17]。相关性分析结果显示,HIF-1α与P-gp表达呈正相关(r=0.574,P<0.01),说明HIF-1α与P-gp共同参与了结肠癌的生长、转移,可能存在一定的相互作用关系[18]。
综上所述,HIF-1α与P-gp在结肠癌组织中存在过表达和共表达现象,在不同Dukes分期和是否伴随淋巴结转移等因素中二者阳性表达率有明显差异,且二者表达呈明显正相关;低氧可以诱导结肠癌细胞中HIF-1α与P-gp蛋白水平表达升高,HIF-1α可能通过与P-gp直接或间接地相互作用而参与结肠癌的发生。
[1]Lu Y,Yu LQ,Zhu L,et al.Expression of HIF-1and P-gp in non-small cell lung cancer and the relationship with HPV infection[J].Oncol Lett,2016,12(2):1455-1459.
[2]郭靖,尚杨杨,汪荣泉.结直肠癌及缺氧的结直肠癌细胞中HIF-1α与miRNA-200b表达的相关性[J].第三军医大学学报,2016,13(6):545-549.
[3]Goossens-Beumer IJ,Derr RS,Buermans HP,et al.MicroRNA classifier and nomogram for metastasis prediction in colon cancer[J].Cancer Epidemiol Biomarkers Prev,2015,24(1):187-197.
[4]Ohlsson L,Hammarström ML,Lindmark G,et al.Ectopic expression of the chemokine CXCL17 in colon cancer cells[J].Br J Cancer,2016,114(6):697-703.
[5]Fan R,Hou WJ,Zhao YJ,et al.Overexpression of HPV16 E6/E7 mediated HIF-1α upregulation of GLUT1 expression in lung cancer cells[J].Tumor Biol,2016,37(4):4655-4663.
[6]张宁.AEG-1、β-catenin和LEF-1在人结肠癌组织中的表达及其临床意义[D].郑州:郑州大学,2015.
[7]Chen EC,Karl TA,Kalisky T,et al.KIT signaling promotes growth of colon xenograft tumors in mice and is up-regulated in a subset of human colon cancers[J].Gastroenterology,2015,149(3):705-717.
[8]秦珍珠,王丹,张玉文.结肠癌组织中环氧合酶-2和低氧诱导因子-1α的表达及其临床意义[J].社区医学杂志,2016,29(10):731-738.
[9]Poulin P,Chen YH,Ding X,et al.Prediction of drug distribution in subcutaneous xenografts of human tumor cell lines and healthy tissues in mouse:application of the tissue composition-based model to antineoplastic drugs[J].J Pharm Sci,2015,104(4):1508-1521.
[10]Ricciardelli C,Lokman NA,Cheruvu S,et al.Transketolase is upregulated in metastatic peritoneal implants and promotes ovarian cancer cell proliferation[J].Clin Exp Metastasis,2015,32(5):441-455.
[11]SéhédicD,CikankowitzA,HindréF,etal.Nanomedicinetoovercomeradioresistanceinglioblastomastem-likecellsandsurvivingclones[J].TrendsPharmacol Sci,2015,36(4):236-252.
[12]Koo GB,Morgan MJ,Lee DG,et al.Methylation-dependent loss of RIP3 expression in cancer represses programmed necrosis in response to chemotherapeutics[J].Cell Res,2015,25(6):707-725.
[13]毛允义,江先汉,杨盛帮,等.PEDF下调HIF-1α抑制前列腺癌细胞侵袭转移的机制[J].实用医学杂志,2015,31(16):2605-2607.
[14]Zhang W,Shi X,Peng Y,et al.HIF-1 promotes epithelial-mesenchymal transition and metastasis through direct regulation of ZEB1 in colorectal cancer[J].PLoS One,2015,10(6):e0129603.
[15]Kim W,Youn HS,Seong KM,et al.PIM1-activated PRAS40 regulates radioresistance in non-small cell lung cancer cells through interplay with FOXO3a,14-3-3 and protein phosphatases[J].Radiat Res,2016,176(5):539-552.
[16]Yeh CC,Hsu CH,Shao YY,et al.Integrated stable isotope labeling by amino acids in cell culture (SILAC) and isobaric tags for relative and absolute quantitation (iTRAQ) quantitative proteomic analysis identifies galectin-1 as a potential biomarker for predicting sorafenib resistance in liver cancer[J].Mol Cell Proteomics,2015,14(6):1527-1545.
[17]Liao MY,Kuo MY,Lu TY,et al.Generation of an anti-EpCAM antibody and epigenetic regulation of EpCAM in colorectal cancer[J].Int J Oncol,2015,46(4):1788-1800.
[18]石晓明,吴胜春,唐雷,等.水通道蛋白-5与多药耐药因子在结肠癌组织中的表达及其关系[J].重庆医学,2015,44(5):644-646.
Expressions of HIF-1α and P-gp in colon carcinoma tissues and cell lines under hypoxic conditions
YangGuanglei1,HuYanfang2,ZhaoShan3,GeGuoqing1,HuYanwei1,HuoCaijuan1,PengLintao1
(1.DepartmentofGeneralSurgery,XingtaiPeople′sHospital,Xingtai,Hebei054031,China;2.DepartmentofNeurology,XingtaiPeople′sHospital,Xingtai,Hebei054031;3.DepartmentofOncology,theSecondHospitalofHebeiMedicalUniversity,Shijiazhuang,Hebei050000,China)
Objective To investigate the effects of hypoxic conditions on expressions of hypoxia-inducible factor 1α (HIF-1α) and P-glycoprotein (P-gp),and the relationship between HIF-1α and P-gp.Methods Tumor tissues from 54 cases of patients with colonic neoplasm in Xingtai People′s Hospital were selected after operation from June 2013 to June 2015.The expressions of HIF-1α and P-gp in colonic tumor tissues were detected by using immunohistochemistry,and their correlations to clinical and pathologic features were analysed.The expressions of HIF-1α and P-gp in colonic tumor cell lines under normoxia and hypoxia conditions were detected by using cell smear method,and correlation between HIF-1α expression and P-gp expression was analysed.Results Among tumor tissues from 58 cases of patients with colonic neoplasm,the positive rate of HIF-1α expression was 58.62%,and that of P-gp expression was 46.55%.The positive rates of HIF-1α and P-gp expressions of patients on the Dukes stage C+D were significantly higher than those of patients on A+B phase (P<0.05).Additionally,the positive rates of HIF-1α and P-gp expressions of patients with lymphatic metastasis were significantly higher than those of patients without lymphatic metastasis (P<0.05).The HIF-1α expression was positively correlated with the P-gp expression (r=0.574,P<0.01).For the same cell lines,the expression levels of HIF-1α and P-gp under hypoxia condition were significantly higher than those under normoxia condition,there were statistically significant differences (P<0.01).While,under the same oxygen conditions,no statistically significant difference was found in expression levels of HIF-1 and P-gp among different colonic tumor cell lines (P>0.05).Conclusion Overexpression and coexpression of HIF-1α and P-gp exist in colon cancer.The expression levels of HIF-1α and P-gp in patients with different Dukes stages and patients with or without lymph node metastasis are significantly different,and positive correlation is observed between the expression of HIF-1α and P-gp.Hypoxia condition can induce an increase in expressions of HIF-1α and P-gp in colonic tumor cells.
hypoxia-inducible factor 1α;P-glycoprotein;colonic neoplasms
2016年度重庆市出版专项资金资助项目
杨光磊(1982-),主治医师,硕士,主要从事结肠癌化疗耐药和抗凋亡机制方面的研究。
��·临床研究
10.3969/j.issn.1671-8348.2017.19.020
R735.4
A
1671-8348(2017)19-2659-03
2017-02-19
2017-04-24)



